维生素C体外抑制SVCV入侵鲤鱼上皮瘤细胞的初步研究
2022-01-18卢玉婷刘芸娜闫子豪汪惠庆李月红
刘 佳 , 卢玉婷 , 刘芸娜 , 闫子豪 , 汪惠庆 , 李月红
(吉林农业大学动物科学技术学院 , 吉林 长春 130118)
鲤春病毒血症病毒(Spring viremia of carp virus,SVCV)引起的鲤春病毒血症(Spring viremia of carp,SVC)是一种具有高致病性、高死亡率和高传染性的疾病,该病危害多种鱼类,并且引起的鱼类死亡率最高可达90%[1]。SVCV属于弹状病毒科,水泡病毒属,其基因组为线性单股负链RNA[2]。SVCV以鱼鳃为入口感染侵入鱼体中,入侵鱼体后迅速地在鱼体内增殖并导致鱼体产生病变,主要表现为病鱼皮肤发黑并出现斑点状出血点,眼球凸出,鳃、肌肉呈现红色,鱼鳔充血,腹部积水和泻殖孔发炎等[3]。SVCV暴发通常会导致养殖过程中鲤科鱼类的大量发病和死亡,造成重大经济损失。但由于人们对这种病原体了解甚少,目前并未开发出针对SVCV的疫苗。此外,虽然目前尚未有报道称SVCV对人类存在危害,但是有机药物残留导致的食品安全问题对人体健康的影响亦不可小觑。因此,寻求一种积极有效的防治方法势在必行。维生素C是鱼类必需的营养物质,具有促进鱼类生长、减少组织氧化损伤、提高鱼类抗应激能力、增强鱼类抵抗病原侵袭能力并提高特异性免疫功能等作用,并且维生素C对人体无害[4-5]。有研究表明,在金头鲷饲料中添加适量的维生素C能提高金头鲷的免疫力;长期投喂大西洋鲑幼鱼缺乏维生素C的饲料,幼鱼的死亡率显著升高; 投喂含有维生素C的饲料能改善杂交鲟幼鱼的肌肉品质,增强鱼体的抗氧化性能并且不改变杂交鲟幼鱼的生长性能和肌肉营养成分[4,6]。因此,本试验选择维生素C对SVCV进行体外抑制试验,以期能够为SVCV防治药物的研发提供新的思路和参考。
1 材料与方法
1.1 材料 鲤鱼上皮瘤细胞(Epithelioma papulosum cyprini,EPC),Gibco M199细胞培养基(北京 Solarbio公司),10%胎牛血清,1%双抗(青霉素和链霉素),于4 ℃保存。维生素C溶液:无血清培养基将其稀释成20、40、60 μmol/L和80 μmol/L,4 ℃保存。二甲基亚砜(Dimethyl sulfoxide,DMSO)、噻唑蓝[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]溶液和胰酶消化液等,均购自长春梦怡美生物科技有限公司;4′,6-二脒基-2-苯基吲哚 (4′,6-diamidino-2-phenylindole,DAPI)试剂,购自武汉塞维尔生物;活性氧(ROS)试剂,购自上海碧云天生物技术有限公司。EPC、SVCV 为本实验室保藏。
1.2 方法
1.2.1 病毒滴度的测定 将EPC接种于96孔板中,在27 ℃、5%CO2的细胞培养箱中培养细胞密度至80%~90%时接入病毒,将病毒原液依次稀释10倍加入细胞中,浓度分别为10-1~10-11,每个浓度做8个重复,每孔加入100 μL,观察细胞病变情况,记录出现细胞病变效应(Cytopathic effect,CPE)现象的孔数。根据Reed-Muench法计算半数细胞感染量(TCID50)。
1.2.2 细胞活性的测定 将EPC接种于3个96孔 板中,在27 ℃、5%CO2的细胞培养箱中培养24 h,将细胞培养液除去,第1个孔板中将维生素C按照0、20、40、60 μmol/L和80 μmol/L的浓度加入细胞中,培养24 h;第2个孔板中将SVCV按照10-1、10-3、10-5、10-7的浓度加入细胞中,培养24 h; 第3个孔板中,先将维生素C按照0、20、40、60 μmol/L和80 μmol/L的浓度加入细胞中,梯度降温至17 ℃培养24 h,然后再加入浓度为10-1的SVCV培养24 h;最后用MTT法测量490 nm处的OD值,计算不同作用条件下的细胞活性。
1.2.3 维生素C对SVCV的抑制作用 将EPC接种于96孔板中,在27 ℃、5%CO2的细胞培养箱中培养24 h;将0、20、40、60 μmol/L和80 μmol/L的维生素C接入孔板中,梯度降温至17 ℃培养24 h,然后加入浓度为10-1的SVCV,继续培养24 h,最后用MTT法测量490 nm处的OD值,计算维生素C对SVCV的抑制作用。
1.2.4 DAPI染色 将EPC接种于24孔板中,在27 ℃、 5%CO2的细胞培养箱中培养24 h,将80 μmol/L的维生素C加入细胞中,3个重复,其他孔分别加入浓度为0、10-1、10-3、10-5、10-7的SVCV,每个浓度3个重复,梯度降温至17 ℃培养24 h,去除维生素C和SVCV并用PBS清洗2遍,最后加入DAPI溶液,避光培养30 min后,去除DAPI溶液,用PBS清洗2遍并加入PBS,用荧光倒置显微镜进行拍摄。
1.2.5 活性氧测定 将EPC接种于24孔板中,在27 ℃、 5%CO2的细胞培养箱中培养24 h,将0、20、40、60 μmol/L和80 μmol/L的维生素C加入细胞中,每个浓度3个重复,梯度降温至17 ℃培养24 h,然后加入浓度为10-1的SVCV,继续培养24 h,去除维生素C和SVCV后用PBS清洗2遍,最后加入含有DCFH-DA的M199培养基,避光培养30 min后,去除含有DCFH-DA的培养基后用PBS清洗2遍并加入PBS,用荧光倒置显微镜进行拍摄。
2 结果
2.1 病毒滴度测定 结果见表1。由公式计算可得TCID50=10-8.54,即当SVCV稀释度为10-8.54时,可使孔内50%的细胞发生病变。
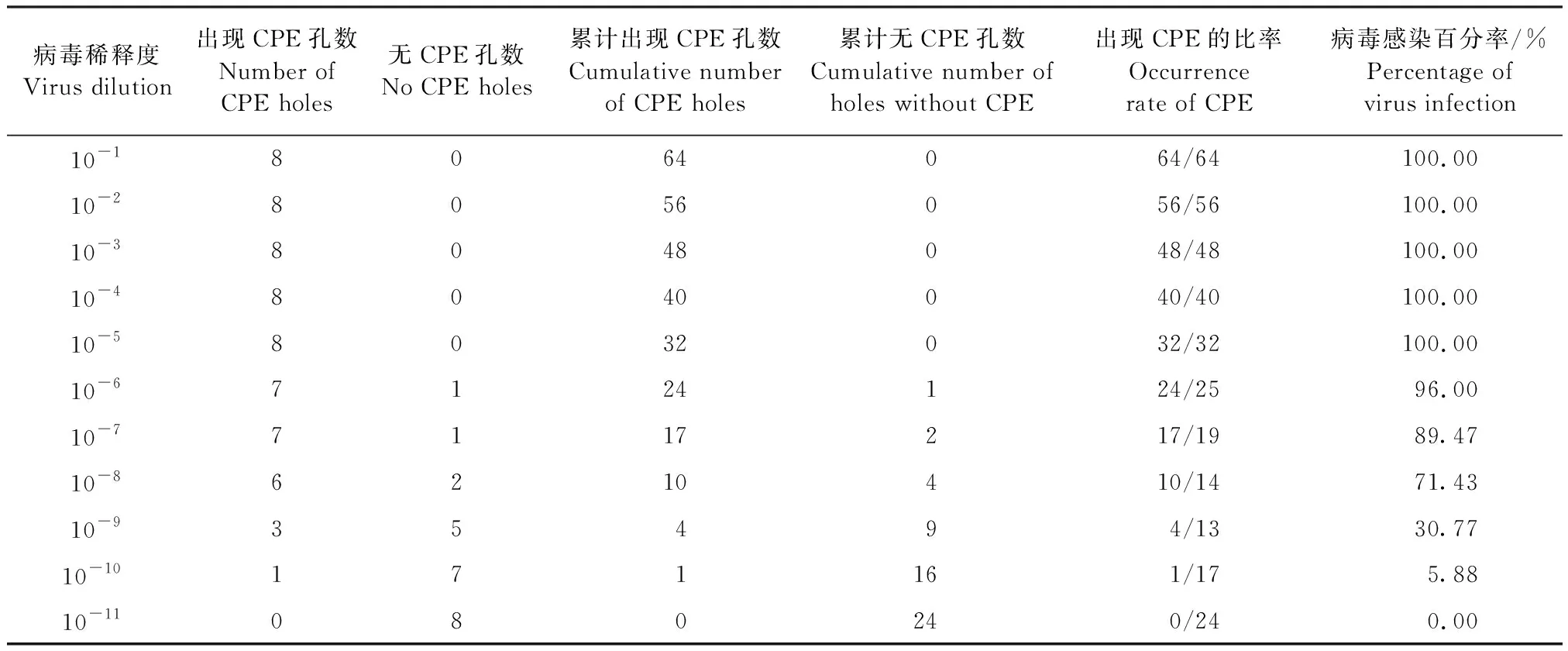
表1 病毒滴度的测定结果Table 1 Results of virus titer test
2.2 细胞活性测定 结果见图1。从图1可知,维生素C对EPC的细胞活性无显著影响 (P>0.05);SVCV能够显著降低EPC的细胞活性,在浓度为10-1时对细胞活性的影响最为显著(P<0.05);而维生素C能够显著改善SVCV对细胞活性的影响。
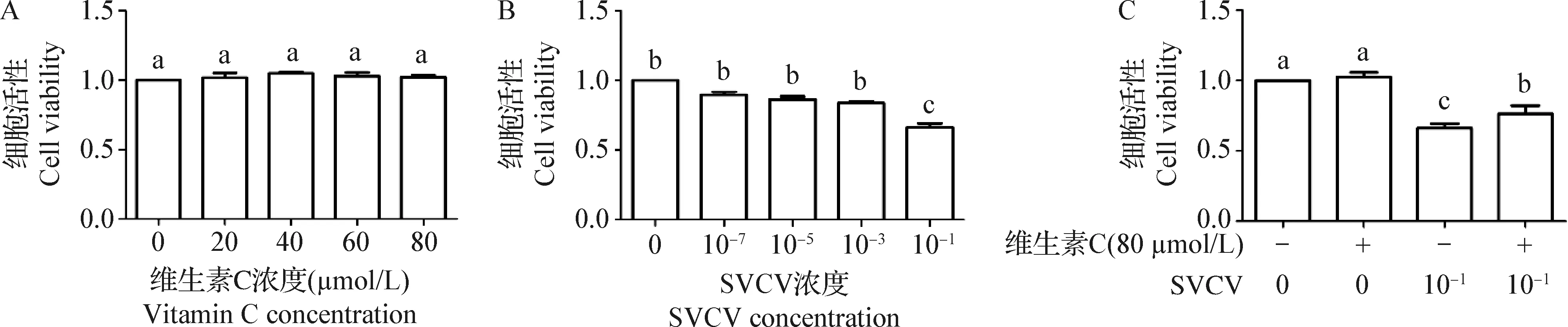
图1 细胞活性的测定Fig.1 Cell viability assayA:维生素C对细胞活性的影响; B:SVCV对细胞活性的影响; C: 维生素C和SVCV对细胞活性的影响不同字母表示差异显著(P<0.05);下同A: Effect of vitamin C on cell viability; B: Effect of SVCV on cell viability; C:Effect of vitamin C and SVCV on cell viability Different letters indicated significant difference (P<0.05). The same as below
2.3 维生素C对SVCV的抑制效果测定 结果见表2。从表2可知,不同浓度的维生素C均对SVCV有一定的抑制作用,在本试验中,80 μmol/L的维生素C对SVCV的抑制作用最强。
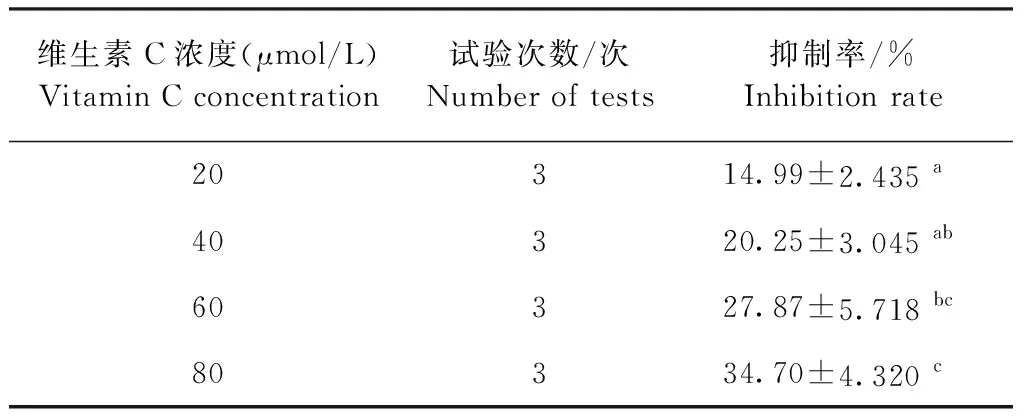
表2 维生素C对SVCV抑制结果Table 2 Inhibitory results of Vitamin C on SVCV
2.4 DAPI染色 由图2可知,80 μmol/L的维生素C对EPC无显著影响,而浓度为10-1的SVCV对细胞影响最为显著,随着SVCV浓度的增高,病毒对EPC的伤害越大。
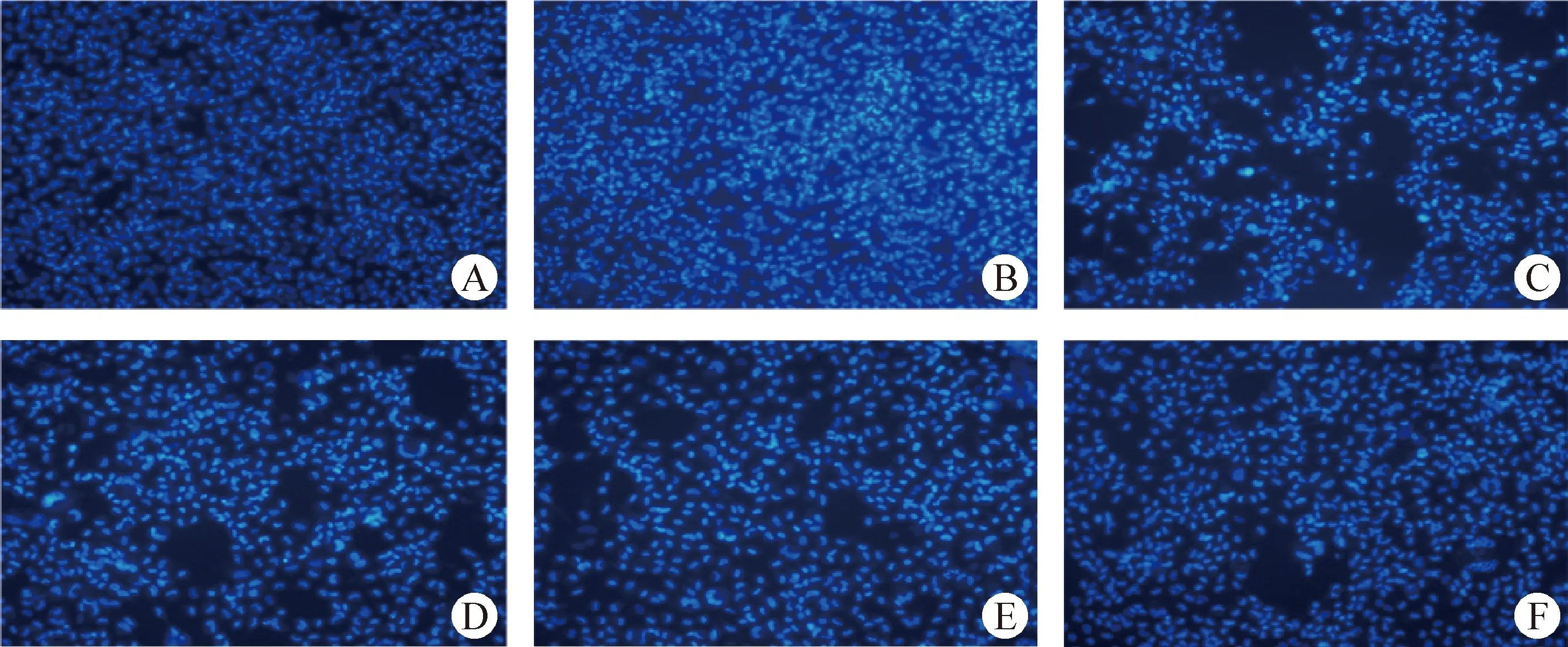
图2 DAPI染色 (200×)Fig.2 DAPI staining (200×)A:对照组; B:80 μmol/L维生素C组; C:10-1 SVCV组; D:10-3 SVCV组; E:10-5 SVCV组; F:10-7 SVCV组A:Control group; B:80 μmol/L vitamin C group; C:10-1 SVCV group; D:10-3 SVCV group; E:10-5 SVCV group; F:10-7 SVCV group
2.5 活性氧测定 由图3可知,SVCV使EPC产生明显的氧化应激,而维生素C能够显著改善SVCV引起的ROS的产生。
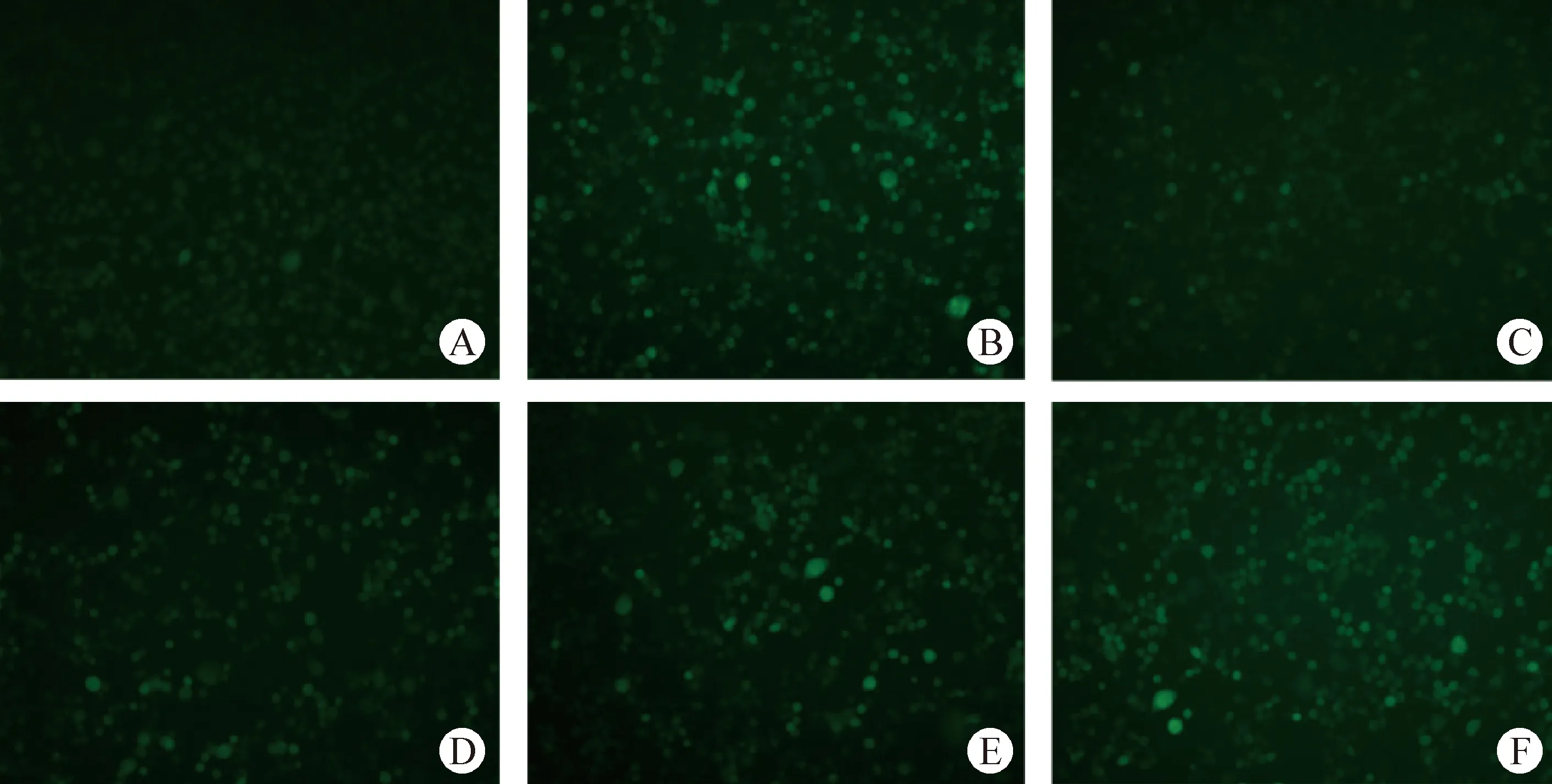
图3 ROS检测 (200×)Fig.3 Determination of ROS (200×)A:对照组; B:SVCV组; C:SVCV+80 μmol/L维生素C组; D:SVCV+60 μmol/L维生素C组; E:SVCV+40 μmol/L维生素C组; F:SVCV+20 μmol/L维生素C组A:Control group; B:SVCV group; C:SVCV+80 μmol/L vitamin C group; D:SVCV+60 μmol/L vitamin C group; E:SVCV + 40 μmol/L vitamin C group; F:SVCV + 20 μmol/L vitamin C group
3 讨论
为了探讨维生素C体外抑制SVCV感染EPC的能力,本试验构建体外EPC模型,用MTT法测定添加维生素C和SVCV 对EPC活性的影响。本试验结果表明,维生素C对细胞活性无显著影响,SVCV对细胞活性影响显著,其中SVCV浓度为10-1时,明显降低细胞活性。从维生素C抑制SVCV感染细胞和维生素C缓解SVCV引起的氧化应激两方面讨论维生素C对SVCV作用效果,本试验结果表明,80 μmol/L 的维生素C对SVCV具有最显著的抑制效果并能降低SVCV引起的氧化应激。此外,维生素C对SVCV的抑制率随着维生素C浓度的增高而增高,在80 μmol/L时抑制率最高,达34.70%。
在细胞正常的生长代谢过程中会持续的产生活性氧(ROS),活性氧对大部分细胞都有毒性[7]。大量的研究表明,维生素C能够增强鱼体的抗氧化能力,包括军曹鱼[8]、青鱼[9]、黄鳝[10]、圆斑星鲽幼鱼[11]、虹鳟[12]和杂交鲟[4]等。此外,维生素C还可促进鱼类生长,缓解环境等不良应激反应,提高鱼体自身免疫力[13-15]。在本试验中,维生素C能明显缓解SVCV引起的细胞氧化应激。
目前关于SVCV的感染机理尚不清楚,也未研制出有效的治疗性药物和预防性疫苗。由SVCV暴发导致的经济损失数目巨大,所以研制出有效的治疗药物和预防疫苗以及对于该病毒的入侵机理的研究迫在眉睫。维生素C作为动物生长、生产及维持正常生理功能必不可少的一种营养物质,在EPC上对SVCV具有显著的抑制效果,且维生素C对鱼体中粗蛋白、粗脂肪、粗灰分和水分含量没有显著性影响[16-18]。本试验选定维生素C作为试验对象,探究维生素C对SVCV的抑制效果,以期为SVCV的防治提供理论基础,开发新的思路,为生产高效的药物及疫苗提供科学依据。
