血液嗜碱性粒细胞CD16和CD32在慢性气道炎症性疾病中的表达及其临床意义
2022-01-18吴久纯耿诗洋谷芳秋何韶衡张慧云刘敬禹
吴久纯,耿诗洋,谷芳秋,何韶衡,张慧云,刘敬禹*
1锦州医科大学附属第三医院呼吸与危重症医学科,辽宁锦州 121001;2锦州医科大学附属第一医院变态反应与临床免疫研究中心,辽宁锦州 121001;3锦州医科大学护理学院,辽宁锦州 121001
支气管哮喘(简称哮喘)和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)都属于慢性气道炎症性疾病,也是临床上常见的呼吸系统疾病。流行病学研究显示,哮喘与COPD的发病率分别为17.6%和47.1%,但哮喘合并COPD的发病率则高达35%并呈逐年上升趋势[1]。全球哮喘防治倡议(global asthma initiative,GINA)/慢性阻塞性肺疾病全球倡议(global initiative on chronic obstructive pulmonary disease,GOLD) (2017版)指出,哮喘-慢性阻塞性肺疾病重叠(asthma-chronic obstructive pulmonary disease overlap,ACO)表现为气道持续性气流受限,同时表现出哮喘和COPD的症状,可能是由不同病理生理基础导致的不同临床表现的气道炎症反应[2]。截至目前,ACO的病因尚未明确,早期便有荷兰假说、英国假说对ACO的发病机制做了详尽阐述,但这些假说的有效性仍存在争议[3]。遗传、肺发育不全、病毒感染、气道高反应性等可能是ACO的高危因素。起初,哮喘症状即反复发作的喘息、气急是ACO的主要症状,而后随即出现COPD症状,表明ACO的一般特征是先出现哮喘症状而后出现COPD症状[4]。哮喘多数是由过敏原引起的IgE介导的变态反应性疾病,哮喘晚期,嗜碱性粒细胞迅速渗入受影响的肺组织中,然后被内源性激动剂激活,从而释放相关细胞因子及炎性介质[5]。嗜碱性粒细胞和组织中的肥大细胞是参与变态反应性疾病的核心效应细胞[6],但嗜碱性粒细胞在健康人外周血中含量极低[7],易被忽视。研究发现,人嗜碱性粒细胞的特异性表面标志物包括CD203c、CD13、CD63、CD164等,其在疾病发病过程中起着关键作用[7]。然而,目前对人嗜碱性粒细胞CD16和CD32在呼吸系统疾病中的作用研究甚少。本研究探讨了血液嗜碱性粒细胞CD16和CD32在ACO、COPD中的表达及其临床意义,以期为临床寻找新的治疗靶点提供理论依据。
1 资料与方法
1.1 主要试剂及仪器 PE标记小鼠抗人CCR3抗体、FITC标记小鼠抗人CD123抗体、PerCP标记小鼠抗人HLA-DR抗体、APC/Cy7标记小鼠抗人CD16抗体、APC标记小鼠抗人CD32抗体、APC/Cy7标记小鼠IgG1 κ同型抗体、APC标记小鼠IgG2b κ同型抗体、去死细胞染料、FcR受体阻断剂、红细胞裂解液购自美国Biolegend公司;人TNF-α ELISA试剂盒购自美国Invitrogen公司。FACS Verse流式细胞仪购自美国BD公司;水浴恒温振荡器购自上海精宏实验设备有限公司。
1.2 研究对象 选取2019年12月-2020年12月就诊于锦州医科大学附属第三医院的COPD、ACO患者以及招募的健康志愿者作为研究对象,分别设为COPD组、ACO组和健康对照组。研究对象纳入标准:年龄≥18岁;至少1个月内未发生过呼吸道感染,未使用全身糖皮质激素、支气管扩张剂、抗生素及免疫抑制剂。排除标准:病情较重,因呼吸衰竭等疾病无法完成肺功能检测;患有肝炎、结核等传染性疾病及其他严重全身性疾病。COPD诊断标准符合2017年GOLD指南[8],即有长年咳嗽、咳痰及喘息等症状,吸烟、职业粉尘接触等相关风险因素,肺功能提示吸入支气管舒张剂后第1秒用力呼气末容积(forced end-expiratory volume at 1 second,FEV1)/用力肺活量(forced vital capacity,FVC)固定比率<0.7。ACO诊断标准参照2017年西班牙发布的COPD指南(Spanish COPD Guidelines,GesCOPD)[9],符合COPD相关诊断标准且支气管舒张试验为阳性[10],即有咳、痰、喘等相关呼吸道症状,肺功能提示吸入支气管舒张剂后FEV1/FVC<0.7、FEV1较用药前增高≥12%且其绝对值增高≥200 ml。所有研究对象均签署知情同意书,本研究获得锦州医科大学附属第三医院伦理委员会审批(JYDSY-KXYJIEC-2020-012)。
1.3 资料收集 收集研究对象的性别、年龄、病史、发病年龄、体重指数(body mass index,BMI)及吸烟史等一般资料,并采集10 ml外周血于EDTA抗凝真空采血管中。
1.4 流式细胞仪检测外周血嗜碱性粒细胞富集群中CD16和CD32的表达 取外周血2 ml,1500 r/min离心10 min,血浆用于ELISA检测,然后用含2%胎牛血清和1%青链霉素的RPMI 1640培养基补全,吹打混匀,取120 μl于流式管中,加入1 μl去死细胞染料及3 μl人FcR受体阻断剂,室温避光孵育15 min;加入5 μl FITC标记小鼠抗人CD123抗体(1:4)、PerCP标记小鼠抗人HLA-DR抗体(1:4)、PE标记小鼠抗人CCR3抗体(1:4)、APC/Cy7标记小鼠抗人CD16抗体(1:4)、APC标记小鼠抗人CD32抗体(1:4),室温避光孵育15 min;加入1.5 ml红细胞裂解液吹打混匀,室温避光孵育12 min;1200 r/min离心6 min,弃上清;加入1 ml PBS,用移液枪吹打混匀;1200 r/min离心6 min,弃上清,加入300 μl PBS,流式细胞仪上机检测嗜碱性粒细胞富集群中CD16和CD32细胞的比例及平均荧光强度(mean fluorescence intensity,MFI),采用Flowjo 10.0软件分析数据。
1.5 ELISA检测血浆中TNF-α含量 根据TNF-α ELISA试剂盒说明书步骤检测血浆中TNF-α含量。
1.6 统计学处理 使用SPSS 13.0软件进行统计分析。符合正态分布的计量资料以表示,组间比较采用t检验或方差分析(F检验)或非参数Kruskal-WallisH分析,进一步两两比较采用SNK检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 三组一般资料比较 共纳入13名健康志愿者、11例COPD患者和28例ACO患者。三组性别、年龄、病史、发病年龄、BMI及吸烟史等一般资料比较,差异均无统计学意义(P>0.05,表1)。
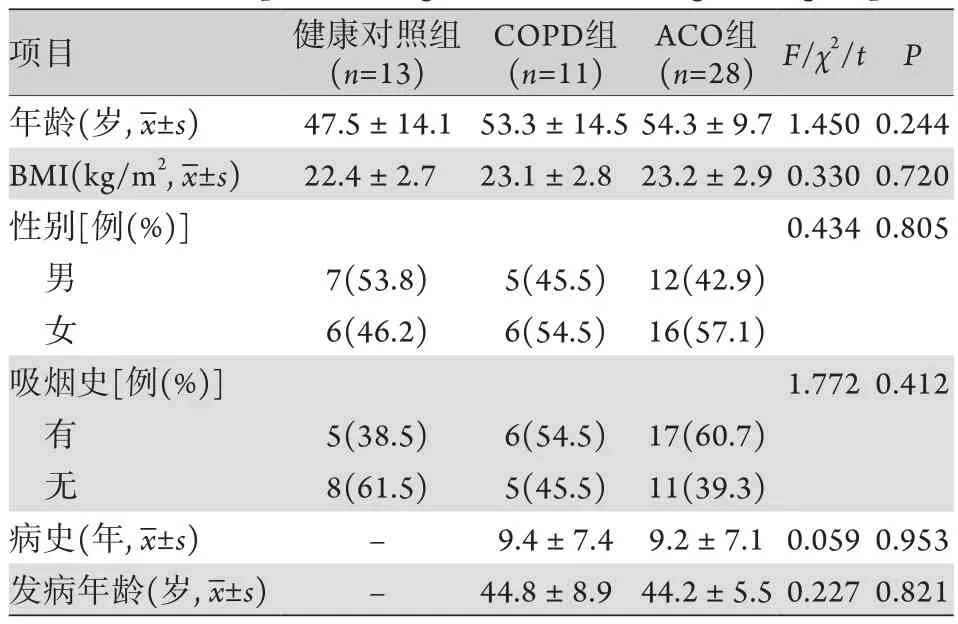
表1 三组一般资料比较Tab.1 Comparison of general data among three groups
2.2 三组外周血嗜碱性粒细胞富集群中CD16和CD32的表达情况 采用3种方法标记嗜碱性粒细胞,分别检测CD16和CD32在粒细胞群和单个核细胞群中的表达,结果显示,三组外周血粒细胞群中3种方法标记的CD16+嗜碱性粒细胞比例差异无统计学意义(P>0.05,图1)。与健康对照组相比,ACO组、COPD组外周血单个核细胞群中CD16+CCR3+细胞比例分别增高2.18倍和1.68倍(Z=-2.998,P=0.002;Z=-2.637,P=0.007),CD16+CD123+HLA-DR细胞比例分别增高1.13倍和0.96倍(Z=-3.026,P=0.002;Z=-2.868,P=0.003),CD16+CCR3+CD123+HLADR-细胞比例分别增高3.67倍和2.26倍(Z=-3.278,P=0.001;Z=-2.521,P=0.011,图1)。

图1 三组不同标记方法下外周血粒细胞群和单个核细胞群中CD16+细胞比例Fig.1 Proportion of CD16+ cells in peripheral blood granulocyte population and mononuclear cell population in three groups with different labeling methods
与健康对照组相比,COPD组外周血粒细胞群中CD32+CCR3+细胞、CD32+CCR3+CD123+HLADR-细胞比例分别增高4.67倍和3.79%(Z=-3.187,P=0.001;Z=-2.498,P=0.011),单个核细胞群中CD32+CD123+HLA-DR-细胞、CD32+CCR3+CD123+HLA-DR-细胞比例分别增高3.70%和3.33%(Z=-2.871,P=0.003;Z=-2.180,P=0.030),ACO组外周血粒细胞群中CD32+CD123+HLA-DR-细胞和CD32+CCR3+CD123+HLA-DR-细胞比例分别下降18.57%和20.89%(Z=-2.311,P=0.019;Z=-2.144,P=0.031,图2)。

图2 三组不同标记方法下外周血粒细胞群和单个核细胞群中CD32+细胞比例Fig.2 Proportion of CD32+ cells in peripheral blood granulocyte population and mononuclear cell population in three groups with different labeling methods
2.3 三组外周血嗜碱性粒细胞中CD16和CD32 MFI比较 流式细胞仪检测结果显示,在粒细胞群和单个核细胞群中,COPD组3种标记方法标记的CD16和CD32 MFI与健康对照组相比,差异无统计学意义(P>0.05,图3-4)。ACO组外周血粒细胞群中CCR3+细胞和CCR3+CD123+HLA-DR-细胞的CD32 MFI分别较健康对照组降低30.7%和37.31%(Z=-2.718,P=0.006;Z=-1.975,P=0.047,图4)。
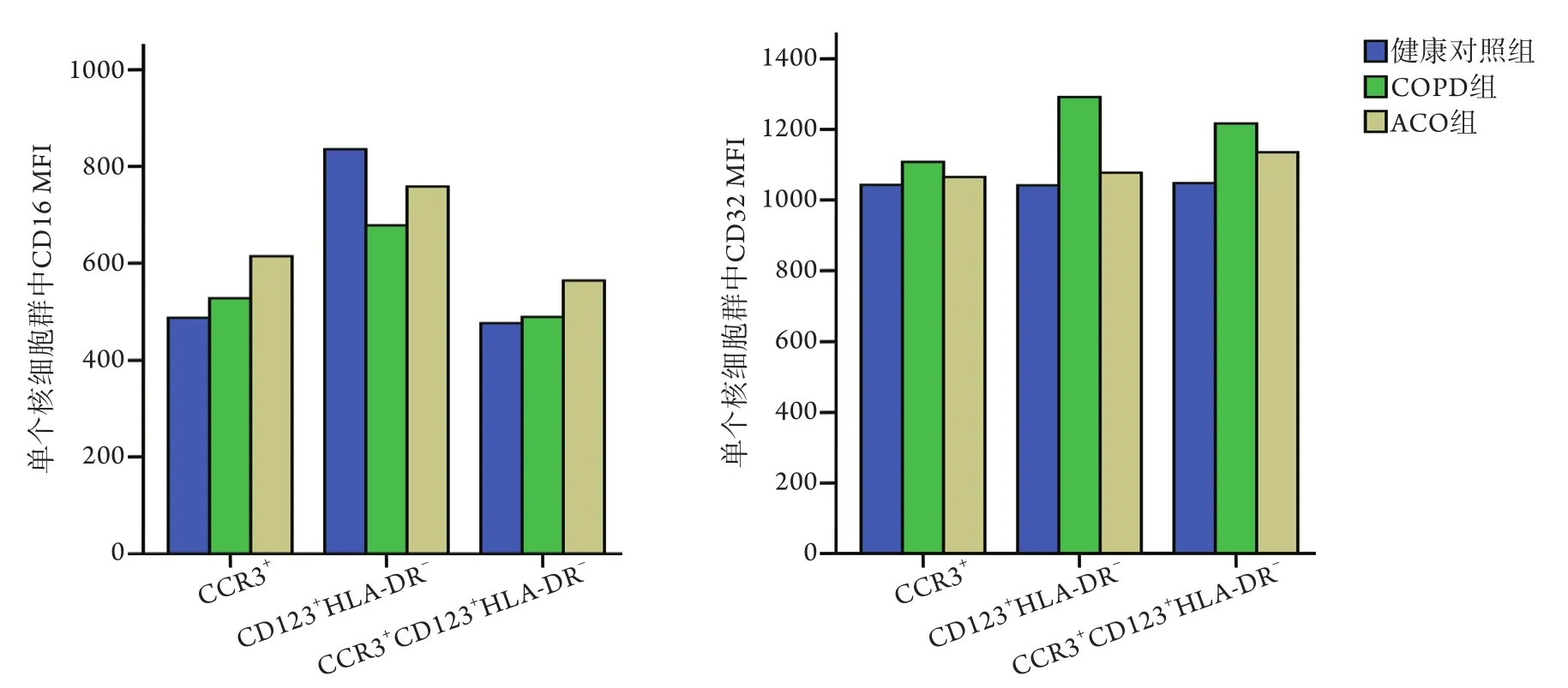
图3 三组不同标记方法下外周血单个核细胞群中嗜碱性粒细胞中CD16和CD32 MFIFig.3 MFI of basophil granulocyte CD16 and CD32 in peripheral blood mononuclear cell population of three groups with different labeling methods
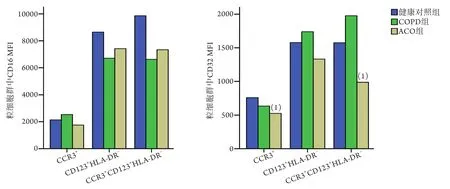
图4 三组不同标记方法下外周血粒细胞群中嗜碱性粒细胞中CD16和CD32 MFIFig.4 MFI of basophil granulocyte CD16 and CD32 in peripheral blood granulocytes population in three groups with different labeling methods
2.4 三组血浆TNF-α表达水平比较 ELISA检测结果显示,与健康对照组比较,ACO组血浆TNF-α表达水平增高2.02倍,差异有统计学意义(Z=-2.078,P=0.036);COPD组与健康对照组血浆TNF-α表达水平差异无统计学意义(P>0.05,图5)。
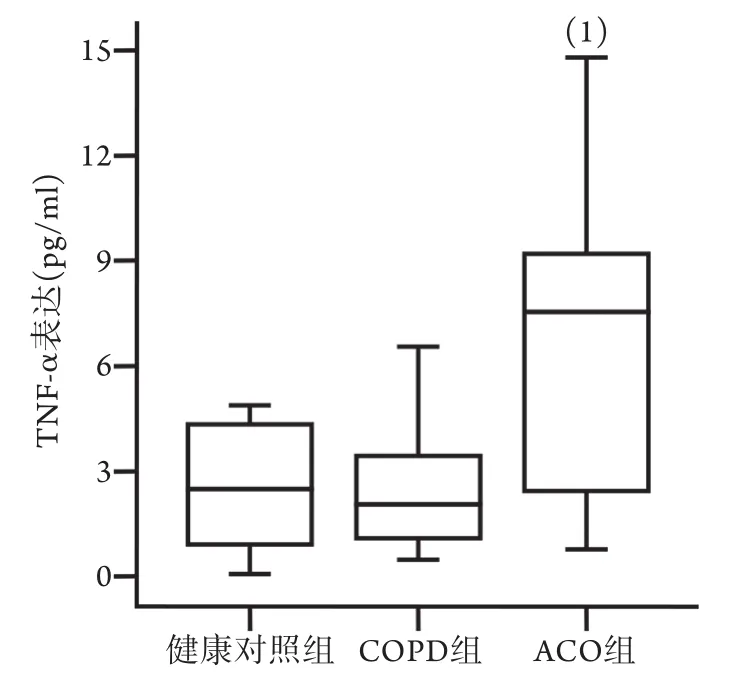
图5 三组血浆TNF-α表达水平比较Fig.5 Expression level of plasma TNF-α in ACO, COPD patients and healthy control subjects
3 讨 论
嗜碱性粒细胞由骨髓造血多能干细胞分化而来,逐渐成熟后进入血液循环,虽然所占比例不到1%,但在过敏性疾病中发挥至关重要的作用[7]。据报道,嗜碱性粒细胞可以表达多种受体,如补体、白细胞介素受体、前列腺素(prostaglandin,PG)受体、趋化因子以及免疫球蛋白Fc受体[11]。但目前对于嗜碱性粒细胞表面CD16和CD32的表达情况了解较少。本研究采用CCR3+[12]、CD123+HLADR-[13]和CCR3+CD123+HLA-DR-[14]3种方法标记嗜碱性粒细胞:其中CCR3+CD123+HLA-DR-标记的细胞为嗜碱性粒细胞[14];CCR3+在粒细胞群中标记嗜碱性粒细胞,在单个核细胞群中可标记少部分淋巴细胞[15];CD123+HLA-DR-在单个核细胞群中仅标记嗜碱性粒细胞[16],但在粒细胞群中可标记髓源性抑制细胞(MDSCs)[17]。最近研究发现,CD16是由两个同源亚单位ζ和γ通过二硫键连接形成的二聚体,与高亲和力的CD16受体特异性结合,从而介导炎症反应,清除免疫复合物[18]。本研究结果显示,ACO、COPD患者血液中CCR3+、CD123+HLA-DR-、CCR3+CD123+HLA-DR-单个核细胞群中CD16+细胞比例升高,而在粒细胞群中3种方法标记的CD16+细胞比例无明显差异。ACO、COPD患者单个核细胞群中CD16+CCR3+细胞比例分别增高2.18倍和1.68倍,可能源于淋巴细胞(而非嗜碱性粒细胞)CD16表达升高,但CD16+CD123+HLADR-和CD16+CCR3+CD123+HLA-DR-细胞比例明显升高,表明ACO、COPD两种疾病很可能通过嗜碱性粒细胞表达CD16而诱导发病,提示嗜碱性粒细胞可能是CD16拮抗剂发挥作用的靶细胞,这为后续ACO、COPD的临床治疗提供了新的方向。
嗜碱性粒细胞源的CD32是一种低亲和力的IgG受体(FcγRⅡ),包括FcγRⅡA、FcγRⅡB和FcγRⅡC 3个亚型,其中FcγRⅡA、FcγRⅡC为激活受体,FcγRⅡB为抑制受体[19],可以抑制IgE介导的过敏反应[20]。本研究结果显示,COPD患者血液中CD32+CD123+HLA-DR-细胞、CD32+CCR3+CD123+HLA-DR-细胞比例在单个核细胞群中增高,CD32+CCR3+细胞、CD32+CCR3+CD123+HLA-DR-细胞比例在粒细胞群中增高;ACO患者血液中CD32+CD123+HLA-DR-细胞和CD32+CCR3+CD123+HLA-DR-细胞比例在粒细胞群中降低,表明CD32在ACO、COPD中差异性表达,考虑原因为嗜碱性粒细胞可能通过表达不同亚型的CD32而致病。在粒细胞群和单个核细胞群中,COPD患者3种方法标记的嗜碱性粒细胞CD32 MFI与健康对照组比较无明显差异,而ACO患者血液粒细胞群中CCR3+细胞和CCR3+CD123+HLA-DR-细胞的CD32 MFI降低,进一步证实嗜碱性粒细胞CD32在不同疾病中的表达不同。因此,检测血液嗜碱性粒细胞CD32的表达可能有助于ACO、COPD的鉴别诊断,利于指导临床治疗。此外,ACO起初出现哮喘症状,而哮喘症状多因接触过敏原、冷空气后发生变态反应所致,考虑嗜碱性粒细胞通过表达CD32可能抑制该过敏反应,提示哮喘可能在ACO中占主导作用,本研究结果有助于理解嗜碱性粒细胞参与ACO、COPD发病的机制,进一步研究可建立小鼠模型探讨具体致病通路。
TNF-α是一种可以对炎症、感染和损伤迅速做出反应的细胞因子,早期参与细胞因子网络的启动进程,产生炎症反应的级联放大效应[21]。迟春天等[22]的研究发现,TNF-α是预测慢性炎症性疾病严重程度的潜在标志物,高水平的TNF-α可导致体内炎症加剧。ACO发病可能是由气道炎症反应、气道高反应性及气道结构破坏等多种因素共同导致的,其主要表现是同时具有COPD和哮喘相关的特征,但ACO患者较单纯COPD、哮喘患者临床症状重、合并症多且急性加重频繁[23]。本研究结果显示,ACO患者血浆中TNF-α水平明显升高,考虑ACO相关临床表现与血浆中TNF-α水平升高有关,从而导致机体发生严重的炎症反应,这对ACO的早期诊断与治疗具有重要意义。
本研究存在一定的局限性:受新冠肺炎疫情的影响,样本收集困难,实验进展缓慢,研究对象相对较少,研究结果有待进一步扩大样本量加以验证;CD16和CD32参与ACO、COPD发病的机制尚不明确,后续需建立动物模型进行深入研究。
综上所述,本研究结果表明,嗜碱性粒细胞源的CD16和CD32以及TNF-α等生物标志物可能在ACO、COPD发病中起着重要作用,且CD16和CD32可作为预防和治疗ACO、COPD的重要靶点,为慢性气道炎症性疾病的预防与治疗提供了新方向。
