外泌体miRNAs及lncRNAs在乳腺癌中的作用研究进展
2022-01-18万雪叶婷李婧媛冯佳谢丹刘靳波
万雪,叶婷,李婧媛,冯佳,谢丹,刘靳波
西南医科大学附属医院医学检验部,四川泸州 646000
乳腺癌是女性最常见的恶性肿瘤,其发病率与死亡率在女性癌症中均位居第一[1]。尽管乳腺癌治疗策略不断更新且靶向药物不断开发,但因具有高度异质性,乳腺癌患者的长期生存率依然较低[1-2]。因此,进一步探讨乳腺癌发生发展的分子机制[3],以及开发用于早期诊断及预后评估的生物标志物,对早期防治乳腺癌、提高患者生存质量有重要意义。
外泌体是一种直径为30~150 nm的脂质双层小泡,由肿瘤细胞、干细胞及其他正常细胞释放,通常存在于体液中,其内包含多种生物活性物质如蛋白质、代谢产物、DNA、mRNA及非编码RNA等[4]。外泌体被认为是一种重要的胞间通信介质,它作为“转运载体”能将内容物从原发肿瘤细胞转移至微环境及远处器官,促进肿瘤的侵袭及转移[5-6]。由于外泌体具有自我保护功能,能避免其活性物质在血液运输过程中被降解,因此,它也是肿瘤的候选生物标志物[5]。近年来研究显示,在乳腺癌发生发展过程中,外泌体介导的核酸分子具有重要作用,其中微小RNAs(microRNAs,miRNAs)及长链非编码RNAs(long non-coding RNAs,lncRNAs)是关键的影响因子。miRNAs及lncRNAs通过外泌体在转录、转录后及表观遗传水平上调节基因的表达,进而调控细胞生物信号[1]。
外泌体miRNAs及lncRNAs在乳腺癌领域中的研究涉及肿瘤基因表达、肿瘤微环境变化、抗肿瘤药物耐药及肿瘤生物标志物等方面。本文针对外泌体miRNAs及lncRNAs在乳腺癌发生发展中的作用机制,以及其作为乳腺癌生物标志物的研究进展进行综述。
1 外泌体miRNAs在乳腺癌中的作用
miRNAs是长度为18~24 nt的高度保守的非编码序列,与RNA诱导沉默复合物结合靶向mRNAs,调控基因的表达[5]。在乳腺癌外泌体研究中,外泌体介导的miRNAs通过靶向相关蛋白、激活信号通路参与乳腺癌细胞侵袭转移、调控肿瘤微环境,以及促进乳腺癌细胞耐药(图1)。

图1 外泌体miRNAs及lncRNAs在乳腺癌中的功能Fig.1 The functions of exosomal miRNAs and lncRNAs in breast cancer
1.1 肿瘤来源外泌体miRNAs在乳腺癌中的作用
1.1.1 在乳腺癌侵袭转移中的作用 Singh等[7]研究发现,外泌体miR-10b在人乳腺癌MDA-MB-231细胞中高表达;将MDA-MB-231细胞与HMLE细胞共培养后发现,miR-10b可通过外泌体转移至HMLE细胞,增强HMLE细胞的侵袭能力,表明乳腺癌细胞外泌体miRNAs能增强正常乳腺细胞的侵袭作用。Ding等[8]发现,外泌体miR-222在乳腺癌淋巴结转移患者中高表达;进一步研究发现,外泌体介导miR-222抑制PDZ与LIM结构域蛋白2(PDZ and LIM domain protein 2,PDLIM2)表达,激活核因子-κB(nuclear factor-κB,NF-κB)信号通路,促进乳腺癌细胞的侵袭及转移。Fong等[9]发现,miR-122在乳腺癌细胞外泌体中高度富集,并可通过外泌体转移至转移前微环境细胞(包括肺成纤维细胞、脑星形胶质细胞),抑制其丙酮酸激酶表达,减少对葡萄糖的消耗,使乳腺癌细胞获得更多葡萄糖,从而促进乳腺癌细胞转移,提示肿瘤来源外泌体miRNAs可促进乳腺癌细胞的侵袭及转移。O‘Brien等[10]报道,miR-134在三阴性乳腺癌组织及血清外泌体中表达降低,MDA-MB-231细胞表达的外泌体miR-134通过调节STAT5B/HSP90信号通路减少三阴性乳腺癌细胞的侵袭及迁移,提示肿瘤来源外泌体miRNAs也可抑制乳腺癌细胞的侵袭及转移。因此,肿瘤细胞外泌体miRNAs可作为促癌基因及抑癌基因参与乳腺癌的发生发展。
1.1.2 在微环境中的作用 肿瘤微环境由细胞外基质及基质细胞组成,基质细胞包括间充质干细胞(mesenchymal stem cells,MSCs)、肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)、肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)、免疫细胞、内皮细胞及脂肪细胞等。近年来研究表明,肿瘤来源外泌体miRNAs在肿瘤微环境的建立中起重要作用。
乳腺癌细胞外泌体miRNAs通过调控CAFs发挥促癌作用。Yan等[11]发现,MYC原癌基因蛋白(MYC proto-oncogene protein,MYC)可诱导MDAMB-231细胞分泌外泌体miR-105。CAFs与MDAMB-231细胞来源外泌体共培养后,外泌体miR-105可抑制CAFs中MAX相互作用蛋白1(MAX-interacting protein 1,MXI1)的表达,激活MCY信号,诱导代谢重编程,促进乳腺癌细胞的生长。Baroni等[12]发现,乳腺癌细胞通过外泌体将miR-9转移至成纤维细胞(normal fibroblasts,NFs),诱导NFs出现CAFs样表型,促进乳腺癌细胞的侵袭、转移。外泌体miRNAs也参与对内皮细胞的调节。Kosaka等[13]将乳腺癌细胞外泌体与内皮细胞共培养,发现miR-210可通过外泌体转移到内皮细胞,促进肿瘤血管形成及乳腺癌细胞的转移。Zhou等[14]发现,MDA-MB-231细胞外泌体miR-105可抑制内皮细胞中紧密连接蛋白-1(ZO-1)的表达,破坏内皮细胞的屏障功能,从而促进乳腺癌细胞转移。此外,乳腺癌细胞外泌体miR-144及miR-126也可与脂肪细胞相互作用。外泌体miR-144通过调节MAP3K8/ERK1/2/PPARγ信号途径促进脂肪细胞向米色/棕色脂肪细胞表型分化,外泌体miR-126通过阻断脂肪细胞IRS/Glut-4信号通路激活AMPK/自噬通路并诱导低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)表达,共同促进脂肪细胞的分解代谢,诱导肿瘤生长[15]。由此可见,肿瘤细胞可通过分泌外泌体miRNAs调控肿瘤微环境,以利于自身的生长、侵袭及转移,在肿瘤的恶性转化过程中发挥重要作用。
1.1.3 参与乳腺癌细胞对药物的耐药性 尽管化疗药物被广泛应用于乳腺癌的治疗,但持续接触化疗药物不可避免地会导致获得性耐药。外泌体作为核酸的载体,参与核酸的传递,在肿瘤耐药中发挥重要作用。Wei等[4]首次发现外泌体miRNAs可参与癌细胞耐药性的传播。耐他莫昔芬MCF7细胞外泌体进入他莫昔芬敏感的MCF7细胞中,能释放miR-221/222,抑制p27及雌激素受体α(estrogen receptor α,ERα)的表达,促进MCF7细胞对他莫昔芬耐药[4]。Santos等[16]从乳腺癌阿霉素耐药株及紫杉醇耐药株中分离出富含miR-155的外泌体,这些外泌体与敏感乳腺癌细胞共培养后,可增强后者对这些化疗药的耐药性。此外,Wang等[17]发现,将耐顺氯氨铂MDA-MB-231细胞的外泌体miR-423-5p转移到其他乳腺癌细胞中,能改变其他乳腺癌细胞对顺氯氨铂的敏感性。总之,耐药肿瘤细胞可介导外泌体传递miRNAs至敏感细胞中,引起敏感细胞耐药,从而导致治疗失效。
1.2 肿瘤微环境来源外泌体miRNAs在乳腺癌中的作用 外泌体作为细胞间信息传递的媒介,在肿瘤细胞及微环境调节中具有双向作用。不仅肿瘤细胞外泌体miRNAs作用于微环境细胞,肿瘤微环境细胞外泌体miRNAs也可作用于乳腺癌细胞。
MSCs与肿瘤血管形成有关。MSCs外泌体miR-100转移到乳腺癌细胞后,可调节mTOR/HIF-1α信号通路,减少血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,从而抑制肿瘤血管的生成[18]。CAFs主要源于NFs,参与乳腺癌的发生、血管形成及上皮-间质转化[19]。外泌体miR-21、miR-378e及miR-143在CAFs中高表达,乳腺癌细胞摄取CAFs外泌体miRNAs后,可促进乳腺癌细胞的上皮-间质转化及肿瘤干细胞特性[19]。Kim等[20]发现,外泌体miR-4516在浸润性导管癌的CAFs中低表达。乳腺癌细胞过表达外泌体miR-4516后,可通过下调FOS样抗原1(FOS like antigen 1,FOSL1)抑制乳腺癌细胞增殖。TAMs是肿瘤微环境中最丰富的免疫相关细胞[21]。将TAMs与乳腺癌细胞共培养后,可检测到乳腺癌细胞存在TAMs外泌体特异性miR-223,后者可通过激活Mef2c/β-catenin信号通路促进乳腺癌细胞的侵袭[21]。上述研究均说明,乳腺癌细胞可通过摄取微环境细胞外泌体miRNAs调控靶基因或激活相关信号通路,从而参与乳腺癌的发生发展。
2 外泌体lncRNAs在乳腺癌中的作用
LncRNAs是一种长度超过200 nt的RNAs,通常充当竞争性内源RNAs或RNA海绵,参与各种生理及病理过程[1]。外泌体lncRNAs在乳腺癌细胞的转移、增殖、凋亡、调控肿瘤微环境及促进乳腺癌细胞耐药方面发挥了重要作用(图1)。
2.1 肿瘤来源外泌体lncRNAs在乳腺癌中的作用
2.1.1 在乳腺癌转移、增殖及凋亡中的作用 有研究发现,外泌体lncRNA GS1-600G8.5在脑转移乳腺癌细胞中高表达,并可通过下调ZO-1表达破坏血脑屏障,促进乳腺癌细胞的脑转移[22]。Zhang等[23]发现,lncRNA MALAT1在乳腺癌中高表达,并可通过外泌体包裹传递给乳腺癌细胞,促进乳腺癌细胞的增殖。Koldemir等[24]的研究表明,外泌体lncRNA GAS5是诱导凋亡的标志物,用紫杉醇及博来霉素处理乳腺癌细胞后,能诱导乳腺癌细胞高表达外泌体GAS5,促进乳腺癌细胞凋亡。因此,乳腺癌细胞可通过外泌体lncRNAs发挥促癌及抑癌作用。
2.1.2 在微环境中的作用 肿瘤来源外泌体lncRNAs与肿瘤微环境中的免疫细胞有关。乳腺癌细胞外泌体lncRNA BCRT1与巨噬细胞共培养后,可促进巨噬细胞M2型极化,增强乳腺癌细胞的迁移及血管生成能力[25]。γδ T细胞是肿瘤浸润淋巴细胞的主要成分,与乳腺癌的病理学特征及预后不良密切相关[26]。γδ1 T细胞摄取乳腺癌细胞外泌体lncRNA SNHG16后,可通过与miR-16-5p相互作用激活TGF-β1/SMAD5通路,诱导γδ1 T细胞表达CD73,使其转变成CD73+γδ1 T细胞,从而抑制机体免疫功能,促进肿瘤生长[26]。由此可见,肿瘤细胞外泌体lncRNAs可作为免疫细胞的诱导剂促进乳腺癌的生长与转移。
2.1.3 参与乳腺癌细胞对药物的耐药性 在耐曲妥珠单抗乳腺癌细胞株中,lncRNA SNHG14通过Bcl-2/Bax信号通路促进曲妥珠单抗耐药,然后SNHG14经耐药细胞株分泌的外泌体包裹,转移至敏感细胞中,促使敏感细胞耐药[27]。Han等[28]也发现外泌体lncRNA AFAP1-AS1参与了乳腺癌细胞对曲妥珠单抗的耐药。进一步研究发现,AFAP1-AS1通过AU结合因子1(AU-binding factor 1,AUF1)启动ERBB2 mRNA翻译,促进人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达,诱导敏感株对曲妥珠单抗耐药。类似研究还包括,lncRNA UCA1[29]及lncRNA H19[30]通过外泌体参与乳腺癌细胞对他莫昔芬及阿霉素的耐药。总之,耐药肿瘤细胞可利用外泌体将lncRNAs传递给敏感的乳腺癌细胞,诱导其对化疗产生耐受。
2.2 肿瘤微环境细胞来源外泌体lncRNAs在乳腺癌中的作用 近来有研究表明,肿瘤微环境细胞来源外泌体lncRNAs也可以影响乳腺癌的发生发展。研究人员发现乳腺癌细胞可摄取CAFs分泌的外泌体lncRNA SNHG3,而SNHG3能充当miR-330-5p的内源性竞争RNA,增加乳腺癌细胞丙酮酸激酶的表达,抑制线粒体氧化磷酸化,增强糖酵解过程,从而促进乳腺癌细胞的增殖[31],提示肿瘤细胞外泌体摄取微环境细胞外泌体lncRNAs后,可将后者作为内源性RNA发挥其生物作用,参与乳腺癌细胞的增殖。
3 外泌体miRNAs及lncRNAs作为乳腺癌的生物标志物
由于外泌体miRNAs及lncRNAs具有高度稳定性及富集性,而且外泌体的脂质双分子层结构能保护miRNAs及lncRNAs在血液循环中不被核糖核酸酶降解,因此外泌体miRNAs及lncRNAs可作为疾病的候选生物标志物。近来研究表明,外泌体miRNAs及lncRNAs可作为乳腺癌诊断及预后评估的生物标志物,对临床早期治疗、减少复发、改善预后具有重要意义(图2)。
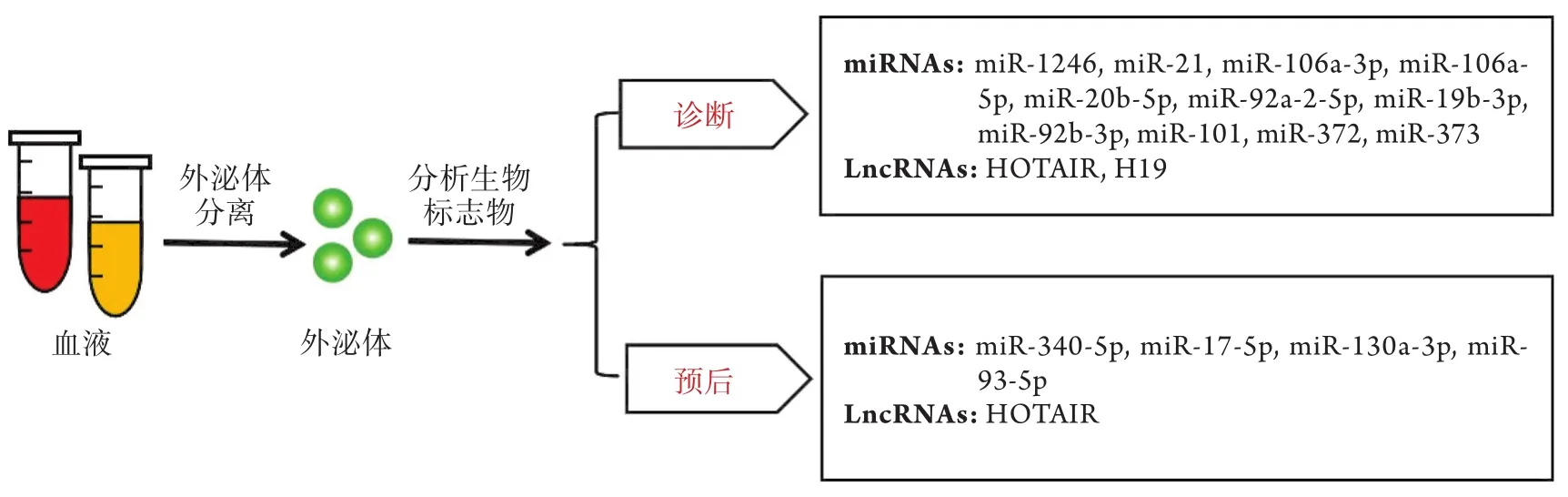
图2 可作为乳腺癌诊断及预后评估标志物的外泌体miRNAs及lncRNAsFig.2 Exosomal miRNAs and lncRNAs used as biomarkers for diagnosis and prognosis of breast cancer
3.1 外泌体miRNAs 乳腺癌患者血液中外泌体miRNAs作为潜在的生物标志物已被广泛研究。Hannafon等[32]比较了16例乳腺癌患者与16例健康对照的血浆外泌体,发现miR-1246及miR-21在乳腺癌患者血浆外泌体中显著升高,两者联合测定诊断乳腺癌的受试者工作特征曲线下面积(AUC)为0.73,提示其可能是辅助乳腺癌诊断的指标。Li等[33]分析了32例乳腺癌患者与32例健康对照的血浆、血清外泌体中来自miR-106a-363簇的12个miRNAs,发现乳腺癌患者血浆外泌体中miR-106a-3p、miR-106a-5p、miR-20b-5p、miR-92a-2-5p及血清外泌体中miR-106a-5p、miR-19b-3p、miR-20b-5p、miR-92b-3p均明显高于对照组,提示这些血浆及血清外泌体miRNAs可能成为乳腺癌诊断的新型标志物。Eichelser等[34]通过研究50例乳腺癌患者与12例健康对照者发现,miR-101、miR-372及miR-373在血清外泌体中的表达量高于血清中的表达量,乳腺癌患者血清外泌体中miR-101及miR-372的表达量明显高于对照组,两组miR-373表达量无明显差异,对乳腺癌分子亚型进一步分析发现,三阴性乳腺癌患者外泌体miR-373高于Luminal A、B型乳腺癌患者及对照组。该研究提示外泌体miR-101及miR-372可能是乳腺癌诊断的生物标志物,外泌体miR-373可能是三阴性乳腺癌诊断的生物标志物。有Meta分析发现,外泌体miR-340-5p、miR-17-5p、miR-130a-3p、miR-93-5p与乳腺癌的复发及远处器官转移相关,提示这些外泌体miRNAs对乳腺癌患者的预后判断具有良好的参考价值[35]。
3.2 外泌体lncRNAs 相关研究发现,外泌体lncRNAs也可作为理想的乳腺癌诊断及预后评估生物标志物。Zhong等[36]比较了乳腺癌患者、乳腺良性疾病患者与健康对照者外泌体的lncRNA H19表达情况,发现lncRNA H19在乳腺癌患者中高表达,其AUC为0.870,高于CA153及CEA的AUC(分别为0.822、0.811),lncRNA H19、CA153与CEA三者联合检测诊断乳腺癌的AUC更高(0.845),提示外泌体lncRNA H19可能是诊断乳腺癌的新型标志物。Tang等[37]研究发现,外泌体lncRNA HOTAIR在乳腺癌患者血清中呈高表达,其AUC为0.918,明显高于CA153的AUC(0.738);此外,lncRNA HOTAIR高表达与乳腺癌患者生存率低及行新辅助化疗对他莫昔芬反应不佳有关。Wang等[38]也发现,血浆外泌体HOTAIR的表达与HER2阳性呈正相关,HER2能促进HOTAIR表达,增加外泌体HOTAIR的数量,提示外泌体HOTAIR可能是诊断HER2阳性乳腺癌的敏感生物标志物,也可能是评估乳腺癌患者化疗效果的指标。
4 总结与展望
外泌体作为重要的细胞信息传递媒介,其内容物miRNAs及lncRNAs在调控乳腺癌的发生发展及耐药等过程起关键作用。外泌体不仅在体液中含量丰富,而且可保护自身携带的miRNAs及lncRNAs不被降解,使外泌体miRNAs及lncRNAs可作为肿瘤标志物用于乳腺癌的诊断及预后评估。此外,由于miRNAs及lncRNAs可通过外泌体在癌细胞与正常细胞、癌细胞与癌细胞、癌细胞与微环境细胞之间进行转移,针对这些外泌体miRNAs及lncRNAs开发新型抗癌靶向药物可能是乳腺癌治疗的新方向。
虽然国内外研究对外泌体miRNAs及lncRNAs在乳腺癌中所表现的功能及生物特性日趋明确,但外泌体的分离、纯化、鉴定方法复杂、费时、价高,使外泌体miRNAs及lncRNAs在临床上的应用受到了限制。因此,探索简便、经济、快速的方法技术势在必行。尽管血液外泌体miRNAs及lncRNAs在乳腺癌中的临床意义得到了初步探索,但大多数处于基础研究阶段,且规模较小,缺乏大样本及多中心研究验证。总之,明确外泌体miRNAs及lncRNAs参与乳腺癌发生发展的作用机制,有助于寻找新型生物标志物并研究出带有保护性miRNAs及lncRNAs的外泌体,为乳腺癌的诊断及治疗提供新方向。
