全胃肠外营养对幼鼠心肌的损伤作用及其机制
2022-01-18孙晓东沈蕾蕾郑瑞雪赵庆宁陈盛
孙晓东,沈蕾蕾,郑瑞雪,赵庆宁,陈盛*
1陆军军医大学第一附属医院儿科,重庆 400038;2陆军军医大学第一附属医院病理科,重庆 400038
全胃肠外营养(total parenteral nutrition,TPN)已广泛应用于临床。极低或超低出生体重儿的早期肠内喂养困难,常需给予TPN治疗;患有坏死性小肠结肠炎、喂养不耐受、自发性肠穿孔、短肠综合征及胃肠道手术后等的患儿,也需要长时间的TPN治疗。因此,TPN已成为挽救患儿生命的重要营养支持手段。但TPN也可引起多种并发症,如肝损伤、感染、血栓形成和代谢紊乱等,其中较为常见的是胃肠外营养相关性肝疾病(PNALD)。有研究发现,长时间TPN可导致40%~60%的患儿肝功能异常,严重者可诱发肝纤维化、门脉高压甚至死亡[1]。近年来,TPN对心血管系统的影响已引起国内外学者的高度关注[2]。临床上长期TPN可引起心输出量降低和肺毛细血管楔压增高,QT间期延长[3-4],且心功能的下降程度与脂肪乳剂呈剂量依赖性[5]。Demircan等[6]发现,TPN动物模型在放置PICC导管之外的血管中存在内皮损伤,提示TPN可能损伤心血管系统。但是,目前国内尚未见TPN对心脏损伤作用的报道,因此,本研究通过构建TPN动物模型,探讨TPN对心脏的损伤作用及其可能机制,旨在为临床防治TPN相关心脏并发症提供理论基础。
1 材料与方法
1.1 实验动物 6~8周龄SPF级Sprague-Dawley雄性幼鼠24只,体重220~240 g,购自陆军军医大学实验动物中心[合格证号:SCXK(渝)20170002],并饲养于陆军军医大学第一附属医院实验动物中心。本研究已通过动物伦理委员会的批准(AMUWEC20201551),研究过程符合医学动物实验的伦理要求。
1.2 主要试剂 TUNEL细胞凋亡检测试剂盒(C1090)、MDA检测试剂盒(S0131S)、H2O2检测试剂盒(S0038S)、DAPI(C-1005)(上海碧云天生物技术有限公司),MPO抗体(22225-1-AP,中国武汉Proteintech公司),β-actin(SC-8432,美国Santa Cruz公司),Total RNA Kit Ⅰ(R6834-01,美国Omega公司),ReverTra Ace-α-反转录试剂盒(FSK-101,日本TOYOBO公司),SYBR Green Realtime PCR Master Mix(QPK-201,日本TOYOBO公司)。基因引物由中国生工生物工程股份有限公司合成。
1.3 主要仪器 低温离心机(德国Sigma公司),酶标仪(美国Thermofisher公司),Bio-Rad 3000微量光度计、CFX96 Software PCR仪(美国Bio-Rad公司),凝胶成像系统(法国Evolution-Capt Edge公司),自动染色机(德国Leica公司),激光共聚焦系统(德国Carl Zeiss公司),新生儿1.9F PICC管(美国MediBeacon公司),单双通道微量动物输液泵(东莞恒丰医疗科技有限公司)。
1.4 方法
1.4.1 动物模型 将24只SPF级雄性Sprague-Dawley幼鼠随机分为4组(n=6):正常组、对照组、TPN-7 d组及TPN-14 d组,各组幼鼠周龄及体重差异无统计学意义(P>0.05)。对照组、TPN-7 d和TPN-14 d组提前禁食1 d,经腹腔注射麻醉后消毒铺巾,在幼鼠右颈做一0.5 cm长切口,分离出右颈静脉,将肝素化的1.9F PICC管插入1.0~1.5 cm,进入上腔静脉后固定,关闭切口,PICC末端经皮下隧道自幼鼠背部引出,经皮缝合固定于幼鼠背侧。对照组幼鼠经颈静脉置管后在输液泵控制下持续输入生理盐水,术后24 h内以1 ml/h输注,24 h后以2 ml/h输注,可自由进食进水;TPN-7 d和TPN-14 d组幼鼠经颈静脉置管后持续输入静脉营养液,术后24 h内以1 ml/h输注,24 h后以2 ml/h输注,并禁食禁水;正常组不做处理,正常喂食标准鼠粮,自由饮水。正常组、对照组、TPN-7 d组、TPN-14 d组幼鼠分别在建模第14、14、7、14天处死,获取心肌组织。
1.4.2 TPN营养液的配制 参照文献[7-8]报道的方法配制TPN营养液:TPN组幼鼠经中心静脉导管连续避光输注TPN营养液[205 kcal/(kg.d)],每升TPN溶液中包含450 ml复方氨基酸(华润双鹤制药公司,中国),360 ml 50%葡萄糖(中国大冢制药有限公司),140 ml脂肪乳(中国费森尤斯卡比华瑞制药有限公司),同时添加微量元素、维生素和电解质。
1.4.3 HE染色观察各组幼鼠心肌组织的病理学变化 将幼鼠心脏新鲜样品剪成小块,用4%多聚甲醛固定24 h,经不同浓度乙醇脱水,石蜡包埋,切片(厚度3 μm),切片放入自动染色机中染色、封片,然后在光学显微镜下观察各组心肌组织的病理学变化。
1.4.4 TUNEL法检测各组幼鼠心肌组织的细胞凋亡情况 切片脱蜡后按照TUNEL试剂盒说明书检测各组幼鼠心肌组织的细胞凋亡情况,在200倍光镜下随机观察5个视野,计算每个视野的凋亡指数。凋亡指数(%)=阳性细胞数/总细胞数×100%。
1.4.5 ELISA法检测各组幼鼠心肌组织中丙二醛(MDA)和过氧化氢(H2O2)含量 将幼鼠心脏新鲜样品剪碎,加液氮研磨成粉,加入裂解液,4 ℃ 下12 000×g离心,取上清液,严格按照试剂盒说明书用分光光度计检测心肌组织MDA和H2O2含量。
1.4.6 qRT-PCR检测各组幼鼠心肌组织MPO mRNA的表达情况 将幼鼠心脏新鲜样品剪碎,加液氮研磨成粉,加适量Trizol裂解液提取总RNA,使用ReverTra Ace-α-反转录试剂盒合成cDNA。反应条件为:42 ℃ 10 min,30 ℃ 20 min,99 ℃ 5 min,4 ℃ 5 min。再将合成的cDNA作为荧光定量模板,以β-actin为内参照。反应体系:2×SYBR Green 10 μl+cDNA模板2 μl+上下游引物各0.3 μl,加去离子水至总体积20 μl。反应条件为:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s,40个循环。引物序列:MPO,正义5‘-CCAGCCAGATTTCCTGTCT CC-3‘,反义5‘-TGAGCGTCCCAATTCCTTTGA-3‘,片段长度211 bp;β-actin,正义5‘-GAGAGGGAAAT CGTGCGT-3‘,反义5‘-GGAGGAAGAGGATGCGG-3‘,片段长度250 bp。结果以相对表达倍数表示。
1.4.7 Western blotting检测幼鼠心肌组织MPO蛋白的表达情况 将幼鼠心脏新鲜样品剪碎,加液氮研磨成粉,冰上裂解30 min。离心后取上清,加入适量5×loading Buffer,取等量蛋白样品上样,电泳、转膜。PVDF膜封闭浸于一抗溶液中,4 ℃孵育过夜,二抗室温孵育2 h,化学发光法显影。采用ImageJ软件分析条带灰度值,蛋白相对表达水平以MPO/β-actin的比值表示。
1.4.8 免疫荧光检测幼鼠心肌组织MPO的表达情况 石蜡切片脱蜡复水后置于抗原修复液中(92 ℃15 min),自然冷却后用5% BSA封闭15 min,滴加一抗4 ℃过夜(12 h以上),滴加二抗37 ℃ 1 h,滴加DAPI工作液室温1 min,封片,荧光显微镜拍片,ImageJ软件分析荧光强度。
1.5 统计学处理 采用SPSS 27.0软件进行统计分析,采用GraphPad Prism 8.0作图。计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组幼鼠心肌组织的病理学变化 HE染色结果显示,正常组、对照组幼鼠心肌纤维形态正常,排列整齐,未见明显出血、肿胀和坏死,未见明显炎性细胞浸润,肌原纤维结构完整(图1A、B);TPN-7 d组有3只幼鼠(50%)心肌组织可见轻微间质出血和少量炎性细胞浸润,以中性粒细胞为主(图1C);TPN-14 d组所有幼鼠的心肌组织均出现了轻到重度损伤,重度损伤可表现为间质出血和水肿、血管扩张、心肌间隙增宽、少许坏死和大量炎性细胞浸润,以中性粒细胞、浆细胞、淋巴细胞为主(图1D)。
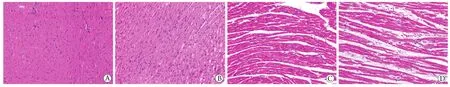
图1 各组幼鼠心肌组织病理学变化(HE ×200)Fig.1 Pathological changes of myocardial tissue in each group (HE ×200)
2.2 各组幼鼠心肌细胞凋亡情况比较 TUNEL染色结果显示,正常组、对照组、TPN-7 d组及TPN-14 d组幼鼠心肌细胞凋亡率分别为3.34%±2.91%、3.48%±1.06%、10.97%±5.16%、23.24%±4.20%,与正常组、对照组相比,TPN-7 d组、TPN-14 d组心肌细胞凋亡指数明显升高(P<0.05),且TPN-14 d组凋亡指数明显高于TPN-7 d组(P<0.05)(图2)。

图2 各组幼鼠心肌细胞凋亡情况Fig.2 Apoptosis of myocardial cells in each group
2.3 各组幼鼠心肌组织MDA及H2O2含量比较 与正常组、对照组比较,TPN-7 d组MDA含量未见明显升高,差异无统计学意义(P>0.05),而TPN-14 d组较正常组、对照组及TPN-7 d组均明显升高(P<0.05);与正常组、对照组比较,TPN-7 d组、TPN-14 d组幼鼠H2O2含量明显升高(P<0.05),且TPN-14 d组明显高于TPN-7 d组(P<0.05)(表1)。
表1 各组幼鼠心肌组织MDA、H2O2含量比较(,n=6)Tab.1 Comparison of MDA and H2O2 levels in myocardium of young rats in each group (, n=6)

表1 各组幼鼠心肌组织MDA、H2O2含量比较(,n=6)Tab.1 Comparison of MDA and H2O2 levels in myocardium of young rats in each group (, n=6)
与正常组、对照组比较,(1)P<0.05;与TPN-7 d组比较,(2)P<0.05。
项目 正常组 对照组 TPN-7 d组 TPN-14 d组 F P MDA(μmol/mg) 1.97±0.19 3.88±0.60 4.37±0.32 7.00±0.69(1)(2) 88.380 0.000 H2O2(μmol/L) 0.61±0.27 1.20±0.18 2.22±0.28(1) 3.43±0.48(1)(2) 74.450 0.000
2.4 各组幼鼠心肌组织MPO mRNA表达情况比较与正常组、对照组比较,TPN-7 d组MPO mRNA表达无明显升高,差异无统计学意义(P>0.05),而TPN-14 d组较正常组、对照组及TPN-7 d组均明显升高(P<0.05)(图3)。

图3 各组幼鼠心肌组织MPO mRNA表达情况Fig.3 Relative expression level of MPO mRNA in myocardial tissue of young rats in each group
2.5 各组幼鼠心肌组织MPO蛋白表达情况比较Western blotting检测结果显示,与正常组、对照组比较,TPN-14 d组及TPN-7 d组MPO蛋白表达水平明显升高(P<0.05),且TPN-14 d组明显高于TPN-7 d组(P<0.05)(图4)。
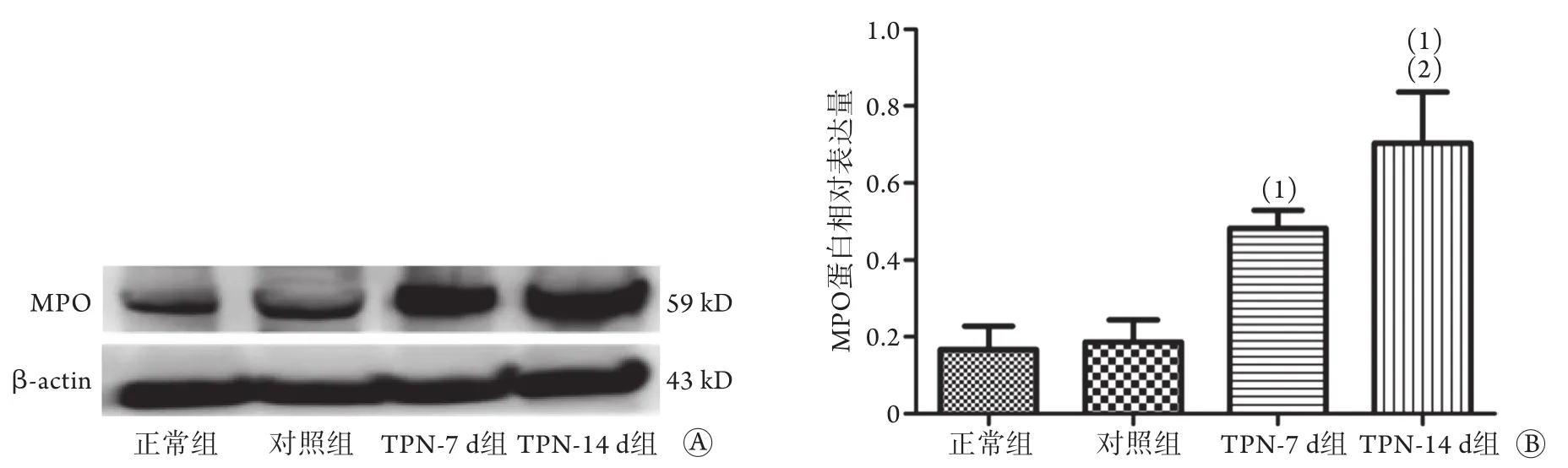
图4 各组幼鼠心肌组织MPO蛋白表达情况Fig.4 Expression of MPO protein in myocardial tissue of each group
2.6 各组幼鼠心肌组织MPO免疫荧光表达情况比较 正常组、对照组、TPN-7 d组及TPN-14 d组幼鼠心肌组织MPO的荧光强度分别为8.28±2.09、10.35±3.07、17.48±1.77、32.54±6.08,与正常组、对照组比较,TTPN-7 d组及TPN-14 d组幼鼠MPO荧光强度明显升高(P<0.05),且TPN-14 d组明显高于TPN-7 d组(P<0.05)(图5)。

图5 各组幼鼠心肌组织MPO免疫荧光表达情况Fig.5 MPO immunofluorescence expression in myocardium of each group
3 讨 论
TPN作为重要的营养支持及治疗措施,已成为肠内喂养困难或禁食患儿不可缺少的治疗手段,但长时间TPN导致的并发症可影响患儿的生活质量及治疗结局。TPN对心血管系统也存在不同程度的影响,有研究表明,TPN配方中的脂肪乳剂可减轻局部麻醉剂、氟哌啶醇和三环类抗抑郁药对心脏的毒性作用,其机制与增加心肌细胞内钙离子水平从而增强心肌的收缩力有关[9];也有研究证实,脂肪乳剂可改善心肌组织的缺血再灌注损伤[10]。然而,由TPN导致的心血管系统不良事件日益增多[2,11],研究发现,TPN可引起置管以外的血管内皮细胞损伤[6];有报道接受不到2周标准TPN治疗的婴儿死于心脏骤停,而尸检并未发现心脏器质性病变,推测与TPN致心肌损伤有关[12];Marfella等[3]发现,静脉输入脂肪乳剂后,随时间延长,血液儿茶酚胺水平升高,心脏复极期延长。有文献报道,即使在导管放置位置无误的情况下,经中心静脉置管输注TPN也可能会出现心包积液和心脏压塞等严重情况[13]。因此,探讨TPN对心血管系统尤其是心肌的损伤作用及其机制对预防相关并发症具有重要的临床意义。
本研究通过构建TPN动物模型发现,经过7 d的TPN后,50%的幼鼠心肌组织出现了轻度的病理损伤,而经过14 d的TPN后,所有幼鼠的心肌组织均出现轻到重度损伤。TUNEL染色发现,TPN 1周后心肌细胞凋亡增加,且TPN-14 d组多于TPN-7 d组,提示1周的TPN即可引起心肌损伤,且随TPN时间的延长,心肌损伤加重,与Gürünlüoğlu等[14]的报道一致,他们通过建立10 d TPN兔模型发现心肌组织在病理上出现了空泡变性、坏死和水肿,在电镜下肌纤维变性和丧失,细胞质水肿、线粒体固缩、脂滴明显。一项针对健康受试者进行的临床随机交叉试验发现,与盐水输入组比较,TPN组QT间期延长,表明TPN可能破坏了心肌的电化学信号[3]。胃促生长素(ghrelin)具有保护心血管系统的生物学作用,可通过特定的受体介导心脏血管舒张,增强心肌收缩力。Hagiwara等[15]利用大鼠动物模型发现,TPN组的胃促生长素水平较完全肠内营养组明显降低,心功能明显降低。以上研究均证实TPN可导致心肌损伤,根据现有的文献,其病理机制可能与以下几个方面有关:(1)光能破坏TPN营养液中具有抗氧化作用的维生素,导致机体氧化-抗氧化系统失衡,诱导脂质过氧化,从而损伤心肌细胞[16]。(2)由于缺乏肠道营养的刺激,肠道蠕动减少,肠道内微生物群的组成和功能发生改变,从而诱导肠道炎症及促进肠道通透性增加,易致细菌或内毒素(LPS)移位。有研究发现,1周的TPN即可引起门静脉部位的LPS水平升高[17];笔者团队的研究也发现,持续2周的TPN可导致幼鼠先天性及获得性免疫功能受损,IL-1β、TNF-α水平升高,而IL-10、IL-4水平降低(待发表)。(3)TPN营养液经导管通过右侧颈静脉输入,首先到达的部位即为右心房,使心肌长期处于高浓度脂质和高浓度葡萄糖的局部环境中,影响了心肌细胞的正常代谢。(4)TPN营养液配方中高比例的ω-6脂肪乳剂可使线粒体功能紊乱,从而诱导死亡受体的表达,导致细胞凋亡[18]。(5)由于肠内营养缺失,肠促胰岛素分泌减少,使高血糖的发生率增高,也是心肌损伤的重要机制之一[19]。总之,TPN可导致心肌受损,成为临床上心输出量降低、肺毛细血管楔压增高[4]、心功能下降[5]、QT间期延长[3]的重要原因;此外,超过2周的TPN是院内感染的独立危险因素,部分患儿院内感染表现为以右心衰竭为主要的脓毒症症状,但鉴于大多数患儿血液培养结果为阴性,且心力衰竭时促炎因子呈过度激活状态,因此,此类临床症状究竟是由感染所致还是TPN介导的心肌损伤所致,往往很难鉴别,需引起高度重视。
TPN导致心肌损伤的分子机制目前尚不清楚。本研究发现,TPN组幼鼠心肌组织H2O2含量及MPO蛋白表达水平升高,且随TPN时间的延长更为明显;MDA含量及MPO mRNA在7 d时虽未升高,但14 d时升高明显。H2O2是活性氧(ROS)家族的组成成分,是细胞生长、炎症、氧化应激在内的各种病理生理过程中的关键信号分子。MDA是脂质过氧化的最终产物,脂质过氧化是一种连锁反应,可持续提供氧自由基。MPO是血红素过氧化物酶超家族的一员,主要在中性粒细胞和单核细胞中表达,存在于嗜蓝颗粒中。白细胞激活时可分泌MPO,通过酶促反应产生次氯酸(HOCl)和其他活性物质,通过损伤内源性抗氧化防御机制导致心肌损伤[20-21],中性粒细胞是主要的心肌损伤早期反应细胞,而MPO则可作为中性粒细胞的功能标志和激活标志,在心肌损伤24 h内出现,早于心肌酶谱的变化,是反映心肌早期炎性损伤的重要指标之一[22]。H2O2、MDA及MPO均是反映心肌氧化应激的标记物,因此本研究结果也表明氧化应激介导了TPN导致的心脏损伤。Gürünlüoğlu等[14]也发现,10 d的TPN兔模型心肌组织中的MDA、过氧化氢酶、氧化应激指数(OSI)等均出现升高,同时反映慢性心肌损伤和氧化应激指标的相对端粒长度明显降低。此外,有临床研究发现,经过5 d的TPN后,新生儿血液中MDA的含量较TPN前反而降低了,推测与营养液中维生素C的抗氧化作用有关[23]。而本研究结果表明,长时间的TPN后,即使在使用维生素C的情况下仍不能完全消减对心肌的氧化损伤。TPN对心肌的氧化损伤可能与ROS的过量生成有关,TPN相关性高血糖破坏线粒体功能可能是其重要原因之一[19]。物质代谢产生的电子在线粒体中经过电子传递链传递给O2,此过程受到质子电化学梯度的严格控制,而高血糖使三羧酸循环过度活跃,进而产生大量的电子流,破坏正常的质子电化学梯度,使电子不经过复合体Ⅲ的传递而直接经辅酶Q传递给O2,最终导致ROS的大量生成[24]。高血糖还可通过活化甘油二酯(DAG)、蛋白激酶C(PKC)和NADPH氧化酶等信号途径促进ROS的大量释放[25-26]。此外,TPN溶液受到光的影响导致抗氧化维生素的损失和包括脂质过氧化物在内的多种过氧化物的过量产生,也是机体过量ROS的重要来源[16]。脂肪乳剂中的ω-6多不饱和脂肪酸是否可促进炎症尚存争议,但ω-6/ω-3比例较高时,炎症状态较明显,因此不当的ω-6/ω-3比例可能也是促进ROS过量产生的重要原因[27]。
综上所述,本研究结果显示,1周的TPN即可引起心肌损伤,且随着时间的延长而加重,氧化应激可能是其重要的机制之一。因此,尽可能缩短TPN使用时间,尽早开始肠内营养,对防治TPN的心肌并发症具有重要的临床意义。但本研究也存在一些局限性,如设置的时间点为第7天、第14天,而在TPN第7天时心肌损伤已经发生,且随时间延长而加重,但目前尚未找到TPN造成心肌损伤的起始时间点,需在后续研究中进一步细化时间点。
