慢性粒细胞白血病患者血液指标检查与人类白细胞抗原基因的相关性
2022-01-18李露
李露
白血病为临床上常见的血液病之一,主要是患者自身造血功能遭到严重破坏,从而造成血液系统出现障碍[1,2]。人类慢性粒细胞白血病(chronicmyeloid leukemia,CML)是源自造血干细胞的恶性血液肿瘤,其发病过程为造血干细胞发生染色体易位,使得酪氨酸激酶产物异常活化,并浸润其他组织和器官,从而抑制正常血细胞的生长和分化[3]。随着医学技术的提高,药物联合治疗慢性粒细胞白血病已显著延长了患者的生存时间,但是很多患者治疗后容易复发,且治疗费用居高不下,为此在临床上需要攻克与发展新的治疗与诊断方法[4]。形态学检查作为慢性粒细胞白血病基础诊断的重要方式之一,特别是血液各指标检查作为白血病分析诊断的基础,具有应用方便、快速等特点,但是诊断的特异性有待提高[5]。人类白细胞抗原(human leukocyte alleles,HLA)是人体内能引起强排斥反应的主要组织相容性抗原系统,也是人类基因组中多态性程度最高的一个遗传系统,在不同种族、不同地区均表现出分布差异,也具有连锁不平衡和单倍型遗传的显著遗传特征[6,7]。本文具体探讨了慢性粒细胞白血病患者血液指标与HLA 基因的相关性,希望能为早期动态监测患者病情变化提供参考。现总结报告如下。
1 资料与方法
1.1 一般资料 选择2016 年1 月~2020 年8 月在本院诊治的慢性粒细胞白血病患者64 例作为白血病组,另选择同期在本院体检的健康人群64 例作为对照组。白血病组中,男38 例,女26 例;年龄最小6 岁,最大71 岁,平均年龄(25.22±15.26)岁;平均体质量指数(21.01±1.77)kg/m2;平均病程(2.17±0.22)个月;临床表现:头晕45 例,乏力52 例,纳差41 例,腹痛35 例,腹部包块32 例,发热22 例,淋巴结肿大5 例,听力下降3 例,骨关节痛8 例,盗汗19 例。对照组中,男39 例,女25 例;年龄最小6 岁,最大75 岁,平均年龄(26.15±16.29)岁;平均体质量指数(22.18±1.78)kg/m2。两组的性别、年龄、体质量指数等一般资料对比,差异无统计学意义(P>0.05),具有可比性。纳入标准:初治患者;白血病组患者都符合慢性粒细胞白血病的诊断标准;年龄6~75 岁;汉族;居住在本地区≥3 年;患者或患者家属同意签署知情同意书;医院伦理委员会批准了此次研究;无合并其他部位恶性肿瘤。排除标准:怀孕或哺乳期妇女;合并先天性心肝肾异常者;检测前接受异基因造血干细胞移植术的患者。
1.2 方法 HLA 基因检测:在无菌状态下取两组研究对象外周静脉血2~3 ml,抗凝后,提取单个核细胞,BS 洗涤,1450 r/min 离心10 min,弃上清液,重悬细胞,提取总RNA,逆转录为cDNA,采用聚合酶链式反应(PCR)方法检测HLA-A、HLA-B、HLA-DRB1 基因型与表达情况。
1.3 观察指标 分析两组HLA-A、HLA-B、HLADRB1 等位基因分布情况。对比两组HLA-A、HLA-B、HLA-DRB1 等位基因突变率,WBC、RBC、PLT 异常率,红细胞参数(MCV、MCH、MCHC、RDW)。并分析HLA 等位基因突变率与各指标的相关性,以及慢性粒细胞白血病发生的影响因素。
1.4 统计学方法 采用SPSS19.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验;相关性检验采用Pearson(计量)及Spearman(计数)相关分析;影响因素分析采用Logistic 回归分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组HLA-A、HLA-B、HLA-DRB1 等位基因分布情况 两组共检出13 个HLA-A 基因、22 个HLA-B 基因和11 个HLA-DRB1 基因,呈现较高的基因多态性。
2.2 两组HLA-A、HLA-B、HLA-DRB1 等位基因突变率对比 白血病组的HLA-A、HLA-B、HLA-DRB1等位基因突变率分别为12.5%、18.8%和10.9%,高于对照组的1.6%、4.7%和0,差异有统计学意义(P<0.05)。见表1。

表1 两组HLA-A、HLA-B、HLA-DRB1 等位基因突变率对比[n(%)]
2.3 两组WBC、RBC、PLT 异常率对比 白血病组的WBC、RBC、PLT 异常率分别为96.9%(62/64)、53.1%(34/64)和70.3%(45/64),高于对照组的1.6%(1/64)、3.1%(2/64)、1.6%(1/64),差异具有统计学意义 (P<0.05)。
2.4 两组红细胞参数对比 白血病组的MCH、MCHC低于对照组,RDW、MCV 高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组红细胞参数对比 ()
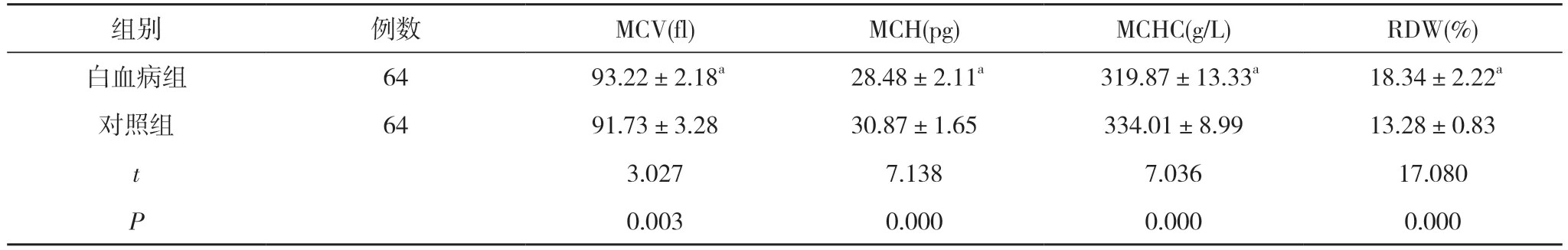
表2 两组红细胞参数对比 ()
注:与对照组对比,aP<0.05
2.5 相关性分析 白血病组患者相关性分析显示,HLA 等位基因突变率与WBC、RBC、PLT 异常率和RDW 呈正相关,与MCHC 呈负相关(P<0.05)。见表3。

表3 白血病组患者血液各指标与HLA 基因突变率的相关性
2.6 影响因素分析 Logistic 回归分析显示,HLA 等位基因突变率与WBC、RBC、PLT 异常率和RDW 呈正相关,与MCHC 呈负相关(P<0.05)。见表4。
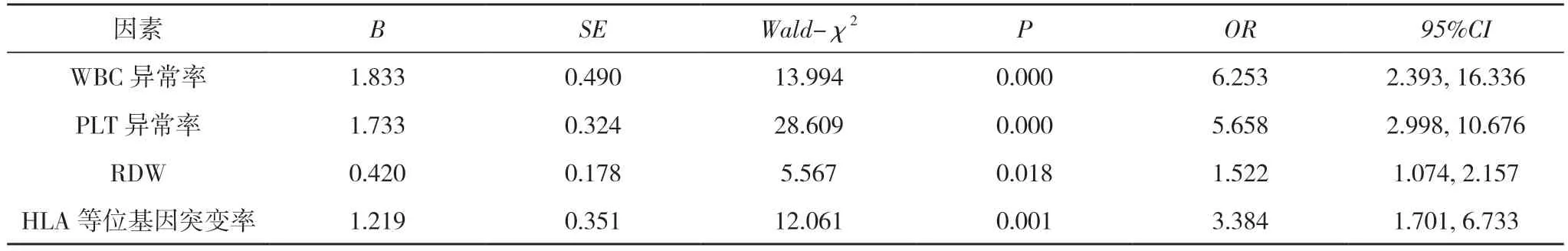
表4 影响慢性粒细胞白血病发生的多因素分析
3 讨论
慢性粒细胞白血病是一种以髓系增生为主的造血干细胞恶性肿瘤,BCR-ABL 融合基因是该病发生的分子生物学基础,费城染色体形成是其标志性的细胞遗传学特征[8]。慢性粒细胞白血病多发生于男性,从机制上分析,慢性粒细胞白血病患者会多伴随白细胞升高,诊断时白细胞通常>25×109/L,50%左右的患者白细胞高达100×109/L。50%的患者血小板在诊断时升高,部分可>1000×109/L[9]。红细胞及血红蛋白在患者早期诊断时可正常,随着疾病进展逐渐下降。MCV、MCH、MCHC、RDW 可反映机体红细胞大小和血红蛋白的改变,通常用于贫血类型的诊断[10]。本研究显示白血病组的MCH、MCHC 低于对照组,RDW、MCV高于对照组,差异有统计学意义(P<0.05)。其中RDW反映了外周血红细胞体积异质症,是利用血细胞自动分析仪对红细胞体积进行测量与处理获得的参数。高RDW 水平表明机体免疫功能受损,伴随有全身炎症状态、氧化应激,可导致机体出现肿瘤、营养缺乏和骨髓功能障碍等疾病。MCH、MCHC的低表达可导致核酸、蛋白质和脂质的氧化损伤,降低了红细胞的寿命,使外周血红细胞体积异质性增加,从而导致RDW、MCV增加。
随着分子生物学实验技术的进展,80%~90%的慢性粒细胞白血病患者有克隆染色体异常,也伴随有多基因多态性[11]。HLA 是位于人第六号染色体短臂上的一群高度多态性的紧密连锁基因群,HLA-A、HLA-B、HLA-DRB1 是等位基因最多的3 个HLA 基因座,与机体的自身免疫密切相关[12]。HLA 基因组的多态性主要在外显子2 和3,可导致核苷酸出现沉默置换或同义突变,不引起氨基酸种类的改变,减少了HLA 蛋白水平的多态性[13]。本研究显示两组128 例入选者中检出13 个HLA-A 基因、22 个HLA-B 基因和11 个HLA-DRB1 基因,呈现较高的基因多态性;白血病组的HLA-A、HLA-B、HLA-DRB1 等位基因突变率分别为12.5%、18.8%和10.9%,高于对照组的1.6%、4.7%和0,差异有统计学意义(P<0.05)。从机制上分析,HLA 突变可以诱导特异性细胞毒T 细胞产生,导致机体出现肿瘤免疫逃逸状况,从而诱发白血病[14]。
慢性粒细胞白血病患者的血细胞不仅有量的变化,同时也存在形态学的变化,观察其变化规律有助于慢性粒细胞白血病的诊断及预后判断。本研究相关性分析显示,慢性粒细胞白血病患者的HLA 等位基因突变率与WBC、RBC、PLT 异常率和RDW 呈正相关,与MCHC 呈负相关(P<0.05);Logistic 回归分析显示,HLA 等位基因突变率、RDW 及WBC、PLT 异常率为导致慢性粒细胞白血病发生的影响因素(P<0.05)。从机制上分析HLA 基因作为一种遗传标记,表达于人体几乎所有有核细胞表面,并与T 细胞受体分子、免疫细胞表达的免疫球蛋白同参与免疫识别和免疫应答。HLA 等位基因突变可以抑制HLA 表达产物和抑制性受体直接结合,加重外周血自然杀伤细胞(NK)的细胞毒作用,从而诱发机体恶性肿瘤的发生[15]。本研究也存在一定的不足,纳入的患样本量比较少,没有进行HLA 多个位点的分析,且形态学分析指标比较少,将在后续研究中进行探讨。
总之,慢性粒细胞白血病的发病机制是多因素、复杂的,HLA 作为人体最复杂的抗原系统,慢性粒细胞白血病多伴有血液检查异常与HLA 等位基因突变,两者存在相关性。
