利福平致肝损害机制及基因多态性研究进展
2022-01-18陈智慧综述刘泉波审校重庆医科大学附属儿童医院儿童发育疾病研究教育部重点实验室国家儿童健康与疾病临床医学研究中心儿童发育重大疾病国家国际科技合作基地儿科学重庆市重点实验室重庆400014
陈智慧 综述,刘泉波 审校 (重庆医科大学附属儿童医院,儿童发育疾病研究教育部重点实验室,国家儿童健康与疾病临床医学研究中心,儿童发育重大疾病国家国际科技合作基地,儿科学重庆市重点实验室,重庆 400014)
抗结核药物不良反应以药物性肝损害(drug-induced liver injury,DILI)最多见,危害性也最大[1]。研究显示,我国涉及的主要药物性肝损害中,抗结核药物致肝损害(anti-tuberculosis drug-induced hepatotoxicity,ATDH)占人群总发病率的21.99%,位居第二[2],儿童结核患者中ATDH发病率约为8.80%[3]。ATDH可致抗结核治疗选药方案变化以及诱发耐药,且二线抗结核药物价格昂贵,均导致抗结核治疗困难,可能引起治疗中断甚至危及生命,给个人、家庭及社会造成沉重的负担。利福平(rifampicin,RFP)是目前抗结核治疗中广泛使用并引起ATDH的一线药物之一,但其引起肝损害的具体机制尚不明确,本文就RFP致肝损害的机制及其基因多态性相关研究进展进行综述。
1 利福平导致的肝损害
DILI根据发病机制分为固有型和特异质型,RFP所致ATDH多为固有型,其所致肝损害呈浓度及时间依赖性,具有可预测性[1,4]。临床中抗结核治疗以联合用药为主,利福平可与其他药物相互作用,常引起肝细胞损伤型或胆汁淤积型肝损害[1,5]。RFP导致的肝脏组织病理学改变,多表现为急性肝炎、带状坏死及胆汁淤积性肝炎[6],镜下可见肝细胞脂肪变性,伴轻度坏死和炎症,部分线粒体、内质网肿胀断裂,以及散在的胆汁淤积[7-8]。
2 利福平致ATDH发病机制
RFP致ATDH的发病机制较复杂,具体机制尚不明确,可能有多种机制共同参与,如线粒体氧化应激、内质网应激、肝细胞凋亡增加、胆汁淤积、PXR激活诱导多种药物代谢酶及转运蛋白的活性和表达水平增加等。
2.1 利福平增加应激反应引起肝细胞凋亡致肝损害
RFP可通过线粒体氧化应激、内质网应激,增加肝细胞的凋亡率,降低肝细胞的存活率,其所致细胞毒性具有浓度及时间依赖性[4,9-10]。利福平可使线粒体超微结构产生病理改变引起线粒体功能障碍,导致活性氧的过度产生和细胞色素C的释放,诱导细胞凋亡、坏死和纤维化[10]。利福平与异烟肼(isoniazid,INH)联合用药时,由于肝脏中谷胱甘肽(glutathione,GSH)合成无法应对机体需求的增加或药物活性代谢物的消耗性利用,导致GSH稳态失衡,引起线粒体氧化应激增加,诱导线粒体通透性改变导致肝细胞凋亡损伤[11]。GSH可与多种药物的毒性中间代谢产物结合,并排出体外起到解毒作用[12],GSH消耗过多可致肝脏毒性产物集聚,进一步加重肝损害。
RFP通过激活PERK-ATF4-CHOP途径,增加葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)、蛋白激酶R样内质网激酶(protein kinase R-like ER kinase,PERK)、转录激活因子(activa-ting transcription factor 4,ATF4)、C/EBP同源蛋白(C/EBP homologous protein,CHOP)的蛋白和基因表达水平,从而影响内质网应激,介导细胞凋亡[9]。内质网中未折叠或错误折叠的蛋白质累积也可导致内质网应激,进而激活未折叠蛋白反应,诱导适应性反应以重建内质网功能并恢复体内平衡[13],如果应激信号严重和/或延长,则细胞凋亡途径被激活[14],从而导致肝损害。
但另一方面,RFP也可通过激活腺苷酸活化蛋白激酶α(AMP-activated protein kinase α,AMPKα)介导核因子E2相关因子2/血红素加氧酶-1(nuclear factor erythroid 2-related factor 2/heme oxygenase 1,Nrf2/HO-1)信号通路,对肝脏起到一定程度抗氧化应激的保护作用[15]。
2.2 利福平引起肝内胆汁淤积致肝损害
多项动物实验研究表明,RFP可引起小鼠肝内胆汁淤积。研究发现,利福平可抑制胆汁酸转运蛋白及mRNAs的表达,如胆盐输出泵(bile salt export pump,BSEP,由ABCB11编码)、Na+/牛磺胆酸盐转运蛋白(Na+/taurocholate cotransporter,NTCP,由SLC10A1编码)、多药耐药蛋白1(multidrug resistance protein 1,MDR1,由ABCB1编码)、多药耐药蛋白2(multidrug resistance-associated protein,MRP2,由ABCC2编码)、有机阴离子转运多肽2(organic anion transporting protein 2,OATP2,由SLCO1B1编码)、有机溶质转运蛋白β(organic solute transporter β,OSTβ)。这些因子影响胆汁酸循环,血清中结合胆红素、总胆汁酸的水平显著升高,导致胆汁淤积及肝功能损害[4,12,16-18],但具体发生机制仍待进一步研究。Xu B Y等[19]研究发现,RFP可通过氧化应激激活蛋白激酶C-细胞外信号调节激酶/c-Jun氨基末端激酶/p38(protein kinase C-extracellular signal-regulated kinase/c-Jun N-terminal kinase/p38,PKC-ERK/JNK/p38)和磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)信号通路,引起网格蛋白介导的内吞作用和泛素-蛋白酶体降解MRP2,使MRP2在细胞膜的分布减少,抑制MRP2表达,导致胆汁淤积。熊去氧胆酸和丹参酮ⅡA通过Nrf2介导适应性应答,增加胆汁酸转运蛋白表达则能减轻肝损害[4,20]。RFP还可影响紧密连接蛋白如ZO-1蛋白和闭合蛋白的连续性,破坏肝细胞连接,诱导肝内胆汁淤积[7]。肝功能受损后肝脏中有毒胆汁盐逐渐积累,激活GRP78和CHOP等蛋白的基因表达,促进未折叠蛋白反应[21],增加肝细胞凋亡。
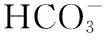
2.3 利福平通过人孕烷X受体途径引起肝毒性物质积聚致肝损害
RFP为人孕烷X受体(pregnane X receptor,PXR)特异性配体,可引起PXR蛋白过表达和活化,诱导多种药物代谢酶及转运蛋白的活性和表达水平增加[25],可增加RFP自身及其他药物代谢,并使卟啉、脂质及胆红素等物质在机体内积聚导致肝损害。
原卟啉IX(protoporphyrin IX,PPIX)是卟啉生物合成的中间体,通常在肝脏中浓度非常低,肝脏中高浓度的PPIX会导致肝损伤。RFP与INH联用时通过PXR介导改变血红素生物合成途径,导致肝脏中内源性肝毒素PPIX积聚并致毒性作用[26]。而氨基乙酰丙酸合成酶(aminolevulinic acid synthase,ALAS)是卟啉生物合成中的限速酶,PXR的激活可上调肝脏中的ALAS1表达[27],使其产物ALA增加,ALA是PPIX的前体,进而引起PPIX积聚导致肝损害。
过氧化物酶体增殖体激活受体γ(peroxisome proliferator-activated receptor,PPARγ)信号通路是PXR的一个下游靶点,RFP通过活化PXR诱导PPARγ信号通路及其靶基因表达上调,促使循环系统的甘油三酯转向肝脏;另外脂肪酸合成的相关mRNA(Fas、Acc、Scd-1)表达上调,促进脂肪合成,加剧脂质在肝脏的积聚[28]。表达上调的PPARγ信号通路下游可检测到围脂滴蛋白,该蛋白可促进脂滴成熟并抑制脂肪的分解,导致甘油三酯聚集,但该传导途径未表现出剂量依赖性,引起的脂质积聚主要是低剂量RFP的毒性作用[29]。在另一项动物实验研究中,高剂量RFP(>20 mg/kg)可通过间接激活mPXR的核转位,诱导CYP3A11等PXR靶基因的反式激活,增加CYP3A在小鼠肝脏中的表达,而CYP3A高表达可能会引起总胆固醇和低密度脂蛋白胆固醇升高[29-30]。
PXR蛋白过表达和活化也增加CYP3A4和CYP2B6表达,促进INH产生肝毒性代谢产物[25,31],熊果酸和齐墩果酸通过抑制PXR的反式激活作用,降低其表达则可减轻肝损害[32-33]。对于合并有艾滋病的结核患者,PXR还可通过CYP3A4依赖性途径参与利托那韦生物活化、氧化应激和内质网应激导致肝毒性[34]。由于胆红素的清除需要表达尿苷二磷酸葡萄糖醛酸转移酶(UDP-glucuronosyltransferase,UGT),RFP引起的高胆红素血症可能与PXR对UGT1A表达的负调节作用有关[29]。
2.4 其他
在以往KEGG通路富集分析中,PPARγ信号通路、CYP参与的异生素代谢、GSH代谢、化学致癌作用和酒精毒性作用相关蛋白表达在RFP处理后的动物肝脏中呈剂量依赖性增加[29],对肝脏功能均产生一定影响。
3 利福平致ATDH相关基因多态性
在中国人群发现,ABCB11基因的rs2287616位点与抗结核药物诱导的胆汁淤积型肝损害有关[17];OATP1B1的521T>C位点与利福平所致的肝损害尤其是胆汁淤积型肝损害密切相关[35];SLCO1B1基因的rs4149014位点、SLCO1B1*15单倍体[36],SLCO1B1基因的rs2417957位点T/T基因型、rs4149063位点T/T基因型和TGTG、TTTC和GTTC单倍型[37],以及Nrf2基因中rs4243387位点T/C基因型或rs2001350、rs6726395位点单倍型C-C[38]也与ATDH风险增加相关。转录因子BTB-CNC异体同源体(BTB domain and CNC homologue 1,Bach1)可与Nrf2竞争结合DNA,中国人群中Bach1的遗传多态性也可能与ATDH易感性有关[39],日本人群中Bach1基因rs2070401位点C/C基因型更是发生ATDH的独立危险因素[40]。
PXR基因在中国人群中的rs2461823-AA基因型[41]和印尼人群中的rs3814055-TT基因型[42]与ATDH风险增加相关,而PXR基因的rs7643645-AA基因型[41]、rs3814055变异型[43]、次要等位基因rs7643645和H0010001单倍型[44]与ATDH风险降低有关。巴西人群中CYP2B6基因的rs3745274位点516TT纯合子变异型与RFP-INH导致的ATDH有关[31],中国人群中携带有CYP2B6*6/*6的男性患者发生ATDH风险也更高[45]。Huai C等[46]通过全基因组关联分析及CRISPR/cas9介导的甲基化修饰细胞模型,证明AK2、SLC8A2和PSTPIP2基因区域或其附近的4个CpG位点与利福平治疗后的细胞应答反应有关,并参与引起肝损害。
4 结语
ATDH是全球严重的药物不良反应,可影响抗结核治疗疗效。近年国内外大量研究发现了ATDH的一些高危因素及易感基因,但由于ATDH机制的复杂性以及相关基因的多态性,不同抗结核药物单独或相互作用导致肝损害的机制尚不完全清楚,了解ATDH发生机制有助于我们提前预测和识别抗结核药物与ATDH的相关性及严重程度,减少肝损害的发生,为结核患者的个体化及精准治疗提供理论基础。但目前研究发现的易感基因包含SNP位点较少,也缺乏多种族、多中心的大样本研究,尚不能作为独立的分子生物标志物指导临床抗结核治疗,未来全基因组关联分析将更多的应用于结核病研究,逐渐展开更深入的分子遗传机制研究。
