颅内血肿清除术与亚低温疗法治疗高血压脑出血临床观察
2022-01-18田洋洋
田洋洋 齐 远 张 晶
吉林大学第一医院,吉林 长春 130021
作为神经外科常见的疾病之一,高血压脑出血多发于中老年人群,影响病人身体健康,更是造成病人家庭和社会较大的负担。随着近年来老龄化程度的不断加剧,使得高血压脑出血的患病人数逐年增加,危及患者生命安全。高血压脑出血的发病主要是因高血压造成颅内血管破裂,即血压长时间处于高水平使颅内小血管和穿支血管出现退行性改变,进而出现破裂,致颅内血肿对脑组织造成压迫[1-2]。据报道,在颅内自发性出血中,高血压脑出血的占比约为60%,出血性脑卒中是其中常见的一种并发症,亦是病人死亡的主要原因之一,同时部分病人可出现术后不同程度的神经功能损伤,降低生活质量[3]。国内外对高血压脑出血本身及其危害性的认识逐渐加深,但其治疗方法仍有待提升,对于颅内血肿清除术、小骨瓣血肿清除手术孰优孰劣,目前并无确切统一的意见。
脑出血患者行颅内血肿清除术后颅内高压明显下降,且受压神经元得以恢复。药物治疗、颅内血肿清除术、亚低温疗法是目前临床治疗高血压脑出血的常用方法,其中颅内血肿清除术具有直接改善颅内压的作用[4-5]。研究表明,采用微创颅内血肿清除术可有效改善脑出血患者血清炎症因子水平,同时可促进患者神经功能的恢复,具有良好的临床疗效[6]。亚低温疗法可有效调节患者脑部耗氧量,促进脑部微循环,具有保护神经元的作用,因而近年来广泛应用于高血压脑出血患者的临床治疗[7-8]。亚低温疗法旨在通过控制温度,使之维持在28~35 ℃,并通过减少脑耗氧量和脑代谢、减轻炎症反应、促进脑部微循环、减少脑组织中乳酸的大量堆积、抑制脑细胞结构蛋白的破坏等多种途径发挥保护神经元的作用[9-11]。本研究探讨颅内血肿清除术联合亚低温疗法对高血压脑出血患者血清炎症细胞因子、神经功能缺损程度及预后的影响。
1 资料与方法
1.1 一般资料以吉林大学第一医院2017-01—2018-12接诊的94例高血压脑出血患者为观察对象,对照组和试验组各47 例。对照组男28 例,女19 例;年龄31~78(57.98±9.25)岁;出血部位:脑叶2例,丘脑11例,基底核区34例。试验组男25例,女22例;年龄35~79(56.08±8.73)岁;出血部位:脑叶3 例,基底核区31 例,丘脑13 例。2 组一般资料比较均无明显差异(P>0.05)。纳入标准:无其他严重急慢性疾病;符合高血压脑出血的诊断标准;获得研究对象知情同意。排除标准:因颅脑外伤引起的脑出血;不耐受亚低温疗法者;伴精神性疾病、传染性疾病者;合并血液系统疾病、恶性肿瘤、自身免疫性疾病、痛风、老年性痴呆者;治疗依从性差,中途退出者。
1.2 治疗方法对照组给予颅内血肿清除术:清洁患处皮肤,采用CT定位,明确穿刺处,采用颅内血肿锥颅器直达颅内,置入引流管,通过注射器抽出血肿内液体,采用生理盐水冲洗。抽出液体变清后,注射尿激酶20 000 U,4 h 夹管,开放引流。复查CT,若提示血肿基本消除或消失,则拔出引流管。
试验组给予颅内血肿清除术+亚低温疗法,其中颅内血肿清除术步骤与对照组相同,亚低温疗法:于术后6 h采用水循环式降温毯进行降温,维持肛温33~35 ℃,治疗停止后关闭冰毯机,在室温下复温,治疗7 d。
1.3 典型病例见图1、图2。

图1 A:术前颅脑多排CT平扫显示右侧基底节、放射冠和颞顶叶见团片状高密度影;B:术后即刻复查CT颅脑多排CT平扫显示右侧基底节、放射冠和颞顶叶见斑片状高低混杂密度影;C:术后第8天颅脑多排CT平扫显示右侧基底节、放射冠和颞顶叶见斑片状高低混杂密度影Figure 1 A: Preoperative multi-slice cranial CT scan showed the right basal ganglia, corona radiating and temporal parietal lobe with clusters of high-density shadows; B: Immediately postoperative re-examination of CT cranial multi-slice CT showed patchy high and low density shadows in the right side of basal ganglia,corona radiata and temporal parietal lobe; C: On the 8th day after operation, a multi-slice CT scan of the brain showed patchy high and low density shadows in the right side of basal ganglia, corona radiata and temporal parietal lobe

图2 A:术前颅脑多排CT平扫显示右侧基底节、放射冠和颞顶叶见团片状高密度影;B:术后即刻复查CT颅脑多排CT平扫显示右侧基底节、放射冠和颞顶叶见团片状高密度影;C:术后第9天颅脑多排CT平扫显示右侧基底节、放射冠和颞顶叶见团片状高密度影Figure 2 A:Multi-slice CT plain scan of the brain before operation shows the right basal ganglia, corona radiation and temporal parietal lobe with clusters of high-density shadows; B: Re-examination of the brain immediately after the operation of multi-slice CT plain scans shows clusters of high-density shadows in the right basal ganglia,radiation crown and temporal parietal lobe;C:On the 9th day after surgery,multi-slice CT scan showed clusters of high-density shadows in the right basal ganglia, radiation crowns and temporal parietal lobes
1.4 观察指标分别于治疗前1 d 和治疗后2 周取2 组患者清晨空腹肘前静脉血3 mL,3 000 r/min 离心10 min,置于 80 ℃冰箱中保存待测。血清C 反应蛋白(C-reactive protein,CRP)测定采用免疫比浊法,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)测定采用酶联免疫吸附法。分别于治疗前1 d 和治疗后8 周评估患者日常生活活动能力,采用Brathel 指数量表,总分100 分,评分越高说明病情恢复越好[12];神经功能缺损程度采用美国国立卫生研究院卒中量表(National Institutes of Health stroke scale,NIHSS)评估,分值越高说明缺损越严重[13]。治疗后8 周的预后情况采用格拉斯哥预后分级(Glasgow outcome scale,GOS)量表评估,Ⅰ级:死亡;Ⅱ级:长期昏迷,植物生存;Ⅲ级:日常生活不能自理,重度残疾;Ⅳ级:轻度残疾,但对日常生活影响不明显;Ⅴ级:病情恢复良好,可恢复正常的日常生活[14]。
1.5 统计学方法采用SPSS 23.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,采用t 检验,计数资料用率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 炎症细胞因子2 组治疗前血清炎症细胞因子水平比较无明显差异(P>0.05)。相比治疗前,治疗后2 周2 组血清CRP 和TNF-α水平均明显下降(P<0.05);相比对照组,试验组治疗后2 周血清CRP 和TNF-α水平均明显下降(P<0.05)。见表1。
表1 2组炎症细胞因子比较 (±s)Table 1 Comparison of inflammatory cytokines in two groups (±s)

表1 2组炎症细胞因子比较 (±s)Table 1 Comparison of inflammatory cytokines in two groups (±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
组别对照组n 47试验组47时间治疗前治疗后2周治疗前治疗后2周CRP(mg/mL)31.14±6.08 20.77±5.48*28.68±7.26 11.17±3.07*#TNF-α(ng/mL)3.65±0.69 2.09±0.47*3.59±0.53 1.48±0.37*#
2.2 Brathel指数和NIHSS评分2组治疗前Brathel 指数和NIHSS 评分比较无明显差异(P>0.05)。与治疗前比较,2 组治疗后8 周Brathel指数均明显升高,NIHSS评分均明显下降(P<0.05);与对照组比较,试验组治疗后8周Brathel指数明显升高,NIHSS评分明显下降(P<0.05)。见表2。
表2 2组Brathel指数和NIHSS评分比较 (分,±s)Table 2 Comparison of Brathel index and NIHSS score in two groups (scores,±s)
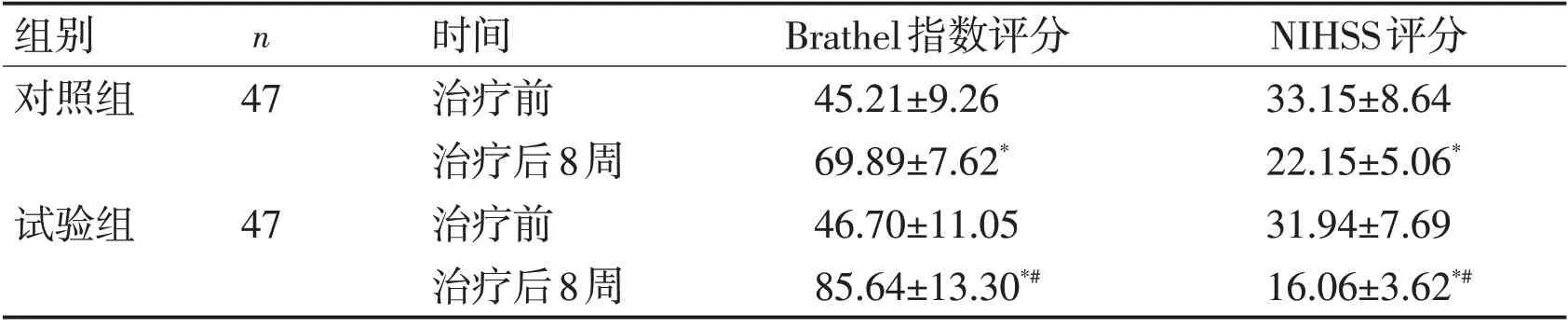
表2 2组Brathel指数和NIHSS评分比较 (分,±s)Table 2 Comparison of Brathel index and NIHSS score in two groups (scores,±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
组别对照组n 47试验组47时间治疗前治疗后8周治疗前治疗后8周Brathel指数评分45.21±9.26 69.89±7.62*46.70±11.05 85.64±13.30*#NIHSS评分33.15±8.64 22.15±5.06*31.94±7.69 16.06±3.62*#
2.3 GOS分级治疗后8周,2组GOS评估情况比较存在明显差异(P<0.05),见表3。

表3 2组GOS分级情况比较 [n(%)]Table 3 Comparison of GOS classification in two groups [n(%)]
3 讨论
作为高血压患者常见的一种并发症,脑出血的致残率和病死率均高。亚低温疗法是利用物理原理有效控制病人体温,使之维持在正常水平,进而发挥治疗作用,目前该疗法广泛应用于神经科的临床治疗和干预。局部亚低温疗法是近年来兴起的一种新型治疗方法,与全身亚低温治疗效果相当,但可有效预防全身亚低温引起的不良反应[15]。随着体温的升高,脑组织耗氧量增多,可能会引起意识状态异常,而头部局部亚低温疗法既可明显减少脑组织耗氧量,也可明显降低颅内压[16]。
头部局部亚低温疗法可通过增加人体血清中超氧化物歧化酶的活性,有效改善患者神经功能,进而起到脑保护的效果[17]。同时,该疗法相对安全、有效,不会引起严重不良反应,可及时提升整体治疗效果,提升预后,降低病死率。研究指出亚低温治疗对缺血缺氧损伤具有良好的神经保护功能,其相关机制主要有以下几点[18]:减少大量乳酸堆积于脑组织内;减少脑组织耗氧量;抑制钙离子内流,减轻钙对神经元的毒性效应;保护血脑屏障,缓解脑水肿程度;缓解弥漫性轴索损伤;减小内源毒性物质(如儿茶酚胺、乙酰胆碱)对脑细胞的损伤效应;缓解脑细胞结构蛋白的受损,加快细胞结构及其功能的修复。另有研究表明,亚低温疗法可通过提升体内各种酶的活性,减轻脑缺血引起的神经细胞损害;保护脑出血患者血脑屏障,进而有效控制颅内压水平[19];抑制高血压脑出血患者体内的炎性状态,控制血管活性物质的表达,减轻神经细胞的炎症反应,抑制细胞凋亡或坏死;通过减缓大脑对氧、葡萄糖的代谢速度,抑制三磷酸腺苷的丢失,减少脑继发性能量损耗,进一步抑制自由基等细胞毒素的堆积,抑制有毒物质的生成,进而发挥减轻脑细胞损伤的作用[20]。
研究报道,老年脑出血患者应用立体定向血肿穿刺置管引流术联合亚低温疗法可有效改善神经功能,提高患者生存质量[21]。研究显示,在微创清除术治疗的同时,应用亚低温疗法可有效提升脑出血患者的治疗效果,改善患者预后[22]。本研究显示,与治疗前比较,2 组治疗后8周Brathel指数明显升高,NIHSS评分明显下降;与对照组比较,试验组治疗后8 周Brathel 指数明显升高,NIHSS 评分明显下降。此外,治疗后8周2组GOS分级比较存在明显差异,表明颅内血肿清除术联合亚低温疗法可明显减轻高血压脑出血患者神经功能缺损程度,改善预后。
研究指出,脑出血患者治疗效果的优劣与出血灶、血清炎症细胞因子水平均存在密切关系[23]。TNF-α是一种重要的细胞因子,由单核巨噬细胞分泌而成,其在不同人体生理过程中发挥显著的调节作用[24-29]。TNF-α水平与机体创伤程度密切相关,在早期脑出血的血肿周围,局部血管组织破坏、神经细胞受损导致炎症反应的发生,进而导致大量的TNF-α产生[30-35]。脑组织受损时CRP水平骤然增高,可导致脑损伤加重。通过检测血清TNF-α与CRP 水平有助于评估脑出血患者炎症反应状态和病情严重程度。本研究发现,相比治疗前,2 组治疗后2 周血清TNF-α和CRP 水平均明显下降;相比对照组,试验组治疗后2 周血清TNF-α和CRP水平均明显下降,表明颅内血肿清除术联合亚低温疗法可有效降低高血压脑出血患者炎症细胞因子水平,减轻机体炎症反应程度。
颅内血肿清除术联合亚低温疗法不仅有效降低高血压脑出血患者促炎细胞因子水平,且明显减轻患者神经功能缺损程度,改善预后情况,有助于提高患者生活质量。
