慢性阻塞性肺疾病合并慢性病贫血患者全身炎症指标变化分析
2022-01-18于彦玲阚小堤郑院青
于彦玲 阚小堤 郑院青
作者单位:中国平煤神马集团职业病防治院呼吸科,河南 平顶山 467000
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种肺气流受限伴多种病理性改变的慢性呼吸系统疾病。多项研究表明[1~4]:COPD 与全身性炎症改变以及慢性病贫血(Anemia of chronic disease,ACD)的发生密切相关。有文献报道[5]:ACD 为一种慢性免疫激活紊乱性疾病,其发病机理与促炎细胞因子水平升高有关,如白细胞介素-1(IL-1)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、肿瘤坏死因子α(TNF-α)、γ干扰素(IFN-γ)、C-反应蛋白(CRP)等炎症介质可通过一系列不同的机制损害正常红细胞而引起ACD 发生。Vasquez 等[6]研究发现COPD 人群中ACD 的患病率为7.5%~21.0%。然而,关于炎症与COPD 合并ACD关系的研究较少,因此本研究通过比较炎症介质水平与COPD 发生ACD 的相关性,为COPD 合并ACD的早诊断和早治疗提供一定的理论依据。
1 材料与方法
1.1 研究对象采用前瞻性病例对照研究,选取2019年3月~2021年3月我院60 例无贫血的稳定期COPD 患者作为对照组,60 例稳定期COPD 合并ACD 患者作为观察组。纳入标准:①年龄≥18 周岁;②临床稳定期COPD;③知情并同意参加本次研究。排除标准:①伴有急性或慢性感染;②除COPD以外的全身性炎症或自身免疫性疾病;③患有肾小球滤过率(eGFR)<60ml·min-1·1.73m-2的肾病;④甲状腺疾病、哮喘病史、肝硬化;⑤有心力衰竭(左心室射血分数<55%)、不稳定型心绞痛、急性心肌梗死或未控制的心律失常病史;⑥有恶性肿瘤史、血液疾病史以及过去3 个月内有胃肠道或其他出血病史。
通过详细的病史、体格检查和肺功能检测以确定COPD 稳定期患者。稳定期COPD 患者均采血进行血常规和生化指标检测,以及血清铁、铁蛋白、总铁结合力(TIBC)、维生素B12和叶酸水平检测。本研究方案获得我院伦理委员会批准,参与者在参与研究前均签署知情同意书。
1.2 诊断标准采用标准肺量计技术(PFT)获得患者肺容量、吸气量、弥散量和呼气流量,将沙丁胺醇给药后15min 测量的第1 秒用力呼气容积(FEV1)与用力肺活量(FVC)比值<0.7 定义为患有COPD。如果患者在之前3 个月内未发生急性加重、住院、呼吸道感染或药物变化,则将其描述为临床稳定期。
ACD诊断标准:①血红蛋白(Hb):男性<130g/L,女性<120g/L;②无任何其他潜在原因引起的贫血;③血清铁蛋白浓度正常或升高(>30ng/ml);④TIBC降低(<250mg/dl);⑤转铁蛋白饱和度降低(>15%且<50%);⑥叶酸水平正常。
1.3 检测方法使用自动分析仪测量血常规和生化指标,通过流式细胞微珠阵列(CBA)和流式细胞术测定血清IL-1、IL-6、IL-10、TNF-α和IFN-γ水平。使用酶联免疫吸附剂测定(ELISA)试剂盒检测血清促红细胞生成素(EPO)水平,使用IMMAGE®800 免疫化学系统通过速率散射比浊法测定CRP水平。
1.4 统计学方法使用SPSS 26.0 软件进行统计学分析,连续变量采用均数±标准差表示,采用Kolmogorov-Smirnov 检验分布的正态性。为了评估两个研究组之间的差异,对分类变量使用χ2检验,对连续变量使用独立样本t检验或Mann-Whitney U 检验。使用Spearman 相关性检验分析各参数之间的相关性,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较观察组Hb 水平明显低于对照组,差异有统计学意义(t=9.861,P=0.002)。而两组在年龄、性别、FEV1、体质指数(BMI)、红细胞平均体积(MCV)、红细胞平均血红蛋白含量(MCH)、红细胞平均血红蛋白浓度(MCHC)和动脉血氧分压(PO2)等指标之间的差异无统计学意义(P>0.05)。见表1。
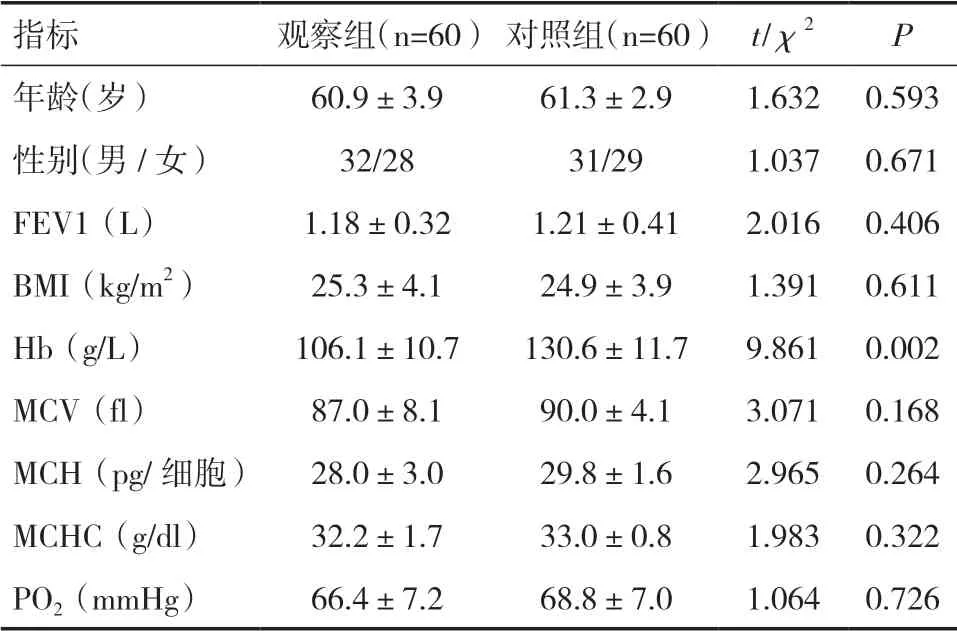
表1 两组患者一般资料比较
2.2 两组外周血清炎症指标和EPO 水平比较观察组外周血清中IL-1、IL-6、IL-10、TNF-α、IFN-γ、CRP 等炎症指标和EPO 水平显著高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 外周血清炎症指标和EPO 水平比较(±s)

表2 外周血清炎症指标和EPO 水平比较(±s)
指标观察组(n=60)对照组(n=60)tP IL-1(pg/ml)31.6±2.916.3±3.49.563 0.009 IL-6(pg/ml)26.5±1.714.9±1.410.764 0.003 IL-10(pg/ml)20.6±2.44.5±0.87.943 0.012 TNF-α(pg/ml)37.3±5.19.4±1.76.977 0.024 IFN-γ(μg/ml)16.1±1.42.6±0.812.753 0.001 CRP(mg/L)18.0±3.16.4±1.74.071 0.036 EPO(mIU/ml)21.4±3.79.6±2.33.965 0.041
2.3 外周血清炎症指标和EPO 与COPD 合并ACD发生的相关性分析采用Spearman 相关分析,探讨外周血清炎症指标和EPO 与COPD 合并ACD 发生的相关性,结果显示IL-1、IL-6、IL-10、TNF-α、IFN-γ、CRP 等炎症指标和EPO 与COPD 合并ACD发生均呈正相关,相关系数r依次为2.605、3.287、1.905、2.672、3.027、1.683、3.129,P<0.05。
3 讨论
炎症细胞因子可通过几种途径损害正常的红细胞生成过程。有文献报道[7]:一些炎症细胞因子能抑制EPO 生成,下调骨髓红系祖细胞的分化,进而导致患者出现贫血症状。Yu 等[8]研究发现:IL-10 升高可增加对红系祖细胞的抑制从而引起贫血,并且在B 细胞淋巴瘤患者中IL-10 升高与贫血相关。在克罗恩病患者中,使用IL-10 作为免疫调节剂治疗可导致ACD 的发生[9]。多项研究认为炎症与ACD 的发生密切相关,炎症是ACD 的诱发因素[10~12]。并且研究还发现大多数ACD 患者对EPO耐药,而炎症被认为是其对EPO 耐药的主要原因[13,14]。有学者分析炎症细胞因子如CRP、IL-1、TNF-α 和IFN-γ 对正常红细胞生成的影响,结果发现EPO 治疗的耐药性与上述炎症细胞因子水平升高密切相关[15]。
最近还有文献报道COPD 合并ACD 的发生可能是由于IFN-γ 和/或TNF-α 等炎症因子抑制EPO 的产生,从而刺激铁调素的产生,铁调素是一种主要在肝细胞中合成的25 个氨基酸的肽,是铁稳态的主要调节因子[16]。此外,还有研究表明铁调素被急性炎症因子(如CRP、IL-1、IL-6 和IL-10)刺激后发生上调,大量铁羁留于细胞内,无法释放被利用,从而导致红细胞的生成减少,导致骨髓对EPO 的反应受损,从而诱发贫血[17,18]。
本研究检测了稳定期COPD 合并ACD 患者和稳定期COPD 无贫血患者炎症因子和EPO 水平,发现COPD 合并ACD 患者主要炎症指标(IL-1、IL-6、IL-10、TNF-α、IFN-γ 和CRP)及EPO 水平均明显高于无贫血的稳定期COPD 患者,且差异具有统计学意义(P<0.05)。上述结果表明炎症因子和EPO 水平与COPD 合并ACD 的发生密切相关。但是本研究也存在一定的局限性:①本研究是一项单中心研究,因此需要更广泛的多中心前瞻性队列研究来充分验证本研究的结果;②本研究仅得出了一些炎症指标与COPD 合并ACD 的发生具有相关性,但是具体炎症细胞因子水平对判断COPD 合并ACD 的特异性和敏感度还需要进一步的研究。
总之,本研究表明炎症介质(IL-1、IL-6、IL-10、TNF-α、IFN-γ 和CRP)及EPO 水平是诊断稳定期COPD 患者是否合并ACD 的重要指标,早期判断COPD 患者合并ACD 对采取积极有效的治疗具有重要意义,未来研究的重点可能是炎症细胞因子对判断COPD 合并ACD 的特异性和敏感度。
