1例HIV/梅毒双窗口期共感染献血者的系统追踪
2022-01-18王立林邬旭群张耿宁理卢亮刘晋洪许晓绚郑欣左佳蕙杨峥嵘赵方曾劲峰
王立林 邬旭群 张耿 宁理 卢亮 刘晋洪 许晓绚 郑欣 左佳蕙 杨峥嵘 赵方 曾劲峰★
在过去的几十年里,梅毒的总发病率在全世界范围内都有所上升[1]。由于发病的高危人群与人类免疫缺陷病毒(human immunodeficiency virus,HIV)一致(尤其是男男性接触者),梅毒HIV共感染病例较为常见。梅毒和HIV 共感染可相互影响单一病原体感染病毒学和免疫学反应过程,此外临床表现、临床诊断和疗效间的相互影响也存在争议[2]。理论上讲,一种病原体的感染可能会促进另一种病原体的感染并加速病程恶化。例如,梅毒可能通过生殖器溃疡来增加精液和阴道分泌物中的病毒载量,或通过降低CD4+T 细胞计数来增加个体对HIV 的易感性,从而促进HIV 的传播[3-4]。众所周知,梅毒可以成功治愈,早期发现HIV,也可达到临床治愈。但是,急性HIV 感染(Acute HIV-1 Infection,AHI)后早期抗病毒治疗(anti-retroviral therapy,ART)因为抑制特异性抗-HIV 抗体生成,减少HIV 抗原,降低病毒DNA/RNA 核酸浓度,会显著影响HIV 的检测[5-6]。本研究通过系统追踪,明确梅毒和HIV 共感染的窗口期患者经过早期治疗后,是否会影响早期免疫学、病毒学诊断结果及治疗效果。现报道如下。
1 材料与方法
1.1 样本信息
深圳市血液中心无偿献血者,男,42 岁,汉族,工人,已婚,2018年4月6日(分别为第一次和第二次高危性行后41 天和35 天)在深圳市血液中心第19 次捐献全血。献血者问询及体检未发现异常及高危风险。本研究经深圳市血液中心医学伦理委员会批准,献血者已签署知情同意书。
1.2 试剂与仪器
乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)(Murex,雅培公司,美国);丙型肝炎病毒抗体(Human anti hepatitis C virus antibody,anti-HCV)(ORTHO,强生公司,美国);第四代Genscreen ULTRA-HIV Ag-Ab 试 剂(抗-HIV1,Genscreen ULTRA,伯乐公司,美国);第三代抗-HIV 试剂(抗-HIV2,北京万泰生物药业股份有限公司);抗-TP 试剂1(DiaSorin S.p.A UK 分公司,英国);抗-TP 试剂2(珠海丽珠试剂股份有限公司)。Procleix Ultrio Elite 检 测 试 剂,Procleix HIV-1、HCV、HBV Discriminatory Assay 鉴别试剂(Grifols,西班牙);MPX v2.0 HBV、HCV、HIV(1+2 型)PCR-荧光法NAT 联合检测试剂(罗氏,美国);Roche COBAS AmpliPrep/COBAS TaqMan HIV-1 test,version 2.0(罗氏,美国);人类免疫缺陷病毒(HIV 1+2 型)抗体检测免疫印迹法试剂盒(Western blotting,WB)HIV BLOT 2.2(MP 生物医学亚太私人有限公司,新加坡)。补充胶体金免疫层析法(上海科华生物股份有限公司)和胶体硒法Alere DetermineTM HIV1/2(雅培Alere Medical Co.Ltd.,美国),甲苯胺红未加热血清试验(tolulized red unheated serum test,TRUST,上海荣盛生物药业有限公司),梅毒螺旋体抗体血清试验(Treponema pallidum particleagglutination test,TPPA,富士株式会社,日本);HIV-1 病毒DNA 检测试剂盒(天津精耐特基因生物技术有限公司);HIV-1 病毒RNA 定量检测试剂盒(Roche COBAS AmpliPrep/COBAS TaqMan HIV-1,罗氏,美国)。
诺华全自动NAT 平台(PROCLEIX Tigris System,美国诺华);CAP/CTM 系统[美国罗氏诊断公司cobass 201 核酸检测系统,由全自动混样仪(HAMILTON Microlab STAR IVD,瑞士HAMILTON),核酸提取仪(cobas AmpliPrep)与分析仪(cobas TaqMan),通过混样和数据管理服务器连接组成];AutoBlot System 20 全自动免疫蛋白印迹仪(美国伯乐);FACS Calibur 标准流式细胞仪测(BD Biosciences,San Jose,CA,美国)。
1.3 方法
1.3.1 样本保存
采集全血于EDTA 2K 管中。血浆和外周血单个核细胞在采集后6 h 内分离,-80℃分装冻存。
1.3.2 判定规则
操作方法和结果的判定均按照试剂说明书执行。标本均经3 遍酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA),若2 遍及以上反应性最终结果判定为阳性,否则判为阴性。
1.3.3 核酸筛查
1.3.3 .1 NAT 单样本检测 样本定性检测献血者血浆中的HIV-1 RNA、HCV RNA 和HBV DNA;对初检单样本反应性的样本,再做NAT 鉴别检测。
1.3.3 .2 NAT 混样检测 模拟6 人份混样:取1份待测样本血浆5 份酶免核酸阴性血浆均匀混合;模拟12 人份混样:取1 份待测样本血浆11 份酶免核酸阴性血浆均匀混合,取混合样本血浆1 mL/份,进行MPX v2.0 PCR-荧光法NAT 联合检测。
1.3.4 HIV 病毒载量测定
具体操作严格按试剂盒说明书,最低检测限为20 copies/mL。
1.3.5 蛋白免疫印(western blottin,WB)迹确证实验
HIV BLOT 2.2 试剂说明书中结果判定标准:阴性——没有病毒特异带,或者只有p17 带;HIV-1阳性——检出2 条ENV 带(gpl60/gp41 和gpl20)及核心蛋白(GAG,包括p17、p24、p55)或酶蛋白(POL,包括p31、p51、p66);不确定——出现任何特异条带,但不足以被判断为阳性。
1.3.6 HIV-DNA 定量分析
HIV-1 病毒DNA 检测整合到人类白细胞基因组中HIV-1 病毒DNA[7]。
1.3.7 CD4+T 细胞计数
应用标准流式细胞仪测定全血样本中CD4+T细胞计数。
1.3.8 追踪随访
在两年时间对窗口期献血者追踪随访11 次,采集其血样补充进口、国产HIV、梅毒抗体ELISA检测,HIV RNA 单人份、多人份混样核酸检测,HIV病毒载量检测,蛋白免疫印迹确证实验,HIV DNA定量分析及CD4+T 细胞计数。献血者在献血后28天开展HIV ART 治疗,49 天开展梅毒治疗。
2 结果
2.1 血清学检测结果
献血后第6 天,第4 代抗-HIV ELISA 和CLIA检测呈阳性。献血后第26 天,第3 代抗-HIV ELISA 和HIV 快速检测阳性。早期ART 治疗后,第4代抗-HIV ELISA 和CLIA 检测信号值略有下降。然而,第三代抗-HIV ELISA 和HIV 快速筛查试剂检测结果均未明显降低。HIV-WB 从献血后42 天开始呈阳性,WB 实验结果示意图见图1。在所有方法中,抗-TP 试剂1 ELISA 检测早期梅毒感染的效率最高。献血后第80 天,梅毒治疗后血清学TRUST 实验结果出现阴转。HIV/TP 共感染献血者治疗前后血清学、核酸学检测结果见表1。
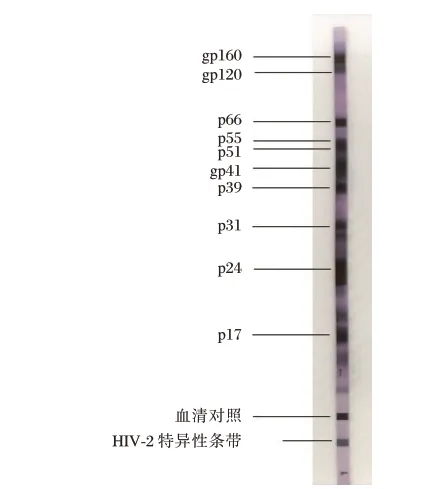
图1 WB 实验结果示意图Figure 1 Schematic diagram of the WB experiment
2.2 HIV 核酸检测结果
献血者本次献血血浆,所有HIV 核酸检测方法均显示反应性。献血后第117 天,除6-MP NAT外,所有NAT 检测HIV-RNA 仍呈阳性反应。经过早期抗逆转录病毒治疗,献血后3 个月内,HIV RNA 病毒载量急剧下降,献血后246 天降至检出限以下;献血后403 天,外周血中仍可检测到HIV-1 DNA,见表1。

表1 HIV/TP 共感染献血者治疗前后血清学、核酸学检测结果Table 1 Serological and Nucleic acid test results after early treatment of HIV/TP coinfected blood donor
2.3 CD4 淋巴细胞计数与CD4/CD8 比值
急性感染期间CD4+T 细胞计数和CD4/CD8比值均显著下降。尽管在第345 天出现CD4+T 细胞计数和CD4/CD8 比值的轻微波动,经过ART 和青霉素治疗,免疫细胞下降的趋势得到较好逆转。见表2。

表2 CD4 淋巴细胞计数与CD4/CD8 比值Table 2 Trend of CD4/CD8 ratio after early treatment of HIV/TP coinfection
3 讨论
本研究通过动态追踪梅毒/艾滋病合并感染窗口期献血者,评估在梅毒/艾滋病联合感染并进行相应治疗前后,不同检测方法(血清学和核酸检测)的试剂诊断效能、机体免疫细胞的数量以及疾病治疗效果。
共同感染治疗后个体疾病进展通常都会改变[8]。之前的研究表明,HIV 引起细胞介导的免疫反应和体液免疫反应破坏改变了梅毒病程,艾滋病患者合并梅毒的临床进展通常比未感染该病毒的患者快[9]。梅毒治疗通常在合并HIV 感染者中应答率较低,表现为非螺旋体滴度下降较慢[10]。在本文病例中,梅毒治疗后,抗-TP 水平降低,并在第80 天时获得血清学应答。表明艾滋病毒/梅毒共感染的个体对梅毒治疗反应良好,尽管研究者不太确定HIV 共感染是否降低了应答率。本研究中不同试剂灵敏度不同,但受共感染影响不大。外生殖器溃疡(献血前第28 天)到抗-TP 试剂1、抗-TP ECLIA 和抗-TP 试剂2 血清学试验阳性之间的时间间隔分别出现在献血后0、6 和10 天。这些数据在单一感染梅毒患者出现症状的时间范围内[11]。梅毒治疗临床疗效需要监测非螺旋体抗体滴度,抗体转阴或滴度下降4 倍以上提示治愈。据报道,15%~25%的患者在初级阶段治疗2~3年后恢复到血清学无反应状态[12]。本研究中,梅毒治疗后血清学TRUST 实验结果出现阴转与之前的研究结果一致,即使在合并感染的患者中也是如此[13]。之前研究也通过比较感染和未感染艾滋病毒的患者,评估了梅毒治疗后艾滋病毒状况与血清学结果的关系[14]。但是,这些研究的结果并不一致,所以目前仍然不清楚艾滋病毒感染者是否能达到梅毒完全清除。这一学术争论的原因或许与①梅毒和HIV感染病程差异性相关;②对血清学无反应的定义不一致有一定联系。
根据英国性健康与艾滋病协会关于艾滋病毒窗口期(2014年11月)声明,暴露4 周后第4 代试剂检测结果呈阴性,艾滋病毒感染可能性极低[15]。然而,根据目前的结果,HIV 窗口期似乎在合并梅毒感染者中更长。本研究中,第四代抗-HIV ELISA 试剂和CLIA 检测试剂在献血后第6天呈阳性,距离献血前41 天和35 天高风险暴露已近6 周。因此推测,窗口期时间延长的一个可能原因是合并梅毒感染影响机体针对HIV 的体液反应进展。
2015年,世界卫生组织ART 指南建议,发现艾滋病毒感染后立即开展抗病毒治疗[16]。早期ART治疗及时降低HIV 病毒浓度。本研究中共感染献血者对ART 反应良好,说明了早期治疗艾滋病毒的重要作用以及HIV DNA 在共感染后作为病毒库长期存在。
根据献血者自述,献血前第28 天出现一处生殖器溃疡(下疳)。有研究表明,下疳通常在暴露后10~90 天出现[17],原发性梅毒下疳形成后1~4 周是梅毒体液反应发展的窗口期[18]。本研究中联合感染对这一症状出现的时间影响似乎有限。
本例报告也存在不少局限性。首先,患者有两次高危行为,但由于缺乏更多信息,无法确定具体感染时间。其次,本研究主要集中在检测和治疗上,有关共感染对免疫系统影响的分子机制仍有待深入研究。后续将在更多不同阶段HIV 与梅毒共感染病人样本中,分析验证与免疫相关差异表达蛋白在不同病程中的功能,探明对HIV 窗口期抗体生成的影响。
