SMILE术中Kappa角补偿对术后眼高阶像差的影响
2022-01-18刘洋任珊
刘洋 任珊
以往的研究已经证实了飞秒激光小切口角膜基质透镜取出手术(femtosecond laser small incision lenticule extraction,SMILE)矫正近视和复性近视散光的安全性、有效性、预测性和稳定性[1,2]。目前认为,切削区以视轴为中心,而不是以瞳孔轴为中心,是屈光手术中取得最佳视觉质量的关键之一[3,4]。与准分子激光屈光手术不同的是,SMILE手术中没有自动化的眼球追踪系统(eye-tracking system),因此,在SMILE手术中术者进行准确的中心定位十分重要,尤其是对于Kappa角较大的患者。以往的研究表明,在准分子激光原位角膜磨镶术(laser-assistedin situ keratomileusis,LASIK)中,Kappa角较大的患者更易出现偏中心切削,造成术后高阶像差(higher-order aberrations,HOAs)增加和视觉质量受损[5]。然而,目前关于SMILE手术中Kappa角影响的研究较少。本研究的目的是探究SMILE术中有、无采取Kappa角补偿(angle Kappa adjustment,AKA)对术后高阶像差的影响。
资料与方法
一、一般资料
1.对象:回顾性病例研究。纳入于2019年12月至2020年5月于海南爱尔新希望眼科医院接受SMILE手术的连续病例108例(108只眼)。对于每个病例,都仅将左眼纳入研究。纳入标准为:≥18周岁,角膜透明,屈光状态稳定1年以上,停戴软性角膜接触镜至少2周以上,停戴硬性角膜接触镜至少4周以上。排除标准为:患有眼内疾病,眼外伤或眼部手术史,患有结缔组织或自身免疫性疾病。所有患者术前均接受Pentacam眼前节分析系统(Pentacam HR,Oculus GmbH,德国)以及眼像差(WaveScan,VISX,美国)检查。患者随机分为两组:Kappa角补偿组(AKA组)和Kappa角未补偿组(Angle Kappa nonadjusted,AKN组),前者采取术中Kappa角补偿,后者术中未进行Kappa角补偿,两组病例其余手术操作均相同。
研究方案符合《赫尔辛基宣言》的原则,并得到海南爱尔新希望眼科医院机构审查委员会的批准。术前获得所有受试者的知情同意。
2.数据采集:术前检查包括裂隙灯检查、散瞳眼底检查、裸眼远视力(uncorrected distance visualacuity,UDVA)矫正远视力(corrected distance visual acuity,CDVA)、验光、眼压、Pentacam眼前节检查以及眼高阶像差检查。术后1个月和3个月重复以上检查。
眼像差检查在暗室中进行。检查开始时要求患者眨眼数次,所有图像均在开始检查后3 s内拍摄,以减小泪膜不稳定状态对像差的影响。所有患者的眼像差检查均由同一位熟练的检查人员完成,每个患者选取3幅质量良好的图像取平均值用于分析。由于患者瞳孔大小会发生变化(同一患者在检查中瞳孔大小会变化,不同患者之间瞳孔大小也有差异),且瞳孔大小与像差显著相关[6],因此,我们使用Matlab软件(版本8.6.0,The Math Works,美国)将所有测量结果转换为在4个不同瞳孔直径(3、4、5、6 mm)下相应Zernike系数的均方根(root mean square,RMS),以便进行比较。波前像差采用美国光学学会(Optical Society of America,OSA)的符号系统进行计算。3、4、5、6阶HOAs的Zernike系数分别记为S3、S4、S5、S6。像差改变量由术后像差的RMS值减去术前像差RMS值算得。
术前使用Pentacam测量视轴相对于瞳孔轴的坐标,作为Kappa角。根据此Kappa角的值进行术中Kappa角补偿。AKA组Kappa角大小为(0.19±0.08)mm,AKN组为(0.17±0.09)mm,差异无统计学意义(P=0.652)。
二、手术方法
所有手术均由同一位熟练的屈光手术医生进行。使用VisuMax飞秒激光系统(Carl Zeiss,德国),参数如下:激光能量115 nJ,点间距4.5 μm,点直径1.5 μm,角膜帽厚度120 μm,光学区直径6.5 mm,角膜帽直径7.5 mm,边切角90°,侧切口位于12点钟方向,长2 mm。术中Kappa角补偿时,要求患者注视绿色固视灯,术者根据患者Kappa角的大小和方向,将负压吸引环的中心相对于瞳孔中心进行相应的调整后,开启负压吸附。其余手术操作均按照标准流程进行。在AKN组,不进行术中Kappa角补偿,负压吸引环的中心直接对正患者的瞳孔中心进行吸附。术后第1天起,所有患者均使用左氧氟沙星滴眼液及妥布霉素地塞米松滴眼液7 d,小牛血去蛋白提取物滴眼液20 d,玻璃酸钠滴眼液30 d;术后第7天起使用0.1%氟米龙滴眼液20 d;以上所有滴眼液的使用频率都是每天点眼4次。
三、统计学分析方法
使用SPSS 25.0统计软件(IBM,美国)进行数据分析。所有计量资料经Kolmogorov-Smirnov检验证实符合正态分布。根据样本大小和资料类型,采用独立样本t检验和重复测量方差分析比较两组术前、术后参数。将视力转换为最小分辨角的对数(logarithm ofthe minimum angle of resolution,LogMAR)进行分析。采用Pearson分析来研究Kappa角与HOAs的相关性。对Kappa角较大的患者(Kappa角大小>0.20 mm)进行亚组分析。所有数据均表示为均值±标准差,(P<0.05)为差异有统计学意义。
结 果
一、基线数据
42位患者被分入AKA组,66位被分入AKN组。所有患者术前CDVA均≤0.1(logMAR视力)。表1为基线数据,两组患者术前各项数据均无统计学差异。术后1个月和3个月时,AKA组的UDVA分别为-0.03±0.07、-0.02±0.09,主觉验光等效球镜分别为(-0.06±0.17) D、(-0.05±0.20) D;AKN组的UDVA分别为-0.02±0.07、-0.03±0.08,主觉验光等效球镜分别为(-0.05±0.19) D、(-0.07±0.21) D。两组的UDVA和等效球镜在术后1个月和3个月时均无统计学差异(均P>0.05)。

表1 两组患者的各项基线参数差异无统计学意义
二、两组患者的像差比较
两组患者不同瞳孔直径下的总高阶像差、球差、垂直彗差、水平彗差和三叶草像差的RMS值见表2。两组患者基线值差异均无统计学意义。术后1个月和3个月,AKA组在6 mm和5 mm瞳孔直径下的垂直彗差均小于AKN组(均P<0.05)。不过,在4 mm和3 mm的瞳孔直径下,两组间垂直彗差的差异则不具有统计学意义(均P>0.05)。两组间球差、水平彗差、三叶草像差、总高阶像差以及3阶至6阶高阶像差(S3~S6)在术后1个月和3个月在不同的瞳孔直径下差异均无统计学意义(均P>0.05)。

表2 两组患者在不同瞳孔大小下眼像差的比较
两组患者术前与术后的垂直彗差RMS改变量见表3。两组患者术后的垂直彗差均增大,其中在6 mm和5 mm瞳孔直径下,AKA组的垂直彗差RMS增大量在术后1个月和3个月时均小于AKN组(均P<0.05)。
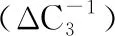
表3 两组患者在不同瞳孔大小下术前与术后垂直彗差改变量的比较
三、亚组分析
我们对术前检查中Kappa角大小>0.20 mm的患者进行亚组分析(见表4)。术前两组HOAs无明显差异。AKA组有17例大Kappa角患者,AKN组有22例大Kappa角患者。术后1个月时,6 mm瞳孔直径下AKA组的总HOA和垂直彗差小于AKN组(P=0.035、0.010)。在3个月时,AKA组的垂直彗差仍小于AKN组(P=0.044)。

表4 两组中具有较大Kappa角的患者在6 mm瞳孔直径下术后高阶像差的比较
四、相关性分析
对于大Kappa角患者,我们进行了6 mm瞳孔直径下的Kappa角与术后HOAs相关性分析。在AKA组,术后1个月和3个月时,Kappa角(0.272±0.064)mm均与全部HOA参数无相关性。在AKN组,术后1月时Kappa角(0.273±0.065)mm与总HOA、彗差以及三阶像差呈正相关(r=0.498,0.507,0.495,P=0.044,0.039,0.043),术后3个月时Kappa角仅与总HOA呈正相关(r=0.489,P=0.046)。
讨 论
人眼的瞳孔轴是指垂直于角膜前表面并与瞳孔中心相连的线,视轴是指注视点、眼内节点和黄斑中心凹之间的连线[7]。Kappa角即为这两条轴所成的夹角。在角膜屈光手术中,以往通常将瞳孔中心作为切削中心,然而,近年来越来越多的研究结果表明这种中心定位方法并不是最好的。Arbelaez等[8]在52例Kappa角较大的近视患者中,比较了LASIK手术以角膜顶点为中心和以瞳孔为中心的术后效果,发现以角膜顶点为中心者术后眼HOA和角膜非球面性数值均更小。Okamoto等[9]在268例近视患者中比较了以同轴角膜映光点(coaxially sighted corneal light reflex,CSCLR)和以瞳孔为中心的LASIK术后效果,发现以CSCLR为中心者具有更小的彗差和总HOA,并且安全性和有效性指数更好。Liu等[10]证实在SMILE手术中以角膜法向定点(corneal vertex normal)为切削中心优于以瞳孔为中心,前者能取得更小的术后残余屈光不正。目前,关于SMILE术中Kappa角补偿对术后视觉质量影响的研究很少,因此,我们进行了本研究。
在本研究中,我们对AKA组进行了Kappa角补偿,即在施加负压吸引前,根据Kappa角的大小和方向,调整负压环与角膜表面的相对位置,从而使切削中心移向视轴。我们发现,AKA组和AKN组两组患者术后均获得良好的屈光状态,这可能是由于近视眼的Kappa角一般较小,因此切削偏心量小,不足以影响视力和屈光(低阶像差)结果。SMILE术后HOAs的增加主要由球差和垂直彗差的增加引起[11]。其中球差增加是由于角膜前表面变平,失去了其自然的长椭圆形态。而垂直彗差的增加,可能是由于SMILE手术的侧切口位于12点钟方向所造成。Mrochen等[12]和Fang等[13]证实偏中心切削是角膜屈光手术后彗差和球差增高的主要原因。在本研究中,两组患者术后垂直彗差均增加,但AKA组的增加量比AKN组更小。我们推测这是由于术中Kappa角补偿做到了更好的中心定位,因此减少了彗差增加量。
两组间彗差增加量的差异仅在6 mm和5 mm瞳孔下具有统计学意义,而在4 mm和3 mm瞳孔下无统计学意义,这表明Kappa角补偿主要有益于暗光条件下的视觉质量。以往在LASIK手术中的研究也证实,如果对较大Kappa角的患者不进行术中Kappa角补偿,将会造成术后HOA明显升高,影响夜间视觉质量,引起光晕和眩光等症状[14]。此外,在用于矫正远视的LASIK手术中,Kappa角补偿也能显著减少偏心量[15]。许多研究都表明偏中心切削会引起HOAs,尤其是彗差的增高[13]。表4说明在大Kappa角患者中,Kappa角补偿很发挥了重要作用,它可以减少术后HOAs的增加,进而提高视觉质量。实际上,在小Kappa角的SMILE手术患者中,也许不需要进行Kappa角补偿,而在大Kappa角的患者中Kappa角补偿是必要的。
本研究中,我们对大Kappa角患者进行了相关性分析,发现AKA组的Kappa角与所有术后HOA参数均无显著相关性。而在AKN组,Kappa角与术后HOAs呈正相关。这也证实了SMILE手术中进行Kappa角补偿的重要性。由于本研究测量的是全眼像差,因此角膜和晶状体对像差的补偿作用未能查明,这是需要在接下来的研究中进行探索的。
本研究的不足之处在于,研究设计为回顾性,且样本量不大。此外,本研究未评估患者的主观视觉质量和症状,如对比敏感度、光晕、眩光等。未来的研究有必要弥补这些不足。
总之,本研究表明SMILE术中Kappa角补偿有助于减少术后HOAs,尤其是对于Kappa角较大的患者。采用本研究中的Kappa角补偿方法可以实现较好的中心定位,帮助患者取得更好的术后视觉质量。
