利妥昔单抗联合糖皮质激素治疗难治性大疱性类天疱疮一例
2022-01-18单敏洁闵仲生潘永正
陈 雪 谭 城 单敏洁 闵仲生 吉 津 陈 芳 刘 青 吴 皞 潘永正
1南京中医药大学附属医院皮肤科,江苏南京,210029;2南京医科大学附属江宁医院肿瘤科,江苏南京,210000
临床资料患者,男,35岁。1个月前无明显诱因四肢出现大小不等的红斑、丘疹,初始表现为靶形损害,后红斑上逐渐出现散在水疱,疱壁紧张,疱液澄清,瘙痒难忍,后水疱破裂干涸,部分结痂,期间患者自服“氯雷他定片”,疗效欠佳,至我院皮肤科门诊就诊。初始诊断为“大疱型多形红斑”,予“复方倍他米松注射液1 mL”肌注,症状一度缓解。数天后皮损复发,四肢、躯干出现新发红斑、丘疹、水疱(图1)。患者10年前有溃疡性结肠炎病史,否认其他慢性病病史,否认家族性遗传性疾病史。
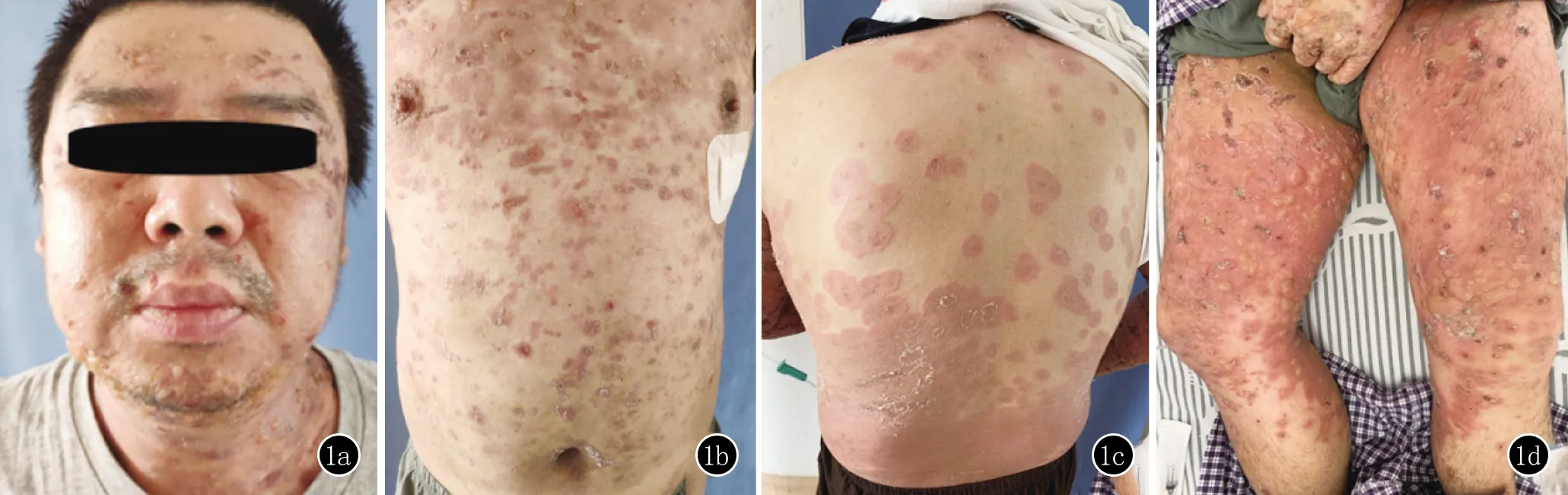
1a、1b、1c、1d:面部、躯干、双下肢红斑、丘疹、水疱,后背红斑呈靶形损害
实验室检查:血常规示白细胞计数11.21×109/L,嗜酸粒细胞百分比7.0%,嗜酸粒细胞绝对值0.78×109/L。尿常规:隐血弱阳性;总IgE测定:1786 IU/mL(正常值<100 IU/mL);凝血七项:D-二聚体6.28 mg/L,纤维蛋白(原)降解产物19.51 μg/mL;血清蛋白电泳:α1球蛋白7.5%;免疫八项:免疫球蛋白M 0.34 g/L,补体C4 0.13 g/L,C反应蛋白12.70 mg/L;血生化、糖化血红蛋白、血沉、肿瘤指标、结核感染T细胞检测、各类病毒检测等都未见明显异常。十二导心电图检查:1、窦性心律;2、QⅢ>1/4R;3、T波改变;腹部B超及心脏彩超均未见异常。IgG、IgM、IgA和C3均为阴性。盐裂试验:IgG表皮侧阳性,C3表皮侧阳性,BP180抗体171.7 U/mL。修正诊断为大疱性类天疱疮(bullous pemphigoid,BP)。住院后再次行皮肤活检,病理示:(左前胸)表皮下水疱形成,表皮内及疱内见嗜酸粒细胞、中性粒细胞及少量红染无定型物,真皮浅层小血管周围淋巴细胞、中性粒细胞、嗜酸粒细胞浸润(图2)。IgG、C3基底膜带线状(+),IgA、IgM(-),BP180抗体>150 U/mL,盐裂试验:IgG表皮侧(+),C3表皮侧(+),天疱疮抗体:Dsg1、Dsg3均为阴性。结合患者皮肤病理、直接免疫荧光和盐裂试验BP诊断明确。
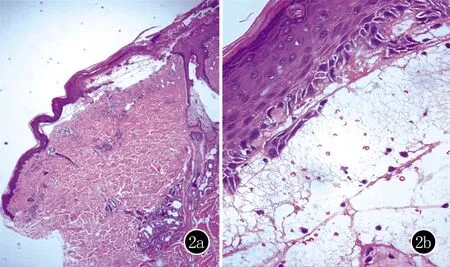
表皮下水疱形成,表皮内及疱内见嗜酸粒细胞、中性粒细胞及少量红染无定型物,真皮浅层小血管周淋巴细胞、中性粒细胞、嗜酸粒细胞浸润(HE,2a×100;2b×400)
治疗过程:初始予甲泼尼龙40 mg/d,症状未见好转,水疱逐渐增多,甲泼尼龙逐渐加至上午40 mg,下午60 mg静滴,患者仍有新发水疱,加用人免疫球蛋白20g/d×5天静脉给药,同时予环磷酰胺0.6 g/d×1天冲击治疗,皮疹得到控制,复查血常规:嗜酸粒细胞百分比7.0%,嗜酸粒细胞绝对值0.64×109/L。20天后当甲泼尼龙减量至上午40 mg,下午40 mg静滴时,患者病情出现反复,予沙利度胺50 mg/d、吗替麦考酚酯胶囊1 g/d,环磷酰胺0.6 g/d×1天冲击治疗,皮疹未控制,复查:嗜酸粒细胞百分比16.5%,嗜酸粒细胞绝对值2.80×109/L,总IgE 2500 IU/ml。考虑患者对甲泼尼龙反应不佳,改用地塞米松磷酸钠15 mg/d,吗替麦考酚酯胶囊加至1.5 g/d后仍有新发水疱。患者病情考虑为难治性BP,再次予人免疫球蛋白20 g/d×5天静滴,同时予利妥昔单抗1 g静脉泵入。利妥昔单抗治疗前查外周血B淋巴细胞百分比:24.1%。经治疗后,患者水疱逐渐吸收干涸,每日新发1~2枚绿豆大水疱,瘙痒也较前明显缓解。利妥昔单抗用后第2天地塞米松磷酸钠减量至7.5 mg/d(此剂量维持至出院)。按照利妥昔单抗使用疗程,2周后继续予1 g静脉泵入,查外周血B淋巴细胞降至0.06%,嗜酸性粒细胞百分比波动予12%~16%(正常值0~5%),嗜酸性粒细胞绝对值波动于1.1~1.4×109/L(正常值0~0.5×109/L),总IgE:668 IU/mL,此时瘙痒缓解,无明显新发水疱,停用吗替麦考酚酯、沙利度胺,复查BP180>150 U/mL。后患者因自身原因要求出院,出院时躯干、四肢红斑颜色变暗,水疱已基本干涸结痂(图3)。出院继续口服甲泼尼龙40 mg/d维持,门诊随诊。出院后患者病情平稳,总IgE、嗜酸性粒细胞持续下降,甲泼尼龙每两周减量8 mg。当甲泼尼龙减量至20 mg/d后,患者双侧手臂出现新发水疱,嗜酸性粒细胞有所升高,故将甲泼尼龙恢复至24 mg/d,同时加予氨苯砜50 mg日2次口服治疗,后未再新发水疱,嘱患者甲泼尼龙每月减4 mg。出院3个月后查总IgE、嗜酸粒细胞降至正常,BP180抗体降至23 U/mL。目前患者甲泼尼龙12 mg/d、氨苯砜50 mg日2次治疗,未见病情反复及不良反应,仍持续跟踪中。
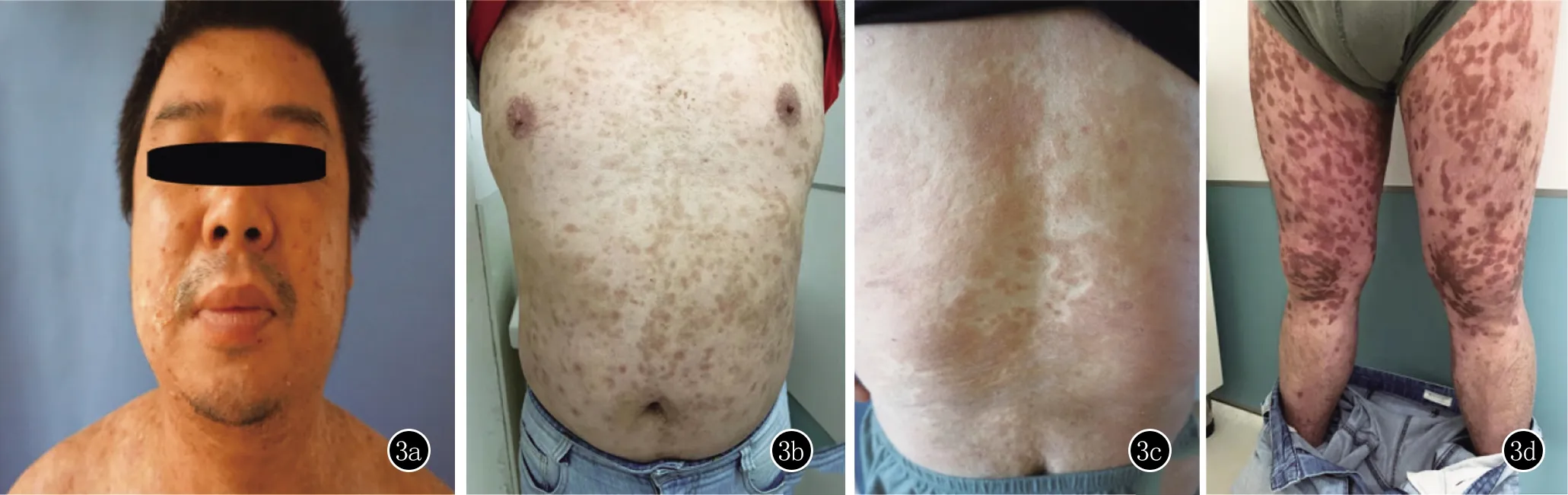
3a、3b、3c、3d:面部、躯干、双下肢均未见新发水疱,留有色素沉着
讨论BP是一种表皮下的免疫性疱病。BP180作为胞外区的跨膜蛋白是BP的主要抗原,非胶原区16A被广泛认为是BP自身抗体的主要靶位。而少数BP则报道为是以胞浆蛋白BP230为靶点[1]。
本例患者10年前曾患有溃疡性结肠炎,经过美沙拉嗪治疗后好转,后未再发。部分学者认为存在潜在的免疫机制导致两种疾病的发生,BP是病因未明的炎症性肠病的皮肤表现[2],推测原因为BP和溃疡性结肠炎都是以Th2免疫应答为主的免疫性疾病。在BP合并溃疡性结肠炎的患者报道中,溃疡性结肠炎与BP均先后出现,且该人群的患病年龄均出现年轻化。研究发现一种分子结构与BP230极为相似的凝集素蛋白,此种蛋白在皮肤和肠道中均有表达。有实验表明[3],提取未经治疗的溃疡性结肠炎患者的血清,以猴食道为底物,间接免疫荧光显示有抗基底膜带抗体的存在。溃疡性结肠炎可以导致结肠渗透性增加,释放结肠抗原,此种抗原易与皮肤抗原发生交叉反应,从而导致BP的发生。有研究显示BP患者的血清及皮损中IL-17/IL23的表达增加,提示Th17信号通路参与自身免疫性疱病的发病[4],与溃疡性结肠炎发病的炎症通路高度吻合,提示了BP可能是溃疡性结肠炎炎症驱动后的结果。
利妥昔单抗是一种人-鼠嵌合的抗CD20的单克隆抗体,通过细胞毒作用或者抗增殖效应以及补体介导的细胞凋亡作用[5],导致抗原特异性记忆B细胞和抗原致敏的成熟B细胞从循环中耗竭,致病抗体减少,疾病得以控制。利妥昔单抗初始用于非霍奇金淋巴瘤的治疗,由于其对CD20+B淋巴细胞具有靶向性的破坏作用,临床上逐渐将其用于免疫性疱病的治疗。虽然BP目前还未列入利妥昔单抗治疗的适应症,但自首例利妥昔单抗成功治疗BP报道后[6],其已逐渐成为难治性类天疱疮的一种治理选择,且欧洲皮肤病与性病学会(EADV)指南建议利妥昔单抗作为BP的三线治疗[7]。有关于利妥昔单抗成功治疗糖皮质激素和奥马珠单抗无效的难治性BP的报道。Ahmed等[8]学者用利妥昔单抗联合免疫球蛋白对12例顽固性BP的治疗进行一系列研究,研究显示12例患者在该方案下均得到完全的临床缓解。一项回顾性病例对照研究表明[9],13例患者接受利妥昔单抗和泼尼松联合治疗的完全缓解率达90%。在另一项回顾性研究发现[7],利妥昔单抗联合人免疫球蛋白,6年内病情均控制良好,且与常规免疫抑制组相比,利妥昔单抗组的感染率和死亡率均降低。
利妥昔单抗治疗BP并未列入诊疗指南。有研究表明[8]在利妥昔单抗开始治疗的前6个月,无需糖皮质激素或免疫抑制剂的治疗,在利妥昔单抗运用前、运用期间以及停止使用后需要静注人免疫球蛋白进行免疫预防。该研究还显示在利妥昔单抗治疗的4-6个月后,患者可达到临床完全缓解。多项研究表明[10],疾病的严重程度与自身抗体滴度呈正相关。当B淋巴细胞耗竭至0时,临床症状并没有得到明显的缓解,此时浆细胞产生自身抗体的作用也未得以抑制,而当致病抗体下降至一定水平后,皮损才足以控制,因此即使利妥昔单抗治疗后B淋巴细胞已降至为0,其他治疗也不能完全停止。欧洲BP指南[7]中指出,当BP180抗体降低至27 U/mL时,疾病得到缓解,此时可以尝试进行药物减量。
目前发现利妥昔单抗对于疾病的控制相对稳定。Reguiay等[11]学者治疗一名难治性BP,2个疗程的利妥昔单抗治疗后未出现皮损的复发。在Pascal[12]的21例患者中,仅9例出现皮损反复,7例予外用药物或系统加量糖皮质激素后病情得到控制,仅2例患者需再行1个疗程的利妥昔单抗的治疗,且9例患者均获得完全的缓解。Lamberts等[13]研究认为利妥昔单抗治疗BP的复发率较高,59%的患者在达到初始CR后复发,但复发的BP再次使用利妥昔单抗后效果仍佳,85.7%的复发病例可以得到缓解。
本例患者在利妥昔单抗的治疗下,停用了一切免疫抑制剂。治疗过程中,每2~4周对病情进行评估,在病情稳定的基础上,适当减量激素,从目前的观察来看,疗效还是相对满意的。本次病例为我们治疗难治性BP积累了经验同时也增强了信心。当然目前随访时间尚局限,病例数量较少,今后还需要更多的时间和临床病例进行研究。
