基于cpDNA分子标记的白杄群体遗传多样性研究
2022-01-18叶冬梅包文泉白玉娥吴晓萌孙昊田
王 玲, 叶冬梅, 包文泉, 白玉娥, 吴晓萌, 孙昊田
(内蒙古农业大学林学院,内蒙古 呼和浩特 010018)
云杉属(Picea)是仅次于松属(PinusLinn)和冷杉属[Abiesfabri(Mast.)Craib]的隶属于松科(Pinaceae Spreng)的第三大属[1],该属是裸子植物中较大的一个属[2],广泛分布于北半球[3].目前被世界普遍认可的云杉属约有34个种(亚洲23个、北美洲8个、欧洲3个)、3个杂交种、3个亚种和15个变种[4].白杄(PiceameyeriRehd.et Wils)(又名毛枝云杉)是我国的特有树种,分布较广,主要分布于山西(五台山区、管涔山区、关帝山)、河北(小五台山区、雾灵山区)和内蒙古西乌珠穆沁旗[5],其海拔分布是由南向北呈递减分布[6].白杄所处的环境与地理位置的不同,也表现为群体对环境的适应能力和群体内部的稳定性不同,因此对白杄群体进行遗传多样性研究,可以探究白杄群体对环境的适应能力和种内变异程度,对我国云杉属及林木育种研究具有重要的理论和实践意义.
遗传多样性的本质是DNA的多态性[7],广义的遗传多样性是指地球上所有生物所携带的遗传信息的总和,但通常情况下所说的遗传多样性指的是种群内的遗传多样性,即种群内不同个体的遗传变异总和,故也称其为基因多样性[8,9],分子标记是研究遗传多样性的方法之一.对云杉属多个物种采用常规染色进行染色体组和核型分析已有50多年[10-15],最主要的分子标记有RFLP、SSR、RAPD、AFLP、ISSR和DNA序列标记等,研究的云杉属树种约有20种,以欧洲云杉(Piceaabies)树种居多[16-25].王改妮等[26]对云杉复合体中的白杄(Piceameyeri)、云杉(Piceaasperata)、红皮云杉(Piceakoraiensis)和西伯利亚云杉(Piceaobovata)的34个居群(332个个体)进行了DNA提取,分别扩增了13个核基因片段,结果表明4个云杉属物种拥有共同祖先,其中西伯利亚云杉最先分化,其次是白杄、云杉和红皮云杉,但后三个物种的分化程度却不高.Li et al[27]通过mtDNA、nrDNA、cpDNA测序,研究川西云杉(Picealikiangensis)自然种群遗传分化,结果表明,川西云杉具有较高的生态位分化.2013年构建了约20 GB的欧洲云杉基因组草图[28,29],可通过分析全基因组DNA序列变异为云杉属群体遗传学的深入研究提供可靠的背景,同时提供崭新的视角和丰富的信息.但是在众多研究中,白杄群体间的遗传多样性和基因分化未见报道.
叶绿体DNA(chloroplast DNA, cpDNA)存在于高等植物叶绿体基质中,多以闭合环状双链分子存在[30],且cpDNA为单亲遗传,细胞分裂时不发生重组[31],其进化速率仅为核基因进化速率的1/2[32].此外,cpDNA的非编码区进化速率更快,能够提供更多遗传学信息,常用于种下与种间植物信息系统重建[30].cpDNA还具有分子量小、结构简单、进化保守及多拷贝等优点[33],可以在短时间内构建植物cpDNA限制图谱和只依靠cpDNA即可构建系统发育树,如非加权组平均法(unweighted pair-group method with arithmetic mean,UPGMA).近几年,cpDNA被广泛应用于各个研究领域如分子进化和系统发育等[30-31,34-35].因此,基于cpDNA分子标记分析白杄群体间遗传多样性,探究白杄群体间的遗传结构、分化、亲缘关系和种内变异程度,对于白杄种质资源的保护与利用提供依据.
1 材料与方法
1.1 试验材料
研究材料取自山西省(庞泉沟、大石洞、五台山)、河北省(小五台山、雾灵山、机械林场)和内蒙古自治区(多伦、正蓝旗、九峰山)的9个天然群体,大多数群体分布于气温较低且潮湿的森林地带,有少数几个群体分布于气温较低但较为干燥的平原地带(表1).

表1 9个采样地的详细信息
每个群体选择30个生长正常的单株用GPS进行定位,单株之间的距离至少大于100 m.将无病虫害的白杄嫩叶迅速装入密封袋中,放入冰盒,于-80 ℃超低温冰箱保存待用.
1.2 DNA提取及纯度检测
经过DNA预试验,最终确定选用试剂盒(Hipure SF plant DNA mini kit)法提取DNA.采用1.2%琼脂糖凝胶电泳检测提取到的DNA纯度.选择条带明亮且不拖尾的DNA样品于-20℃冰箱用于后续PCR扩增.试验共检测了9个群体227个个体.
1.3 cpDNA引物筛选及产物测序
通过NCBI查找获得9对叶绿体基因片段的信息,合成普通引物,对样品进行PCR扩增,筛选获得最适引物.最终从9个叶绿体通用引物中筛选出3个(matk、trnS-trnG和ndhK-C)进行试验(表2).试验采用的PCR扩增体系:反应的总体积为25 μL,模板DNA 2 μL,正反引物各1 μL,2xTaq Plus Master Mix 25 12.5 μL,ddH2O 8.5 μL.反应体系的条件:94 ℃ 4 min,94 ℃ 40 s,62 ℃ 40 s,72 ℃ 1 min 30 s,72 ℃ 10 min,4 ℃结尾,38个循环.取PCR扩增产物经1.2%琼脂糖凝胶电泳检测,检测合格的PCR产物送往上海生工公司进行测序.
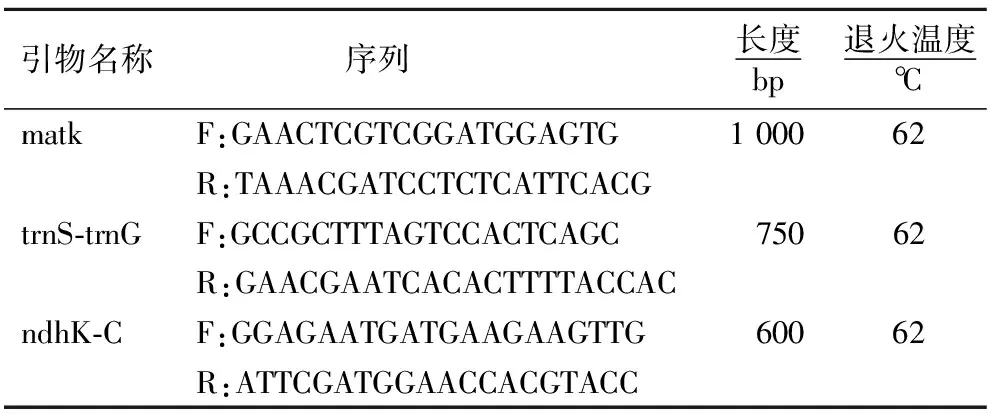
表2 引物详细信息
1.4 数据分析
将测序正常的序列通过NCBI进行BLAST比对,确定所获得的序列是否为目的序列.然后用MEGA 7.0软件对目的序列进行比对.使用POPGEN软件分析观测等位基因数Na、有效等位基因数Ne、Nei′s基因多样性指数(H)、Shannon′s信息指数(I)、多态位点数(S)、多态位点百分比(parallel programming library, PPL)、总体遗传多样性Ht、群体内遗传多样性Hs、基因分化系数Gst和基因流Nm等参数,根据Nei′s遗传距离绘制聚类图.使用DNAsp软件对多态位点数(S)、平均核苷酸差异(K)、核苷酸多样性指数(Pi)、单倍型个数(A)和单倍型多样性(Hd)进行分析.此外,利用APLEQUIN VERSION 3.5软件分析群体的分子方差变异(AMOVA),统计群体内及群体间的变异方差分布和居群间遗传分化系数(Fst).
2 结果与分析
2.1 DNA提取及PCR扩增
使用1.2%琼脂糖凝胶电泳检测DNA质量(图1),DNA长度均>2000 bp,1、2、4、5、6号泳道的DNA浓度约1 000 ng·μL-1,3号泳道的DNA浓度约800 ng·μL-1,提取到的DNA可用于PCR扩增反应.

M:Marker;1~6:不同个体的DNA.
4、7、8、16号泳道的PCR扩增产物条带较弱,不可用于后续的测序,其他产物条带清晰,浓度高,与目的条带一致(图2).

M:Marker;1~18指PCR扩增产物.
2.2 遗传多样性
白杄群体个体的检测结果表明(表3),每个位点检测到的等位基因平均值(Na)、有效等位基因平均值(Ne)、Nei′s基因多样性指数(H)和Shannon′s信息指数(I)均值分别为2.470 6,1.091 5,0.065 0和0.133 2.基于群体水平,上述指标除Ne外均有降低,分别降低47.4%、6.3%、22.0%,而Ne增加了5.5%.9个群体检测的Na为1.117 6~1.882 4,表现为DL>JFS=PQG>JXLC=ZLQ>DSD=XWTS=WLS>WTS.Ne是反映群体遗传变异程度的重要指标,其数值越接近所检测到的等位基因的绝对数,表明等位基因在群体中分布越均匀;Ne为1.034 4~1.779 7,表现为DL>PQG>JXLC>JFS>WLS>ZLQ>DSD>WTS>XWTS,所以DL群体的等位基因在群体中的分布较均匀.各群体的H为0.028 2~0.144 8,表现为DL>PQG>JXLC>JFS>ZLQ>WLS>DSD>WTS>XWTS.I反映位点遗传多样性程度,I为0.051 9~0.264 4之间,表现为DL>PQG>JFS>JXLC>ZLQ>WLS>DSD>WTS>XWTS;DL群体的多态位点数(S)与多态位点百分率(PPL)最大,为15个和88.24%,WTS群体的S和PPL最小,为2个和11.76%.

表3 基于cpDNA分子标记各群体遗传多样性1)
综上分析可知,DL群体的遗传多样性指标值最高,所以DL群体的遗传多样性较高,且具有较好的适应能力与进化潜力,而XWTS群体的遗传多样性指标值最低,故XWTS的遗传多样性较低,对环境的适应能力与进化潜力相对减弱.
2.3 群体遗传结构和遗传分化参数
基于cpDNA分子标记,白杄群体总遗传多样度(Ht)0.065 9,群体内遗传多样性(Hs)0.060 9,基因分化系数(Gst)0.074 9,基因流(Nm)6.172 6,可得出结论:白杄群体间基因分化程度较低且存在广泛的基因交流.通过对群体间分化水平研究白杄群体的遗传结构,白杄群体间的分化程度Fst为1.033%,即总遗传变异的1.033%来自于群体间的遗传变异,98.97%来自于群体内的遗传变异(表4).
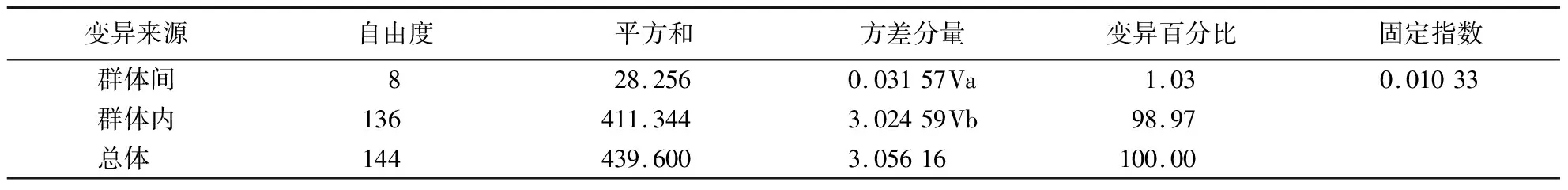
表4 基于cpDNA分子标记的白杄群体方差分析
2.4 各群体单倍型分析
3个叶绿体基因片段(matk、trnS-trnG和ndhK-C)共有61个多态性位点,表现为:ndhK-C>matk>trnS-trnG;平均核苷酸差异(K):ndhK-C>trnS-trnG>matk;共产生124个单倍型,表现为:ndhK-C>trnS-trnG>matk.所以ndhK-C片段的多态性最丰富(表5).
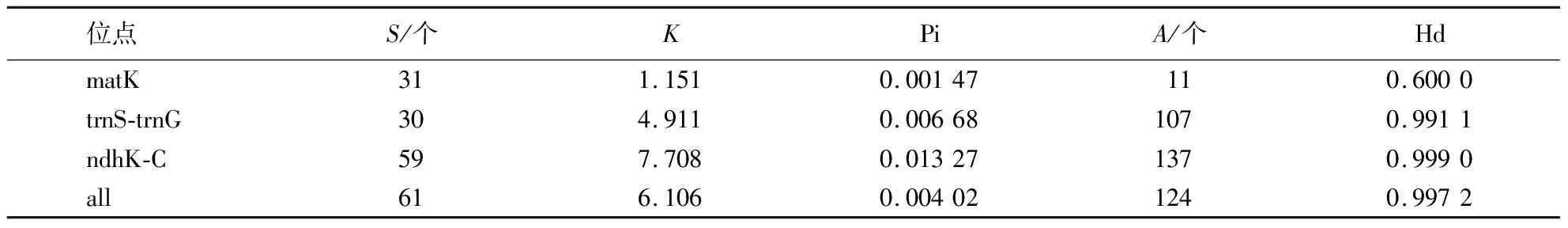
表5 叶绿体基因单倍型多样性、核苷酸多样性和核苷酸平均差异1)
群体多态位点数(S)12~51个,表现为:DL>WLS>DSD>WTS>JFS=JXLC>PQG=ZLQ>XWTS;群体平均核苷酸差异(K)5.110~11.487,表现为:DL>WLS>DSD>XWTS>WTS>JFS>ZLQ>JXLC>PQG;核苷酸多样性指数(Pi)0.003 36~0.007 55,表现为:DL>WLS>DSD>XWTS>WTS>JFS>ZLQ>JXLC>PQG;单倍型个数(A)12~18个,表现为:JXLC>DSD=JFS=PQG=ZLQ>WLS>XWTS>DL=WTS;单倍型多样性(Hd)0.987~1.000,表现为:DSD=WTS=PQG=JXLC=WLS=XWTS>ZLQ>JFS>DL(表6).
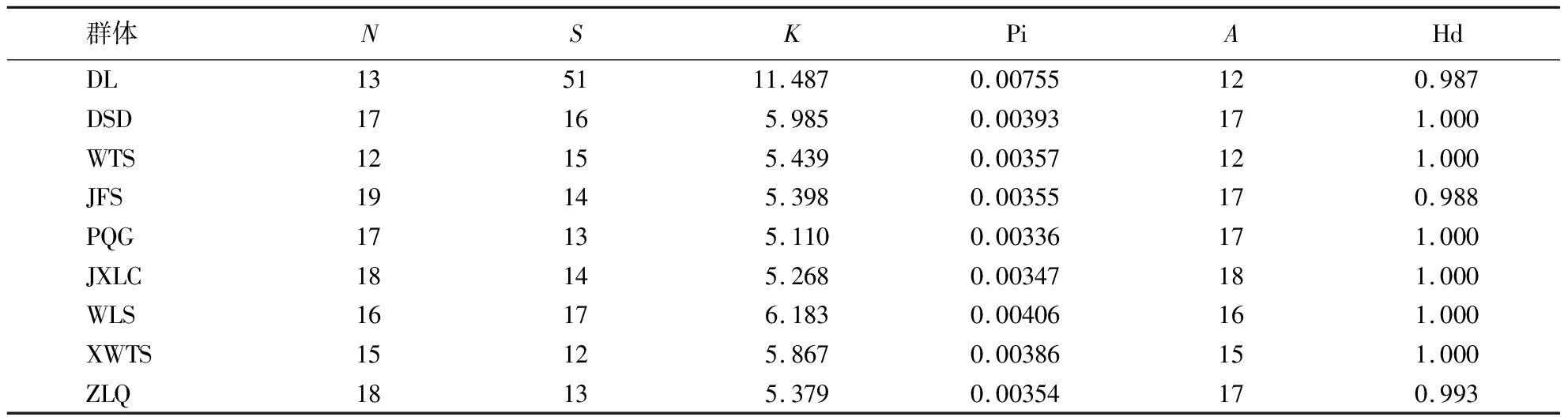
表6 白杄9个群体的叶绿体基因单倍型多样性、核苷酸多样性和核苷酸平均差异1)
综上,DL群体的多态位点数(S)最大,所以DL群体对环境变化的适应能力更强,更稳定,不易受环境的影响,JXLC群体单倍型个数(A)和单倍型多样性(Hd)最大,故JXLC群体较其他群体来说遗传多样性较高.
2.5 群体间的遗传距离与聚类分析
参照Nei′s(1972)分析计算9个群体的亲缘关系.当Nei′s遗传距离(D)为0,遗传一致度(I)为1时,两个群体完全一样,相反则无任何亲缘关系.群体的I为0.942 3~0.999 2,其平均值为0.992 8,说明群体间存在一定的遗传变异;D为0.000 8~0.016 0,其平均值为0.005 7,说明群体间相似程度较高.JXLC群体与XWTS群体的D最大(D=0.016 0),说明两群体遗传相似性水平较低,遗传分化程度较小.DSD群体与ZLQ群体的D最小(D=0.000 8),说明两群体的遗传相似性水平较高(表7).

表7 9个群体间的Nei′s(1972)遗传距离(****下)与遗传一致度(****上)1)
利用白杄群体的遗传距离进行UPGMA聚类分析(图3).结果表明,DSD群体与ZLQ群体的遗传距离最小,可忽略不计,故DSD群体与ZLQ群体的遗传多样性相差较小可视为同一群体,与WLS群体的关系也较为密切.JXLC群体与XWTS群体的遗传距离最大.在0.365 24~0.397 88任意取值时,分为3类,河北的JXLC群体自成一类,内蒙古的JFS群体和山西的XWTS群体聚为一类,其他6个群体聚为一类.由此可知,白杄群体的遗传多样性程度较高.

DL:多伦;DSD:大石洞;WTS:五台山;JFS:九峰山;PQG:庞泉沟;JXLC:机械林场;WLS:雾灵山;WTS:小五台山;ZLQ:正蓝旗.
3 讨论与结论
有研究表明[2],云杉线粒体基因序列变异水平较低,不适合用于云杉属的物种界定研究.本试验选取了4套线粒体(mtDNA)基因片段用以PCR扩增测序,结果也表明,各片段之间无特异性位点.本试验还利用cpDNA分子标记对白杄群体遗传多样性进行研究.结果表明,叶绿体DNA序列在云杉属中拥有更丰富的变异.基因流(Nm)为6.1726,而郑舒文[36]采用18对ISSR引物研究云杉遗传多样性,结果表明,Nm为2.8441.本试验基因流程度较高的原因可能由于采样地较多及采样点不同的原因.本试验结果还得出,白杄群体遗传分化系数(Gst)为0.074 9,Fst为1.033%,表明白杄群体的分化能力较弱,但与前人的研究结果不同(白杄群体的Gst为0.078,Fst为0.05~0.15,白杄群体间遗传分化能力表现为中等)[37],造成试验结果不同的原因可能是所选取基因组片段结构不同,从而得到两种不同的白杄群体分化结果.
主要研究结果:(1)各群体遗传多样性指标存在差异.ZLQ群体的遗传多样性较高,具有较好的适应能力与进化潜力;XWTS群体的遗传多样性较低,对环境的适应能力与进化潜力相对减弱;(2)在叶绿体基因水平上共有61个多态位点(S),共有124个单倍型(A),单倍型多样性(Hd)为0.997 2;片段ndhK-C的多态性最好;(3)白杄群体间基因分化程度不大(Gst=0.074 9),存在广泛的基因交流(Nm=6.172 6);总遗传变异的1.033%来自于群体间的遗传变异,98.97%来自于群体内的遗传变异;(4)通过遗传距离的UPGMA聚类分析,将9个群体分为3类群,即河北的机械林场(JXLC)自为一类,内蒙古的九峰山(JFS)与山西的小五台山(XWTS)聚为一类,其他6个群体聚为一类,所以白杄群体的遗传多样性程度较高.
