一株拮抗性多粘类芽孢杆菌的鉴定及其对小麦赤霉病的田间防效
2022-01-18邓云
邓 云
(福建省南平市农业科学研究所,福建 南平 354200)
小麦赤霉病是世界性病害[1-2],广泛分布于我国温暖潮湿或半潮湿地区,多发于长江上、中、下游及黄淮南片区,对小麦生产的危害甚大.该病不仅会造成小麦严重减产,而且其产生的脱氧雪腐镰刀菌烯醇毒性强,食用后会引起眩晕、发烧、恶心、呕吐、腹泻等急性中毒症状,同时会降低免疫能力和生育能力等,危害人畜健康.目前,施用化学杀菌剂是农业生产上控制真菌性病害的主要方法[3],但是化学农药容易导致农药残留、环境污染、植物病菌产生抗药性等问题.因此,迫切需要更加安全环保的新型生物农药代替传统的化学杀菌剂[4-6].
多粘类芽孢杆菌(Paenibacilluspolymyxa)为芽孢杆菌科(Bacillaceae)类芽孢杆菌属,是一类重要的根际有益菌[7-9].它的代谢产物中含有多种可利用的生物活性物质,如多糖、多肽、蛋白质、糖蛋白、核苷类似物、吡嗪类、醇醛酸等,在农业、食品和环境等方面具有潜在应用价值.多粘类芽孢杆菌可通过产生的抗菌物质和位点竞争的作用方式杀死和控制病原菌[10-15],且该菌是非致病性细菌,被广泛应用于微生物制剂的研制.此外,该菌具有活性高、环境污染小以及不易产生抗药性等特点,具有巨大的生防价值[16-17].
目前,有关广谱抑制真菌的多粘类芽孢杆菌的报道不多,市面上可用于防治小麦赤霉病的多粘类芽孢杆菌的微生物农药菌种资源也不够丰富;有关多粘类芽孢杆菌的主要研究方向为其生物特性和对土壤及作物的作用机理[18-23].本研究从常年开展小麦赤霉病抗性鉴定的鉴定圃土壤中分离出一株具有广谱抑菌效果的多粘类芽孢杆菌DY04,研究其不同施用方法对防治小麦赤霉病和小麦产量的影响,以期为小麦赤霉病的生物防治提供种质资源,并为该生防菌的实际应用提供理论依据.
1 材料与方法
1.1 材料
1.1.1 生防菌菌株 菌株DY04分离自福建省南平市建阳区童游街道南平市农业科学研究所试验基地的小麦赤霉病抗性鉴定圃土壤.
1.1.2 病原真菌菌株 禾谷镰刀菌(Fusariumgraminearum)、稻瘟病菌(Magnaportheoryzae)由本课题组分离;玉米平脐蠕孢(Bipolarissp.)、茶拟盘多毛孢(Pestalotiopsistheae)、玉米茎点霉属(Phomasp.)、番茄尖孢镰刀菌(F.oxysporum)、香蕉枯萎病尖孢镰刀菌(F.oxysporumf.sp.)、黄萎病镰刀菌(F.verticillium)、灰霉病菌(Botrytiscinerea)等由福建农林大学植物保护学院鲁国东教授提供;玉米纹枯病菌(Rhizoctoniasolani)由福建省农业科学院植物保护研究所陈福如教授、杜宜兴副研究员提供.
1.1.3 供试小麦品种 供田间试验的小麦品种扬辐麦4号由扬州里下河农业科学研究所提供.
1.1.4 培养基 红糖豆粉培养基(发酵液)[20]:红糖23.3 g·L-1,CaCO34.9 g·L-1,豆粉11.1 g·L-1,KNO38 g·L-1,KH2PO40.5 g·L-1,K2HPO41.2 g·L-1,MgSO4·7H2O 5 g·L-1,NaCl 3 g·L-1.PDA培养基:马铃薯180~250 g,葡萄糖15~25 g,琼脂15~20 g,水1 000 mL.
1.1.5 微生物菌液助剂 添加剂配方为分散剂PVA(聚乙烯醇)7.2%、湿润剂D425(烷基磺酸缩聚物)4.8%、稳定剂CMC-Na(羧甲基纤维素钠)2.0%、保护剂FWA(荧光增白剂)0.1%[24].
1.2 室内测定方法
1.2.1 染菌大麦粒诱导分离拮抗菌株DY04 将蒸过或煮过的大麦粒装入培养瓶高温灭菌后冷却至室温,向装有大麦粒的瓶中接种禾谷镰刀菌菌块,并在25~26 ℃条件下培养5~6 d,其间摇动培养瓶2~3次,使大麦粒充分长满禾谷镰刀菌.使用若干块无菌纱布分别包裹数颗已长满禾谷镰刀菌的大麦粒,并逐份扎口、系好标签,将其掩埋在鉴定圃土壤10~20 cm的深度诱导拮抗菌附着在染菌大麦粒上,20 d后取出,并分别装入灭菌后的玻璃瓶内,做好标记待用.取出大麦粒洗净消毒后,置于PDA平板培养基上培养3~5 d,观察染菌大麦粒菌丝发展情况.挑取没有明显菌丝扩张的培养皿内的拮抗菌,进行分离纯化培养,得到拮抗菌株DY04[25].
1.2.2 拮抗菌株DY04对病原真菌的防效测定 采用平板对峙法[26]进行测定.将蒸过或煮过的大麦粒装入培养瓶高温灭菌后冷却至室温,向装有大麦粒的瓶中接种拮抗菌DY04菌块,并在28 ℃条件下培养1~2 d,让拮抗菌侵染全部大麦粒.将病原真菌的菌丝块接到PDA培养基(9 cm培养皿)的中央,在距离中央2.5 cm的左右两侧各嵌入一粒携带拮抗菌株DY04的大麦粒,以中央只接种真菌菌块的PDA平板为对照,所有培养皿封口后于28 ℃下培养5~7 d,观察生长情况.每个处理3次重复,当对照菌丝长满整个培养皿时,测定每个培养皿真菌菌落直径,计算抑制率.抑制率/%=(对照菌落直径-处理菌落直径)/对照菌落直径×100.
1.2.3 菌落形态特征鉴定 挑取菌株DY04培养24 h,用100 μL无菌水制成菌悬液[20],然后划线于PDA平板上,28 ℃恒温培养48 h,观察菌落的形态特征.
1.2.4 16S rDNA序列同源性测定 提取拮抗菌株DY04的DNA,由生工生物工程(上海)股份有限公司提取并测序,琼脂糖凝胶电泳检测DNA完整性,PCR所用的引物融合了Miseq测序平台的V3-V4通用引物341F(上游引物5′-CCCTACACGACGCTCTTCCGATCTG-3′,下游引物5′-CCTACGGGNGGCWGCAG-3′)和805R(上游引物5′-GACTGGAGTTCCTTGGCACCCGAGAATTCCA-3′,下游引物5′-GACTACHVGGGTATCTAATCC-3′).PCR 反应体系:2×Taq master Mix 15 μL,Bar-PCR primer F(10 μmol·L-1)1 μL,Primer R(10 μmol·L-1)1 μL,Genomic DNA 10~20 ng,H2O加至 30 μL.PCR 扩增程序:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,共设置25次循环,最后72 ℃延伸5 min.16S rDNA序列在核糖体数据库(http://rdp.cme.msu.edu/index.jsp)中进行BLAST比对.
1.2.5 拮抗菌株DY04发酵液的抑菌效果测定 挑取DY04菌株在红糖豆粉培养基发酵液中培养2 d后,在12 000 r·min-1条件下离心10 min,两次收集上清,上清液过0.22 μm无菌滤膜后分别稀释至2、4、8、16、32倍,取20 μL发酵液采用牛津杯对峙法[26]观察抑菌效果.
1.3 田间试验方法
1.3.1 小麦播种 试验于2020年11月16日—2021年4月15日在福建省南平市农业科学研究所试验基地进行.该基地为全国冬小麦国家区试赤霉病自然抗性鉴定点,赤霉病每年自然稳定发生,无需接种赤霉病菌.冬小麦于11月16日采用条播法播种,行距为26 cm,畦宽1 m,畦长20 m,沟深30 cm,基肥施用小麦专用复合肥900 kg·hm-2、钙镁磷肥600 kg·hm-2,播种后覆土并灌跑马水增加土壤湿度,保证小麦整齐出芽.灌水后立即施用丁草胺除草剂封闭除草,12月10日分蘖盛期施用二甲四氯钠防治双子叶杂草,12月25日人工培土除杂草,次年2月2日施用拔节肥.
1.3.2 试验设计 共设置5个处理:(1)灌根,在小麦始穗期用拮抗菌株DY04的原液灌根处理一次;(2)穗部喷洒原液,分别在小麦始穗期、始花期和盛花期在穗部喷洒拮抗菌株DY04的原液(含助剂)各一次;(3)穗部喷洒发酵液,分别在小麦始穗期、始花期和盛花期在穗部喷洒拮抗菌株DY04的发酵液(含助剂)各一次;(4)农药对照,分别在小麦始穗期、始花期和盛花期在穗部喷洒60%戊唑多菌灵水分散粒剂(河北冠龙农化有限公司)各一次;(5)空白对照(CK),分别在小麦始穗期、始花期和盛花期在穗部喷洒清水各一次.每个处理3次重复,共15个小区,每个小区20 m2.穗部喷洒的拮抗菌原液(NB培养液培养)和发酵液(红糖豆粉培养液培养)有效成分含量为150 000亿个·hm-2,灌根处理的有效成分含量为300 000亿个·hm-2.
1.3.3 调查方法 于小麦黄熟期病害稳定时采用5点取样法调查赤霉病发病情况.每点调查40穗,每小区调查200穗,记录小麦的病穗数和病小穗数,计算病穗率、病小穗率和防效,防效/%=(空白对照小区的病小穗率-处理小区的病小穗率)/空白对照小区的病小穗率×100[27].同时,于收获期调查有效穗数、每穗实粒数,测千粒重,计算理论产量和增产率.单位面积理论产量/(kg·hm-2)=平均每穗实粒数×千粒重(g)×每公顷有效穗数×10-3.
1.4 数据处理
运用IBM SPSS Statistics 19软件选择单因素方差分析处理数据.
2 结果与分析
2.1 菌落形态
多粘类芽孢杆菌是一种革兰氏阳性菌,好氧或兼性厌氧生活[8].显微镜(凤凰光学PH100-3A41L-EP)下观察到DY04菌体呈杆状,菌体大小为(0.5~1.0)μm×(2.0~8.0)μm,在PDA固体培养基上菌落呈白色透明、圆形,边缘整齐,表面湿润、光滑、微隆起(图1).形态特征与多粘类芽孢杆菌相吻合.
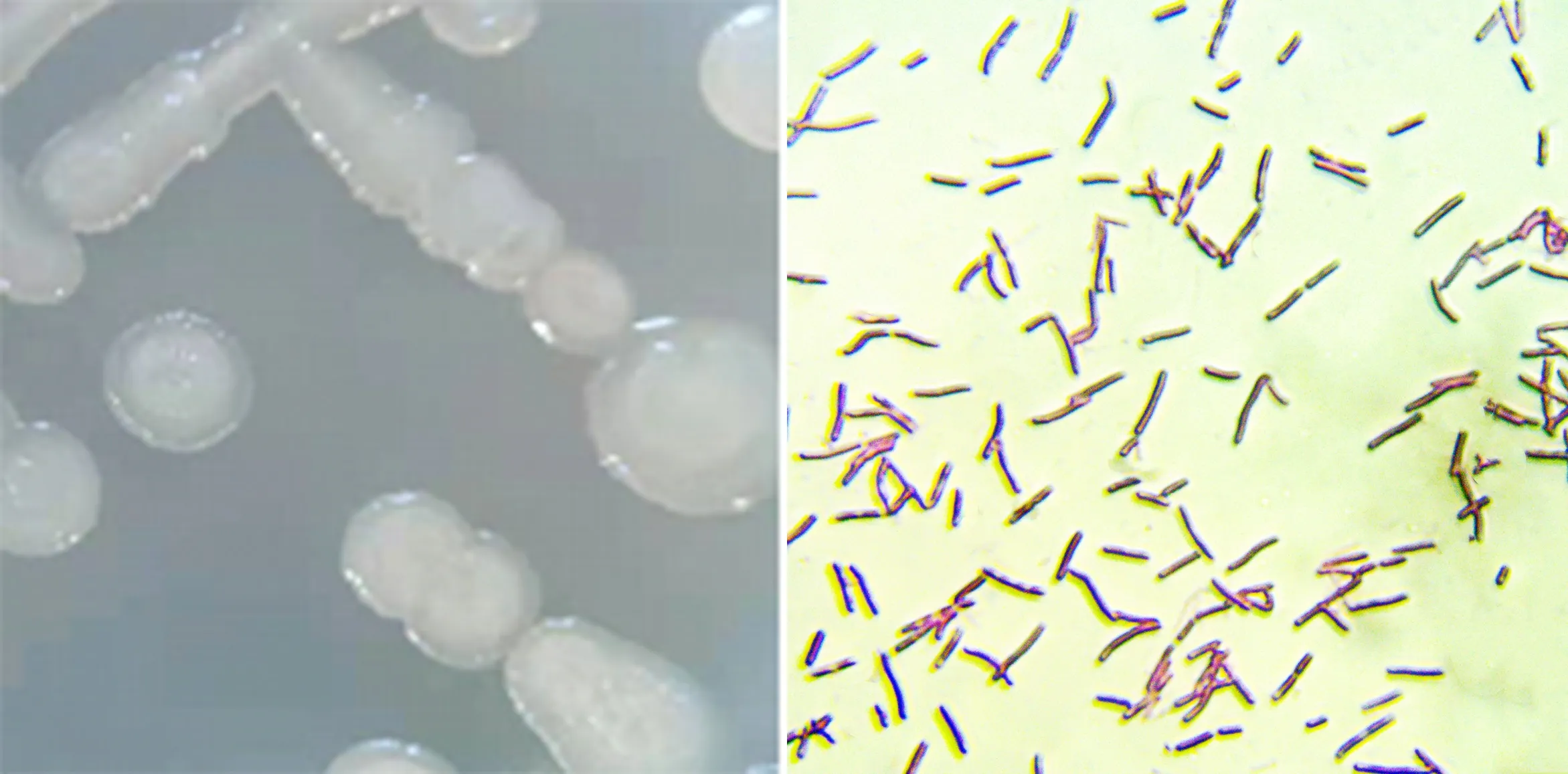
图1 菌株DY04菌落(左)及菌体形态(右)(×1 000)
2.2 16S rDNA序列比对结果
菌株DY04的16S rDNA的序列长度为1 490 bp.经同源性鉴定,该菌株为类芽孢杆菌属(Paenibacillus).由系统发育树(图2)可以看出,菌株DY04与Paenibacilluspolymyxa(多粘类芽孢杆菌)聚为一个分支.结合形态特征,将其鉴定为多粘类芽孢杆菌.

图2 菌株DY04的系统发育树
2.3 菌株DY04的抑菌效果
通过平板对峙法测定了菌株DY04对10种真菌的抑菌活性,结果(图3、表1)表明,该菌株对10种病原真菌均有不同程度的拮抗作用,表现出广谱抗病原真菌的特性.其中:对禾谷镰刀菌和稻瘟病菌的抑制率都达到80%以上;对茶拟盘多毛孢、番茄尖孢镰刀菌、灰霉病菌和玉米纹枯病菌的抑菌活性也较强,抑制率达到60%以上;对玉米平脐蠕孢的抑制率最低,为46.27%.
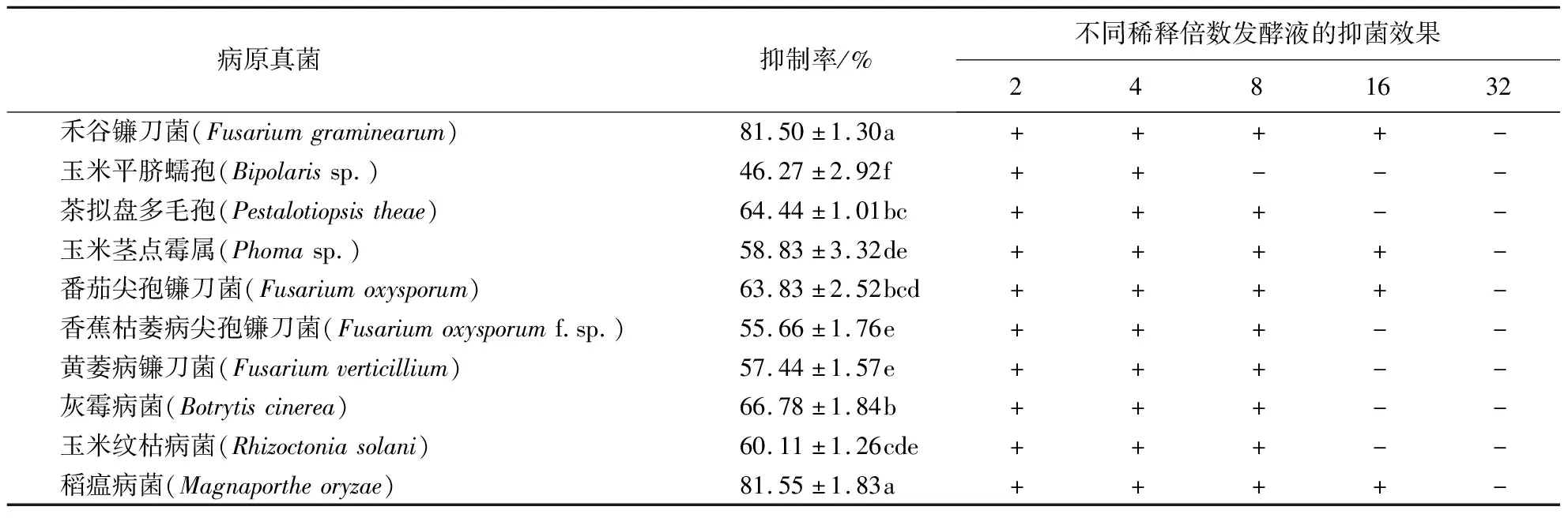
表1 菌株DY04及其发酵液的拮抗谱1)
2.4 菌株DY04发酵液的抑菌效果
采用牛津杯对峙法测定了菌株DY04发酵液对10种真菌的抑菌活性,结果(表1)表明:菌株DY04发酵液稀释至4倍时对10种真菌都有抑制作用;稀释至16倍时仅对禾谷镰刀菌、玉米茎点霉属、番茄尖孢镰刀菌和稻瘟病菌等4种真菌具有抑制效果.
2.5 施药方法对菌株DY04防治小麦赤霉病的影响
表2显示,戊唑多菌灵对小麦赤霉病的防效最高,达到83.46%.多粘类芽孢杆菌菌株DY04的3种施药方法中:灌根处理的防效最高,达到58.43%;穗部喷洒发酵液的防效次之,为57.76%;穗部喷洒原液的防效为47.63%.
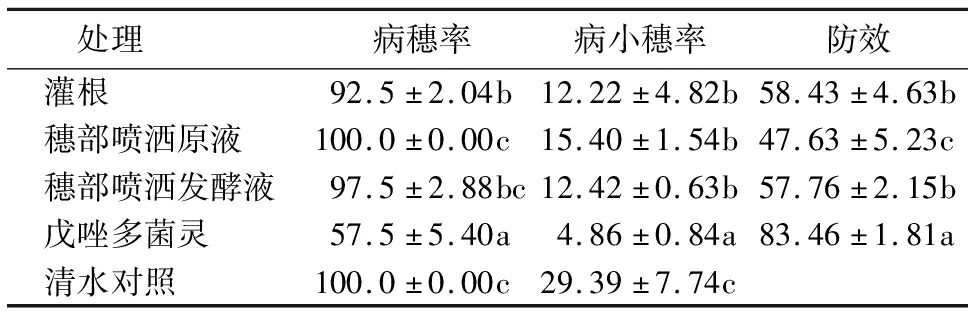
表2 菌株DY04对小麦赤霉病的田间防治效果1)
2.6 菌株DY04施用方法对小麦产量的影响
表3显示,小麦经3种方法施用多粘类芽孢杆菌菌株DY04后,穗实粒率、穗实粒数、千粒重与对照相比均有显著增加.灌根处理、穗部喷洒原液和穗部喷洒发酵液处理的千粒重分别比对照增加8.83%、5.93%和7.21%;理论产量增产率分别为45.21%、25.29%和29.10%.
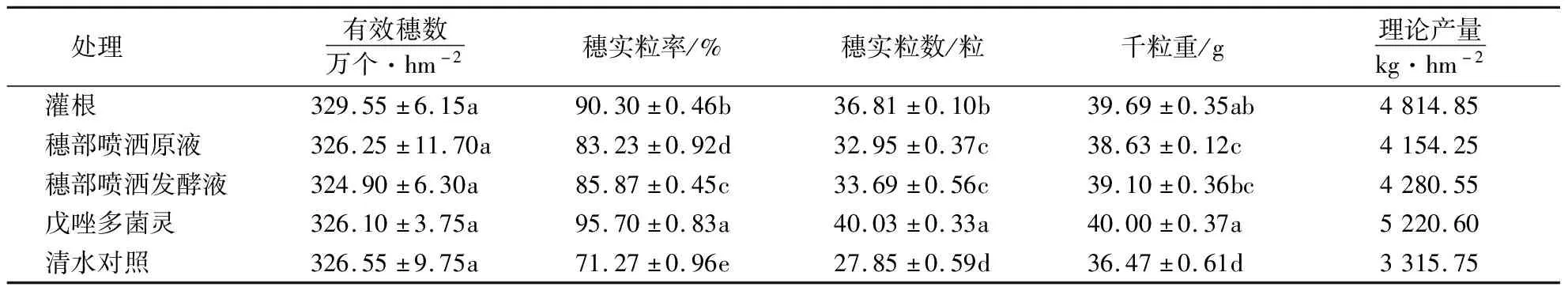
表3 菌株DY04施用方法对小麦产量的影响1)
3 讨论
多数研究者认为,多粘类芽孢杆菌为土壤中的活跃菌,容易在土壤中定殖和繁殖,在土壤的物资和能量循环中发挥重要作用,其代谢产物能够有效抑制病害;同时,该菌具有溶磷和固氮作用,能够增加土壤肥力和调节土壤微生态,促进植物生长,进而增强植物抵抗力[28-33].本试验中的多粘类芽孢杆菌DY04为土壤中筛选出的微生物菌.本研究表明,与穗部喷洒原液(防效为47.63%)或发酵液(防效为57.76%)相比,田间采用灌根方式施用多粘类芽孢杆菌DY04,对小麦赤霉病的防效较好,达58.43%.虽然在穗部施用时添加了保护剂等抗紫外线的助剂,且设置了连续施药3次的处理,但是防效持续性仍不够强,原菌及其代谢产物对紫外线敏感,且原菌不易定殖于植株穗部,导致穗部喷施的效果不及灌根处理.针对穗部喷药持效性弱的问题,今后可尝试炼化该菌的抗紫外线能力后进一步验证其持效性;灌根处理虽然防效较好,但与化学农药相比仍存在很大的差距,本试验中灌根处理只在抽穗初期进行了一次,今后可以通过在分蘖初期至扬花期增加灌根次数测试其是否能够提高药效,同时观察该菌在土壤中的定殖能力,为进一步分析其控制赤霉病发生的机理奠定基础.
赤霉病菌会造成小麦穗部空瘪、籽粒发红发黑、千粒重低,从而降低结实率.本研究表明,与穗部喷洒原液或发酵液相比,灌根处理后小麦产量的增幅最大,千粒重比对照增加8.83%,理论产量增产率为45.21%.笔者田间观察发现,用多粘类芽孢杆菌DY04灌根处理后,灌浆期小麦籽粒外壳部分虽然有红褐色病斑,但后期受到控制并未影响内部健康籽粒;而穗部喷洒原液或发酵液后,灌浆后期外壳带菌麦粒并不能被有效控制,赤霉病菌仍向内部发展,从而降低了籽粒品质.有关灌根处理对小麦赤霉病的防治机理值得深入研究.
致谢:衷心感谢苏妍、黄继平、洪红升、葛桂梅、刘友等同事对该试验给予的帮助.
