巨大芽孢杆菌ω-转氨酶催化合成手性β-氨基醇
2022-01-17杨晓晓张朝峰常宏宏张建栋
杨晓晓, 李 静, 张朝峰, 常宏宏, 张建栋
巨大芽孢杆菌-转氨酶催化合成手性-氨基醇
杨晓晓, 李 静, 张朝峰, 常宏宏, 张建栋
(太原理工大学 生物医学工程学院, 山西 太原 030024)
针对目前用于合成手性-氨基醇的()-转氨酶稀缺的问题,对来自巨大芽孢杆菌(SC6394)的 ()--转氨酶(BMTA)基因密码子进行优化,在大肠杆菌中成功表达,并对BMTA进行纯化表征。结果表明:BMTA对()--氨基醇具有较高活力,对()--氨基醇没有活力;BMTA在pH为7.5、温度为55 ℃下酶活最高,在pH为6.5~8.0,温度为4~30 ℃内具有较好的稳定性。应用BMTA对不同外消旋-氨基醇进行动力学拆分,底物转化率高达50%,对映体过量值(ee)为50%~99%。应用BMTA不对称还原胺化不同-羟基酮,产物()--氨基醇转化率高达58%~96%,ee>99%。
-转氨酶;手性-氨基醇;羟酮;动力学拆分;不对称还原胺化
1 前言
手性-氨基醇是一类非常重要的化合物,可以作为手性助剂或手性配体用于不对称催化反应[1-2],也可作为手性中间体或砌块用于合成多种手性药物[3-4]。化学法合成手性-氨基醇[5-7]普遍存在合成工艺复杂、反应条件苛刻、选择性不高、催化剂昂贵等缺点。生物法作为一种绿色可持续方法[8],已成为国际研究热点。目前,生物法合成手性-氨基醇主要包括转氨酶动力学拆分和不对称还原胺化[9]、脂肪酶动力学拆分[10]、胺脱氢酶不对称还原[11]、酮还原酶不对称还原[12],以及级联生物催化环氧化物不对称开环等[13]。转氨酶作为一种高效催化剂在手性胺合成方面已经得到广泛应用[14],但关于手性-氨基醇尤其是()--氨基醇合成的报道较少。目前仅有来自紫色色杆菌()的CVTA被报道可以还原胺化羟酮合成()--氨基醇,但产物转化率不到40%[15]。近年来,对来自河弧菌()[16]和鲁杰氏菌(TM1040)[17]的转氨酶(vfTA和3FCR)进行了定向进化,得到的突变酶被用于合成()--氨基醇,但反应效率仍有待提高。因此,筛选新的高活力高选择性转氨酶用于手性-氨基醇的合成具有重要的价值。
本研究对来自巨大芽孢杆菌(SC6394)[18]的一个()-转氨酶(BMTA)基因序列进行了密码子优化,在大肠杆菌(BL21)中进行了表达纯化及酶学性质表征;应用BMTA对外消旋-氨基醇进行了动力学拆分,得到()--氨基醇,同时考察了BMTA不对称还原胺化-羟基酮合成()--氨基醇的效率。
2 实验部分
2.1 材料与试剂
菌种与质粒:BL21感受态细胞购于天根生化公司,质粒pET-28a(+)购于安诺伦生物科技有限公司。
培养基(LB培养基):质量浓度为10.0 g×L-1胰蛋白胨、5.0 g×L-1酵母提取物、10.0 g×L-1氯化钠(NaCl),固体培养基添加质量浓度为15.0 g×L-1琼脂粉。
Terrific Broth培养基(TB培养基):质量浓度为12.0 g×L-1胰蛋白胨、24.0 g×L-1酵母提取物、2.31 g×L-1磷酸二氢钾、12.54 g×L-1磷酸氢二钾、体积分数为4 mL×L-1甘油。其中涉及的试剂均为生化试剂级别,购于生工生物工程(上海)有限公司。
试剂:外消旋-氨基醇((±)-1)、()-1和()-1购于安耐吉化学有限公司和苏州爱玛特科技有限公司,-羟基酮(2)购于安耐吉化学有限公司和百灵威科技有限公司。本研究中所涉及的化学药品均为分析纯,其他化学试剂均可从市面上购买获得。
2.2 实验方法
2.2.1-转氨酶重组菌的构建
-转氨酶BMTA基因来自巨大芽孢杆菌(SC6394),对BMTA基因密码子进行优化并交公司合成(通用生物公司)。将目的基因与表达载体pET28a连接,获得重组质粒pET28a-BMTA。将重组质粒pET28a-BMTA导入BL21感受态细胞中,获得重组(BMTA)。
2.2.2 BMTA在大肠杆菌中的表达及纯化
将(BMTA)接种于质量浓度为50 μg×mL-1卡那霉素的LB液体培养基中,温度为37 ℃、转速为200 r×min-1培养7 h,取1 mL的培养液于50 mL的TB培养基(质量浓度为50 μg×mL-1的卡那霉素)中进行扩大培养。当培养液在波长为600 nm的吸光值(OD600)达到0.5~0.6时,向培养基中加入浓度为0.5 mmol×L-1的异丙基--D-硫代半乳糖苷(isopropy--D-thiogalactoside,IPTG),20 ℃、200 r×min-1的条件下继续培养12~14 h,离心收集菌体,将菌体用磷酸缓冲液(浓度为100 mmol×L-1,pH=8.0)洗涤2次,最后用磷酸缓冲液将细胞悬浮,置于冰上,400 W下进行超声破碎10 min(工作时间4 s,间歇时间4 s),将破碎液在温度为4 ℃、转速为3 000 r×min-1的条件下离心30 min,获得BMTA的粗酶液,通过镍柱进行纯化,SDS-PAGE分析纯化后的蛋白。
2.2.3 BMTA的酶活力检测及酶活单位定义
1 mL反应液中有浓度为100 mmol×L-1磷酸钠缓冲液(pH=8.0)、10 mmol×L-1底物、10 mmol×L-1丙酮酸钠、0.2 mmol×L-15'-磷酸吡哆醛(pyridoxal 5'-phosphate,PLP)和0.1 mL酶液,30 ℃反应10 min后,取样300 µL,NaCl饱和,加入10 µL氢氧化钠(浓度为10 mol×L-1)调节溶液pH>10.0,加入300 µL乙酸乙酯(含内标物20 mmol×L-1十二烷)萃取,有机相加无水硫酸钠干燥后,气相检测生成-羟基酮的量。1 min内催化1 μmol产物生成所需要的酶量定义为1个酶活单位(U)。以牛血清白蛋白(BSA)为标准,采用Bradford法测定酶液中蛋白质的浓度[19]。
2.2.4 pH和温度对BMTA酶活性的影响
在不同pH值的缓冲溶液中(磷酸钠缓冲液(100 mmol×L-1,pH为6.0~8.0)、Tris×HCl缓冲液(100 mmol×L-1,pH为8.0~9.0)和甘氨酸-氢氧化钠缓冲液(50 mmol×L-1,pH为9.0~10.0))测定BMTA对()-1c酶活。在最佳pH条件下,在不同温度(25~65 ℃)下检测BMTA对()-1c的酶活(参照2.2.3节)。
2.2.5 pH和温度对BMTA稳定性的影响
将BMTA置于2.2.4节不同pH的缓冲液中,于4 ℃下保存,不同时间取样检测该酶的残余酶活。将BMTA置于磷酸钠缓冲液(100 mmol×L-1,pH=7.5)中,分别在4~50 ℃的水浴中孵育,不同时间取样检测该酶的残余酶活(参照2.2.3节)。
2.2.6 BMTA动力学拆分外消旋-氨基醇
5 mL反应体系中有浓度为100 mmol×L-1磷酸钠缓冲液(pH=7.5)、5~20 mmol×L-1底物((±)-1a-l)、0.2 mmol×L-1PLP、5~20 mmol×L-1丙酮酸钠、质量浓度为10 mg×mL-1BMTA,在30 ℃、200 r×min-1的条件下反应12~24 h,取样300 µL,NaCl饱和,加入10 µL NaOH (10 mol×L-1)调节溶液pH>10.0,加入300 µL乙酸乙酯(含内标物20 mmol×L-1十二烷)萃取,有机相加无水硫酸钠干燥后,气相检测生成-羟基酮的量以及底物的对映体过量百分数(electrical engineering, ee),反应路线如图1所示。
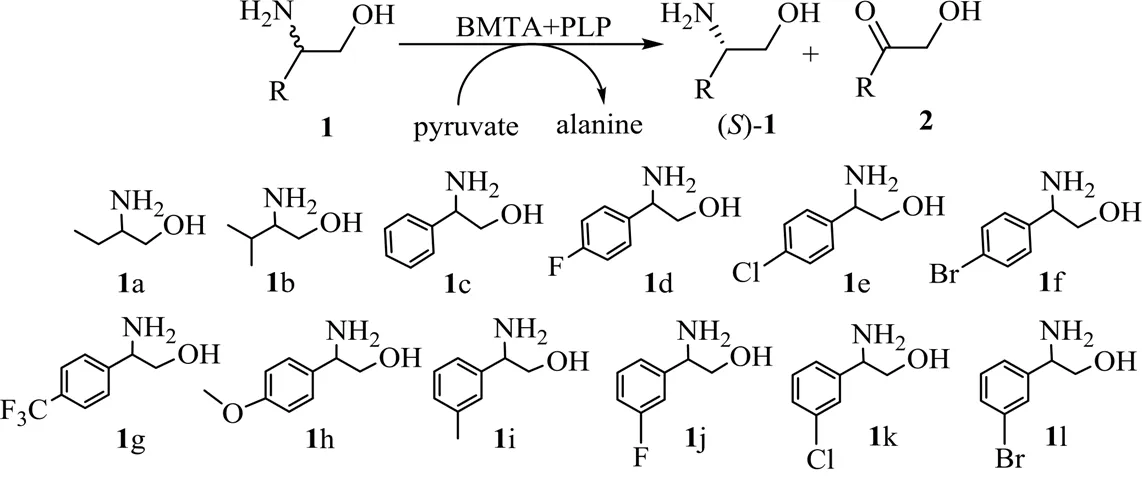
图1 ω-转氨酶BMTA拆分外消旋β-氨基醇
2.2.7 BMTA不对称还原胺化-羟基酮
5 mL反应体系中有浓度为100 mmol×L-1磷酸钠缓冲液(pH=7.5)、10~20 mmol×L-1-羟基酮底物(2a-f)、0.2 mmol×L-1PLP、200~400 mmol×L-1L-丙氨酸、质量浓度为10 mg×mL-1BMTA,在30 ℃、200 r×min-1的条件下反应10~20 h,取样300 µL,NaCl饱和,加入10 µL NaOH(10 mol×L-1)调节溶液pH>10.0,加入300 µL乙酸乙酯(含内标物20 mmol×L-1十二烷)萃取,有机相加无水硫酸钠干燥后,气相检测生成-氨基醇的量以及产物的ee值,反应路线如图2所示。

图2 ω-转氨酶BMTA催化α-羟基酮不对称还原胺化
2.2.8 BMTA动力学拆分(±)-1c制备()-1c
100 mL反应体系中有浓度为100 mmol×L-1磷酸钠缓冲液(pH 7.5)、20 mmol×L-1底物((±)-1c)、0.2 mmol×L-1PLP、20 mmol×L-1丙酮酸钠、质量浓度为10 mg×mL-1BMTA,在30 ℃、200 r×min-1的条件下反应24 h,反应液中加NaCl饱和,加入盐酸使溶液pH<2,100 mL乙酸乙酯连续萃取3次去除所提取的-羟基酮。加入NaOH溶液(10 mol×L-1)使溶液pH>10,100 mL乙酸乙酯重复萃取3次,有机相加无水硫酸钠干燥,过滤后旋转蒸发除去乙酸乙酯,得到的产物真空干燥过夜,计算产物得率。
2.2.9 分析方法
使用气相色谱分析转化率和ee值,具体方法按照Zhang等的方法进行[9]。
3 结果与讨论
3.1 BMTA的表达、纯化和酶活检测
如图3(a)所示,在蛋白质相对分子量r=53 000处出现与BMTA理论大小一致的目的条带,证明BMTA在大肠杆菌中成功表达,并且大多为可溶性表达(如图3(a)所示,lane 2),仅产生少量包涵体蛋白(图3(a),lane 3)。粗酶液经镍柱纯化后,得到单一的目的蛋白条带(图3(b),lanes 7~8)。对纯酶酶活分析发现,BMTA对()-1c有较高酶活(1.1 U×mg-1),对()-1c无活性。Nobili等[16]通过对来自的转氨酶vfTA进行蛋白质改造来提高其催化活力,对()-苯甘氨醇的催化活力仅为0.53 U×mg-1。BMTA作为一种()-选择性转氨酶,可立体选择性转化()--氨基醇,这一现象可用Cahn-Ingold-Prelog规则来解释[17]。

图3 ω-转氨酶BMTA表达及纯化的SDS-PAGE电泳图
3.2 pH对BMTA活性及稳定性的影响
如图4(a)所示,BMTA的最合适pH=7.5,当pH=6.5~8.0时,BMTA相对酶活稳定在80% 以上,当pH>8.5或者pH<6.5时,酶活迅速下降。如图4(b)所示,BMTA在pH=7.0的条件下较稳定,该条件下孵育24 h,残余酶活仍保持在74% 以上;在pH=7.5的条件下孵育24 h,残余酶活保持在65% 以上。当pH>8.5或pH<6.5时,BMTA酶活损失较大。BMTA在pH=7.0~8.0较稳定,而多数已报道的转氨酶的最适pH偏高,如Shin等[20]报道的来自JS17的转氨酶vfTA的最适pH=9.2,当pH>9.0时,酶稳定性迅速下降。
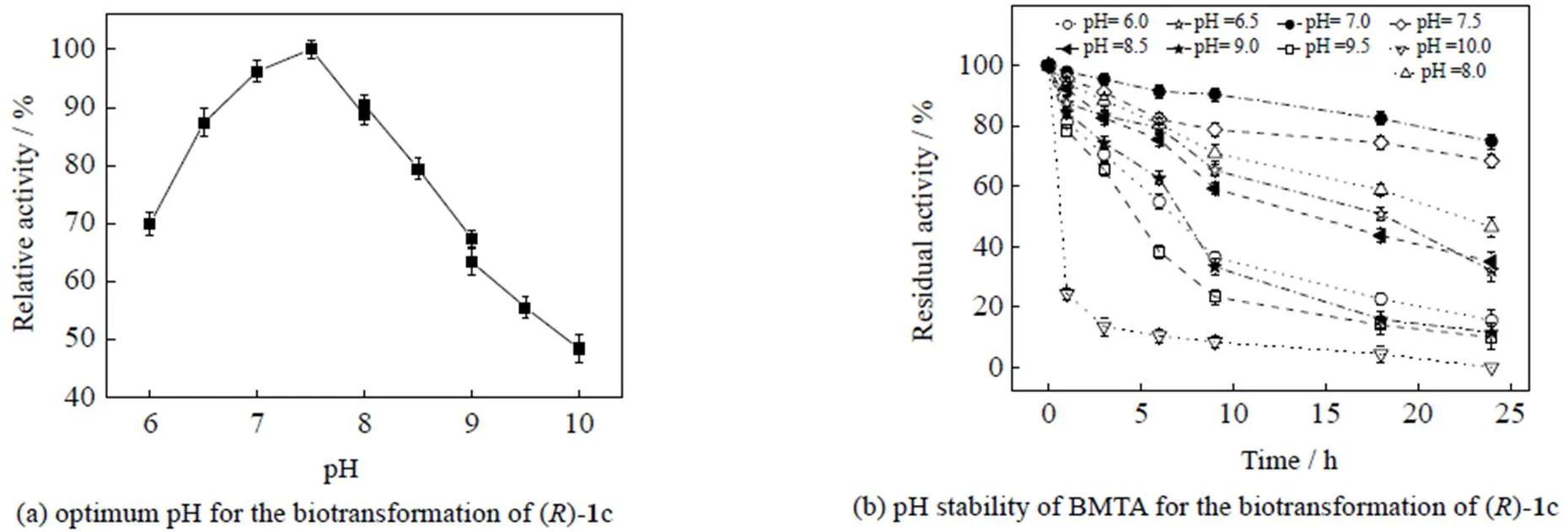
图4 pH对ω-转氨酶BMTA活性及稳定性的影响
3.3 温度对BMTA活性及稳定性的影响
如图5(a)所示,BMTA的最合适反应温度为55 ℃,高于60 ℃或低于50 ℃条件下,酶活迅速下降。BMTA温度稳定性结果如图5(b)所示,BMTA在温度为30 ℃下孵育24 h,残余酶活仍保持在50% 以上。在50 ℃下孵育9 h后酶活基本丧失,显示该酶在低于40 ℃温度下具有较好的稳定性。该结果与已报道的大多数转氨酶相似,如来自结核分枝杆菌()的()-转氨酶MVTA[9],当温度高于40 ℃后,该酶酶活迅速下降。
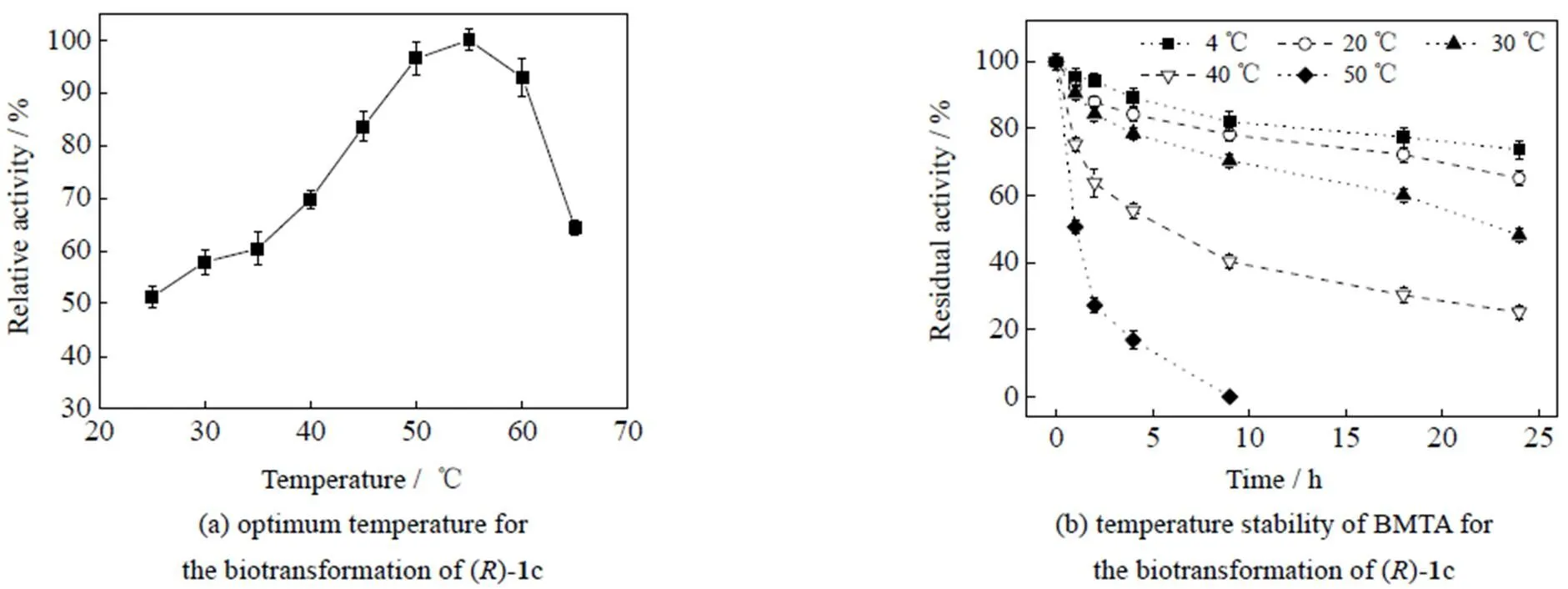
图5 温度对ω-转氨酶BMTA活性及稳定性的影响
3.4 BMTA的底物特异性
BMTA对不同-氨基醇的酶活如表1所示,对链状-氨基醇()-1a的活性较低(0.152 U×mg-1),而对含支链的链状-氨基醇()-1b活性较高(1.083 U×mg-1);BMTA对含苯环-氨基醇()-1c的活性最高(1.107 U×mg-1),对苯环对位含有卤素取代基的底物(()-1d-f)的活性呈下降趋势,为0.658~0.353 U×mg-1;BMTA对苯环对位含─CF3取代基的底物(()-1h)有较高活性(0.624 U×mg-1);当底物的苯环间位被卤素取代后(()-1j-k),BMTA的活性也呈现下降趋势,为0.758~0.346 U×mg-1。BMTA对所有()-底物(1a-l)没有活性,可见BMTA对-氨基醇具有极高的立体选择性。
表1 BMTA对不同底物的酶活性
3.5 BMTA动力学拆分外消旋β-氨基醇
如表2所示,BMTA对底物(±)-1a活性较低,反应24 h后,底物转化率仅有31.5%,ee值为50.1%;对其他底物(±)-1b-l,BMTA的活性较高,反应12~24 h,底物完全被拆分,底物转化率为50%左右,ee>98%。

表2 BMTA拆分外消旋β-氨基醇
3.6 BMTA不对称还原胺化α-羟基酮
如表3所示,BMTA对6种-羟基酮进行不对称还原胺化反应。反应10 h,底物2b-2d的转化率可达93% 以上,而底物2e转化率可达85.3%,产物ee>99%。进一步提高底物2c浓度至20 mmol×L-1,反应20 h,底物转化率仍可达95.2%。BMTA对2a和2f活力较低,反应10 h,转化率分别为58% 和60%。与BMTA相比,目前已报道转氨酶催化-羟基酮还原胺化活力普遍较低,如Nobili等[16]通过对来自的转氨酶vfTA进行蛋白质改造来提高其催化活力,但产物()-苯甘氨醇得率仅有60%。
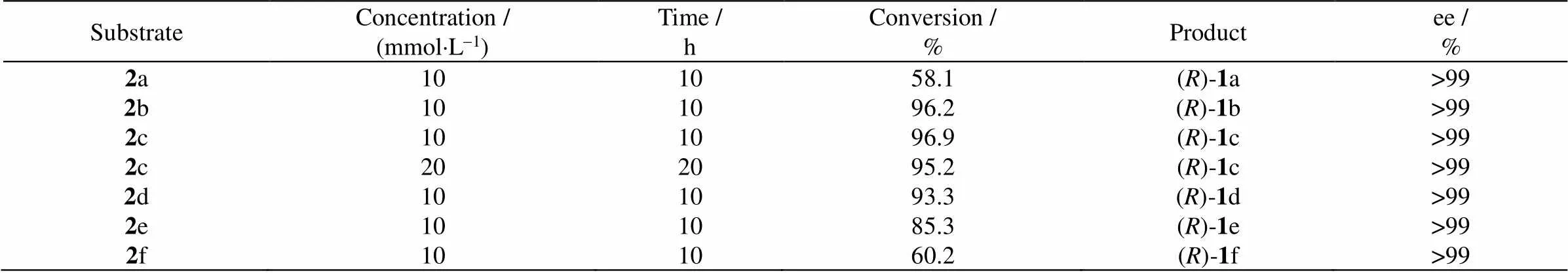
表3 BMTA不对称还原胺化α-羟基酮
3.7 BMTA动力学拆分(±)-1c制备(S)-1c
在100 mL的反应体系中对20 mmol×L-1(±)-1c (275 mg)进行动力学拆分,反应24 h,转化率可达50%。经纯化后获得110.4 mg ()-1c,得率为40.2%,纯度>98%,ee>99%。
4 结论
对来自巨大芽孢杆菌(SC6394)的一个()-选择性-转氨酶BMTA基因密码子进行优化,并成功在大肠杆菌中进行高效表达,对酶进行了纯化和表征。研究发现,在温度为30 ℃、pH=7.5的条件下,且在PLP和丙酮酸钠存在时,BMTA可以拆分外消旋-氨基醇合成()--氨基醇;在30 ℃、pH=7.5的条件下,且在PLP和L-丙氨酸存在时,BMTA可不对称还原胺化-羟基酮合成()--氨基醇。此外,在100 mL的反应体系中对外消旋苯甘氨醇进行了动力学拆分,成功制备了()-1c,得率高达40.2%,ee>99%。本研究证明了BMTA对-氨基醇类化合物具有较高的活力和极好的立体选择性,对手性β-氨基醇类药物中间体工业化生产具有潜在的应用价值。
[1] AGER D J, SCHAAD D R, PRAKASH I.1,2-Amino alcohols and their heterocyclic derivatives as chiral auxiliaries in asymmetric synthesis [J]. Chemical Reviews, 1996, 27(2): 835-876.
[2] MAO P, YANG L R, XIAO Y M,. Synthesis of chiral imidazole amino alcohols and their application in the asymmetric copper-catalyzed henry reaction [J]. Chinese Journal of Organic Chemistry, 2019, 39(2): 443-448.
[3] RADL S, STACH J, PISA O,. An improved synthesis of elvitegravir [J]. Journal of Heterocyclic Chemistry, 2016, 53(6): 1738-1749.
[4] GUO J, ZHU M Y, WU T X,. Discovery of indolin-2-one derivatives as potent PAK4 inhibitors: Structure-activity relationship analysis, biological evaluation and molecular docking study [J]. Bioorganic & Medicinal Chemistry, 2017, 25(13): 3500-3511.
[5] 李鑫磊, 许孝良, 李小年.-氨基酸还原制备-氨基醇研究进展[J]. 现代化工, 2017, 37(4): 28-32.
LI X L, XU X L, LI X N. Progress of the preparation of-amino alcohols by reduction of-amino acid [J]. Modern Chemical Industry,2017, 37(4): 28-32.
[6] BODKIN J A, MCLEOD M D. The sharpless asymmetric aminohydroxylation [J]. Journal of the Chemical Society Perkin Transactions, 2002, 34(24): 2733-2746.
[7] WANG C, LUO L, YAMAMOTO H. Metal-catalyzed directed regio- and enantioselective ring-opening of epoxides [J]. Accounts of Chemical Research,2016, 49(2): 193-204.
[8] 许娜, 关今韬, 张颂红, 等. 晶胶固载副干酪乳杆菌及合成苯乳酸的实验研究[J]. 高校化学工程学报, 2020, 34(1): 149-154.
XU N, GUAN J T, ZHANG S H,. Preparation ofcell-immobilized cryogel biocatalysts for biosynthesis of phenyllactic acid [J]. Journal of Chemical Engineering of Chinese Universities, 2020, 34(1): 149-154.
[9] ZHANG J D, ZHAO J W, GAO L L,. Enantioselective synthesis of enantiopure-amino alcohols via kinetic resolution and asymmetric reductive amination by a robust transaminase from[J]. Journal of Biotechnology, 2019, 290: 24-32.
[10] ROUF A, GUPTA P, AGA M A,. Cyclic--amino alcohols: Preparation and enzymatic kinetic resolution [J]. Tetrahedron Asymmetry, 2011, 22(24): 2134-2143.
[11] WANG H, QU G, LI J K,. Data mining of amine dehydrogenases for the synthesis of enantiopure amino alcohols [J]. Catalysis Science & Technology, 2020, 10(17): 5945-5952.
[12] PATEL R N, BANERJEE A, HOWELL J M,. Microbial synthesis of (2,3)-(-)-N-benzoyl-3-phenyl isoserine ethyl ester-a taxol side-chain synthon [J].Tetrahedron: Asymmetry, 1993, 4(9): 2069-2084.
[13] ZHANG J D, YANG X X, JIA Q,. Asymmetric ring opening of racemic epoxides for enantioselective synthesis of ()--amino alcohols by a cofactor self-sufficient cascade biocatalysis system [J]. Catalysis Science & Technology, 2019, 9(1): 70-74.
[14] FUCHS M, FARNBERGER J E, KROUTIL W. The industrial age of biocatalytic transamination [J]. European Journal of Organic Chemistry, 2015, 2015(32): 6965-6982.
[15] SEHL T, SIMON R C, HAILES H C,. TTC-based screening assay for-transaminases: A rapid method to detect reduction of 2-hydroxy ketones [J]. Journal of Biotechnology, 2012, 159(3):188-194.
[16] NOBILI A, STEFFEN-MUNSBERG F, KOHLS H,. Engineering the active site of the amine transaminase fromfor the asymmetric synthesis of aryl-alkyl amines and amino alcohols [J]. ChemCatChem, 2015, 7(5): 757-760.
[17] PAVLIDIS I V, WEISS M S, GENZ M,. Identification of ()-selective transaminases for the asymmetric synthesis of bulky chiral amines [J]. Nature Chemistry, 2016, 8(11): 1076-1082.
[18] HANSON R L, DAVIS B L, CHEN Y,. Preparation of ()-amines from racemic amines with an ()-amine transaminase from[J]. Advanced Synthesis & Catalysis, 2008, 350(9): 1367-1375.
[19] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[20] SHIN J S, YUN H, JANG J W,. Purification, characterization, and molecular cloning of a novel amine: Pyruvate transaminase fromJS17 [J]. Applied Microbiology and Biotechnology, 2003, 61(5): 463-471.
Synthesis of chiral-amino alcohols by-transaminases from
YANG Xiao-xiao, LI Jing, ZHANG Chao-feng, CHANG Hong-hong, ZHANG Jian-dong
(College of Biomedical Engineering, Taiyuan University of Technology, Taiyuan 030024, China)
()-transaminases available for chiral-amino alcohol synthesis are limited. A ()--transaminase (BMTA) gene (fromSC6394) codons was optimized and overexpressed in, and it was purified and characterized. The results show that the BMTA had high activity toward ()--amino alcohols, but no activity toward ()--amino alcohols. The maximum activity of BMTA was detected at pH 7.5 and 55 ℃, and it had good stability at pHs from 6.5 to 8.0 and temperatures from 4 ℃ to 30 ℃. Kinetic resolution of a set of racemic-amino alcohols by BMTA resulted in 50% conversion of substrates with 50%-99% ee of ()--amino alcohols. Asymmetric reductive amination of several-hydroxy ketones by BMTA resulted in 58%-96% conversions and >99% ee of ()--amino alcohols.
-transaminase; chiral-amino alcohols;-hydroxy ketones; kinetic resolution; asymmetric reduction amination
1003-9015(2021)06-1035-06
Q555.2
A
10.3969/j.issn.1003-9015.2021.06.011
2020-10-16;
2020-12-29。
国家自然科学基金(21772141);山西省青年基金 (201701D221042)。
杨晓晓(1996-),女,山西临汾人,太原理工大学硕士生。
张建栋,E-mail:zhangjiandong@tyut.edu.cn
