刺梨果实发育过程中糖和黄酮的积累及其与光照强度变化的相关性
2022-01-17樊卫国潘学军何春丽陈红周禹佳
樊卫国,潘学军,何春丽,陈红,周禹佳
刺梨果实发育过程中糖和黄酮的积累及其与光照强度变化的相关性
樊卫国,潘学军,何春丽,陈红,周禹佳
贵州大学/国家林业和草原局刺梨工程技术研究中心,贵阳 550025
【目的】研究不同光照强度对刺梨(Tratt.)果实发育过程中糖和总黄酮的积累规律及其对光照强度变化的生理关联性,为刺梨果实的品质调控提供科学依据。【方法】以4年生的‘贵农5号’刺梨结果树为材料,以自然光照强度为对照,设置光照强度减弱20%、40%、60%的3个处理(分别用R0(CK)、R20、R40、R60表示),分析测定不同发育时期刺梨果实中可溶性糖和总黄酮的积累量、相关合成代谢酶活性及其与光照强度变化的相互关系。【结果】在刺梨果实生长发育过程中,糖和总黄酮类物质不断积累,但不同发育时期的积累量有明显差异。在果实缓慢生长期之后,果实中的糖分开始快速积累,到成熟期可溶性总糖和蔗糖的积累量达到最高,其中蔗糖的积累量占可溶性总糖的36.97%。刺梨果实中葡萄糖和果糖的积累量至快速膨大期达到最大,但仅占果实成熟期可溶性总糖最大积累量的10.50%和18.18%。刺梨果实属于蔗糖积累型。刺梨果实中的总黄酮从幼果期开始就快速积累,一直持续到果实快速膨大期,之后总黄酮的积累量增加不明显。刺梨果实发育过程中,不同光照强度下的果实中糖和总黄酮的积累量差异显著,光照强度减弱不利于果实中糖和总黄酮的积累。蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)、转化酶(Ivr)和丙氨酸解氨酶(PAL)、肉桂酸-4-羟基化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)、查尔酮合成酶(CHS)分别是影响果实中糖和黄酮类物质合成代谢的关键酶,光照强度变化与刺梨果实中糖、总黄酮的积累量以及相关合成代谢酶的活性变化密切关联。光照强度减弱会明显抑制SS、SPS、Ivr、PAL、C4H、4CL、CHS的活性。在刺梨果实整个发育过程中,SS和SPS对光照强度减弱的反应敏感。刺梨果实中糖与总黄酮的积累量呈极显著正相关,果实中糖和总黄酮的积累量以及SS、SPS、IVR、PAL、C4H、4CL、CHS的活性均与光照强度变化呈显著或极显著正相关。【结论】刺梨果实为蔗糖积累型,果实缓慢生长期之后,果实中的糖分开始快速积累,果实中总黄酮的积累量从幼果期开始迅速增长,一直持续到快速膨大期。光照强度减弱不利于刺梨果实中糖和黄酮类物质的积累。生产中可以通过改善光照条件,增加刺梨果实中糖和黄酮类物质的含量,提高刺梨果实的品质。
刺梨;果实;光照强度;糖;总黄酮
0 引言
【研究意义】维生素C和黄酮类物质含量丰富是刺梨(Tratt.)果实的两大特色。在每100 g刺梨果实干样中,总黄酮的含量可达0.93%—1.69%[1-2]。然而,不同产地及采收期的刺梨果实总黄酮含量差异很大[3-4],产地的环境差异和果实发育状况可能与此有关。黄酮类物质是一类以光合产物为基础的次生代谢产物,光照在影响糖类合成代谢的同时,也对黄酮类物质的合成产生重要的影响[5]。迄今,有关光照强弱对刺梨果实发育过程中糖和黄酮类物质的积累及其相关生理影响尚不清楚,对此进行探究有利于刺梨果实品质的生理生态调控。【前人研究进展】有关光照条件对果实糖分和黄酮类物质积累的影响已有较多报道。在光照强度减弱的条件下,甜瓜[6]、梨[7]、葡萄[8]等果实中糖的积累量明显减少,果实中与糖合成密切相关的蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)和转化酶(Ivr)活性受到抑制是影响糖积累的重要生理原因。减弱光照强度不仅会降低蓝莓果实中糖的积累量,总黄酮的积累量也随之降低[9]。在银杏叶中,黄酮类物质的增量具有明显的光强效应,增加光照强度能够显著提高总黄酮的含量[10]。光照影响果实中黄酮类物质合成代谢的基因表达,遮光的核桃果实青皮中黄酮类物质的含量随相关合成酶基因的相对表达量降低而减少[11]。光质也影响果实中黄酮的合成与积累,阳光的紫外线强度减少会降低葡萄果实中黄酮的积累[12]。然而也有例外,如遮光反而增加桃果实中黄酮醇的积累[13],适宜的光照强度有利于杨梅叶中黄酮类物质的合成,过强或过弱的光照则不利于总黄酮的积累[14]。植物体内黄酮类物质的合成是十分复杂的过程,人们普遍公认合成代谢途径是苯丙烷途径[5,15-16],其中,苯丙氨酸解氨酶(PAL)将黄酮类物质合成的初始物质苯丙氨酸脱氨基转化形成肉桂酸,之后由肉桂酸-4-羟化酶(C4H)将肉桂酸转化为P-香豆酸,然后在4-香豆素辅酶A连接酶(4CL)作用下,P-香豆酸和辅酶A生成对香豆酰辅酶A,此后在查尔酮合成酶(CHS)催化下,苹果酰辅酶A与对香豆酰辅酶A发生缩合反应形成查尔酮,然后再进一步衍生转化为黄酮醇、黄烷酮醇、异黄酮、异黄烷酮等各类黄酮化合物[15,17-19]。因此,PAL、C4H、4CL和CHS是黄酮类物质合成代谢过程中具有关键作用的酶,其活性的强弱与黄酮类物质的合成与积累密切相关。然而光照强度、光质和光照时长都能促进植物体内黄酮类物质合成代谢途径中关键酶的基因表达,进而增强相关酶的活性,促进黄酮类物质的合成和积累[20]。在光照强度减弱的条件下,葡萄[12]、杨梅[14]、苹果[21]等果实中、、和的相对表达量减少,从而导致黄酮类物质的积累量降低。【本研究切入点】刺梨果实主要用于营养及保健食品的加工,其果实中维生素C及黄酮的含量高低一直备受加工企业重视。前期研究发现,不同光照条件下的刺梨果实中维生素C的含量差异极大,在荫蔽条件下的刺梨果实中维生素C含量很低[22],然而光照条件是否对刺梨果实中黄酮类物质的合成积累也产生重要的影响仍不清楚。【拟解决的关键问题】通过对‘贵农5号’刺梨植株树冠进行不同光照强度的遮光处理,探究刺梨果实发育过程中糖和黄酮类物质的积累规律及其与光照强度变化和合成代谢酶活性的相互关联性,旨在为提高刺梨果实品质的生态调控提供科学依据。
1 材料与方法
1.1 试验材料
试验在贵州大学刺梨盆栽场进行。试材为2016年11月栽植于高80 cm、口径80 cm黑色塑料缸中的‘贵农5号’刺梨,每个塑料缸栽1株,苗木为2年生扦插苗,树形为单干圆头形。PAL、C4H、4CL、CHS活性测定试剂盒和总黄酮测定的标准品均由深圳子科生物科技有限公司提供,SS、SPS、Ivr活性测定的试剂盒由北京索莱宝科技有限公司提供。盆栽土壤为耕作土,pH 6.61,有机质含量2.54%,碱解氮118.20 mg×kg-1,速效钾96.32 mg×kg-1,速效磷21.61 mg×kg-1,交换性钙1 065.07 mg×kg-1,交换性镁286.43 mg×kg-1,有效铁7.23mg×kg-1,有效锰13.44 mg×kg-1,有效铜0.81 mg×kg-1,有效锌2.01 mg×kg-1,有效硼0.52 mg×kg-1。
1.2 试验设计
试验设3个不同光照强度的处理,光照强度分别为自然全光照强度减弱20%(R20)、40%(R40)、60%(R60),以自然全光照下的光照强度(R0)为对照(CK)。每个处理1株,重复4次。试验期间,在刺梨果实的幼果期(5月上旬至5月中旬,花后15 d,以S1表示)、缓慢生长期(5月下旬至6月中旬,花后16—46 d,以S2表示)、快速膨大期(6月下旬至7月下旬,花后47—89 d,以S3表示)、成熟期(8月初至8月下旬,花后90—115 d,以S4表示)不同处理和对照(CK)的光照强度平均值见表1。

表1 在刺梨果实不同发育期自然全光照及不同遮光处理的光照强度
1.3 试验方法
1.3.1 遮光处理 2017年2月在每株盆栽试验树上罩上长、宽、高各2.5 m的框架,每个框架间隔2 m,再在框架上用不同透光率的遮阳网罩对试验树进行遮光。于每个月中旬选择晴天的上午10:00时,用SL-HYX型光照强度测定仪测定框架内的光照强度,及时调整遮阳网的密度使框架内的光照强度分别达到不同处理和对照光照强度的要求。试验期间统一正常水肥管理。
1.3.2 取样及样品制备 2018年和2019年,对各处理不同发育时期的果实进行取样。由于不同遮光处理的刺梨果实发育时期比对照都有所推迟,其中,R20、R40和R60处理分别比对照推迟3—4 d、5—7 d和12—15 d;此外,2019年物候期比2018年晚3 d。因此,2018年对照(R0)不同发育时期的果实取样时间为:幼果期在花后第10天,果实缓慢生长期在花后第30天,果实快速膨大期在花后第60天,果实成熟期在花后第105天,当年对R20、R40和R60处理的果实不同发育时期的取样时间分别比R0推迟3、6和13 d。2019年对不同处理的不同发育时期的果实进行取样时,取样时间在2018年的基础上分别再推迟3 d。果实的取样部位在树冠中上部外围4个方向,幼果期和果实缓慢生长期取样时每个植株采果8个,果实快速膨大期和成熟期取样时每个株植采果4个。取样后的样品果分为两份,将一份样品洗净、杀酶后于60℃下烘干,粉碎过60目筛后用于测定可溶性总糖、蔗糖、果糖、葡萄糖和总黄酮含量。另将一份样品用液氮冷冻处理后置于超低温冰箱(-79℃)中保存,用于测定相关酶的活性。
1.3.3 指标测定 试验期间用SL-HYX型光照强度测定仪测定不同处理的光照强度。用烘干称重法测定果实平均单果干物质重。果实中可溶性总糖含量采用蒽酮比色法[23]测定,蔗糖、葡萄糖、果糖含量采用高效液相色谱法[24]测定,检测器为岛津RID-10A示差检测器,色谱柱为YMC-Pack Polyamine II(250 mm×4.6 mm,5 μm),流动相为乙腈﹕水(75﹕25,V﹕V),柱温30℃,检测池温度为35℃,进样量为10 μL,流速1 mL·min-1。果实中总黄酮含量的测定采用硝酸铝显色法[25],SS、SPS和Ivr活性测定分别采用间苯二酚比色法和3, 5-二硝基水杨酸法[26],PAL、C4H、4CL、CHS的活性测定采用酶联免疫法,酶的提取分别参照Brödenfeldt等[27]和范存斐等[28]的方法。
1.4 数据计算及处理
数据为2018年和2019年两年取样测定结果的平均值。每个指标均重复测定4次。果实中蔗糖、果糖、葡萄糖及可溶性总糖和总黄酮积累量以单果干重的mg数表示,计算公式为:果实中相关物质的积累量=单果平均干物质重(g)×果实干物质中相关物质的含量(%)×1000。
在Excel 2003上进行数据统计及作图,用DPS v7.05软件进行显著性分析和相关性测定,多重比较采用Duncan’s新复极差法。
2 结果
2.1 自然全光照(ck)条件下刺梨果实发育过程中可溶性总糖和总黄酮的积累
2.1.1 糖的积累 在ck条件下,刺梨果实中可溶性糖总糖及其中的蔗糖、葡萄糖和果糖的积累量随果实不断发育而逐渐增长,到果实快速膨大期开始迅速大量积累(图1-A、1-B)。在幼果期,果实中可溶性总糖(图1-A)和蔗糖、葡萄糖、果糖(图1-B)的积累量都较低,每个单果(DW)中分别只有85.96、17.13、15.81和18.88 mg;到果实缓慢生长期的积累量增长仍然较缓慢,分别为196.81、39.79、40.06和46.60 mg;此后,果实中糖分开始快速积累,成熟期可溶性总糖和蔗糖的积累量达到最高,分别为1 178.61和435.73 mg,而葡萄糖的积累量以果实快速膨大期为最多。可溶性总糖及其中的蔗糖积累量在果实不同发育期的差异显著(<0.05),果糖积累量在快速膨大期和成熟期的差异不显著。蔗糖是成熟期果实中最多的糖分,在可溶性总糖中的占比达到36.97%。

S1、S2、S3、S4分别幼果期、缓慢生长期、快速膨大期、成熟期。不同小写字母表示差异显著(P<0.05)。下同
2.1.2 黄酮的积累规律 随刺梨果实的不断发育,果实中黄酮类物质积累量不断增加(图2)。在幼果期和果实缓慢生长期,每个果实(DW)总黄酮的积累量分别达到23.83和43.36 mg;果实迅速膨大期,总黄酮积累量达到最多,果实迅速膨大期和成熟期的总黄酮积累量分别达到63.42和65.41 mg,但差异并不显著,说明总黄酮从幼果期就开始快速积累,一直持续到果实快速膨大期,这可能是刺梨果实中黄酮类物质积累规律的表征,而且与幼果期开始果实中合成黄酮的酶活性就已经较高有关。
2.2 光照强度对不同发育期刺梨果实中可溶性总糖和总黄酮积累的影响
2.2.1 对可溶性总糖积累的影响 在刺梨果实的不同发育期,随光照强度的减弱,果实中可溶性总糖的积累量总体表现为明显降低的趋势(图3-A),仅在果实快速膨大期的自然全光照强度(CK)与光照强度减弱20%的可溶性总糖积累量差异不显著;在果实其他发育期,所有光照强度减弱处理的可溶性总糖积累量均显著低于CK(<0.05)。说明刺梨果实在发育过程中糖分的合成需要良好的光照条件,光照强度减弱不利于可溶性总糖的积累。

图2 在自然全光照条件下刺梨果实不同发育期的总黄酮积累量
2.2.2 对蔗糖、葡萄糖及果糖积累的影响 在果实的不同发育时期,蔗糖、葡萄糖及果糖的积累量总体表现为随光照强度的减弱而降低的变化趋势(图3-B—D),但在果实快速膨大期,光照强度减弱20%处理的葡萄糖和果糖积累量比对照的高,而在成熟期,二者之间差异不显著。
2.2.3 对总黄酮积累的影响 光照强度减弱会明显降低刺梨果实总黄酮的积累量。在果实的不同发育期,自然全光照强度下刺梨果实中总黄酮的积累量均为最大(图4),随光照强度减弱,刺梨果实的总黄酮积累量表现出明显的降低趋势。在幼果期、缓慢生长期和快速膨大期,光照强度减弱20%处理的总黄酮积累量降低的幅度与CK差异不显著,但在成熟期的差异达到显著水平(<0.05)。光照强度减弱40%和60%后,不同发育时期果实中的总黄酮积累量均大幅度降低。在果实快速膨大期和成熟期,光照强度减弱20%、40%和60%处理的总黄酮积累量分别比CK降低了3.22%、41.09%、63.07%和10.82%、32.56%、43.78%。以上结果表明,在整个刺梨果实发育过程中,严重减弱光照强度后对果实中黄酮的合成与积累都有极其不利的影响,其中光照强度减弱60%的处理,严重影响缓慢生长期。
2.3 光照强度变化与不同发育期刺梨果实中可溶性糖和总黄酮积累的相关性
2.3.1 光照强度变化与可溶性糖、总黄酮积累的相关性 在刺梨果实不同发育时期,光照强度变化与刺梨果实中蔗糖、葡萄糖、果糖、可溶性总糖、总黄酮的积累量都表现出极显著的正相关,相关系数在0.87—0.98(表2),均达到极显著水平(<0.01)。
2.3.2 总黄酮与可溶性糖积累量的相关性 在刺梨果实不同发育时期及不同光照强度下,果实中总黄酮的积累量与可溶性糖积累量均密切相关。不同发育期,刺梨果实的总黄酮积累量与蔗糖、葡萄糖、果糖及可溶性总糖的积累量均呈正相关(表3),相关系数均达到极显著水平(<0.01),说明糖类物质是黄酮合成的基础底物。

CK、R20、R40和R60分别代表自然全光照强度(对照)、光照强度减弱20%、40%、60%。不同小写字母表示相同发育时期不同处理间在0.05水平上的显著性差异,括号内不同小写字母表示相同处理不同发育期在0.05水平上的显著性差异。下同

图4 光照强度减弱对不同发育期刺梨果实中总黄酮积累的影响
2.4 光照强度减弱对不同发育期刺梨果实中糖和黄酮类化合物合成相关酶活性的影响
2.4.1 对果实中可溶性糖合成相关酶活性的影响 在不同发育期的刺梨果实中,与蔗糖合成相关的SS和SPS的活性均随光照强度的减弱而降低,不同处理间均有显著差异(<0.05)(表4)。与果糖、葡萄糖合成密切相关的Ivr活性,虽然在不同发育时期也表现出随光照强度减弱而降低的趋势,但在果实发育过程中,自然全光照强度下(CK)与R20处理的Ivr活性均无显著差异;而在刺梨果实进入到快速膨大期和成熟期,光照强度减弱至自然全光照强度(CK)的40%(R40)和60%(R60)的Ivr活性显著低于CK和R20处理。由此可见,在光照强度稍有减弱的条件下,对整个刺梨果实发育过程中Ivr活性的影响不明显,刺梨果实中Ivr对光照强度减弱的敏感性不如SS和SPS。从表4还可看出,无论在自然全光照和光照强度减弱的条件下,刺梨果实中SS和SPS的活性均明显表现出随果实发育时期的增长而增强的趋势,而Ivr的活性则表现出随果实发育时期的增长而减弱的趋势,这种变化趋势与果实发育后期蔗糖大量积累而葡萄糖及果糖积累较少相吻合,这是蔗糖积累型果实的重要生理表征。
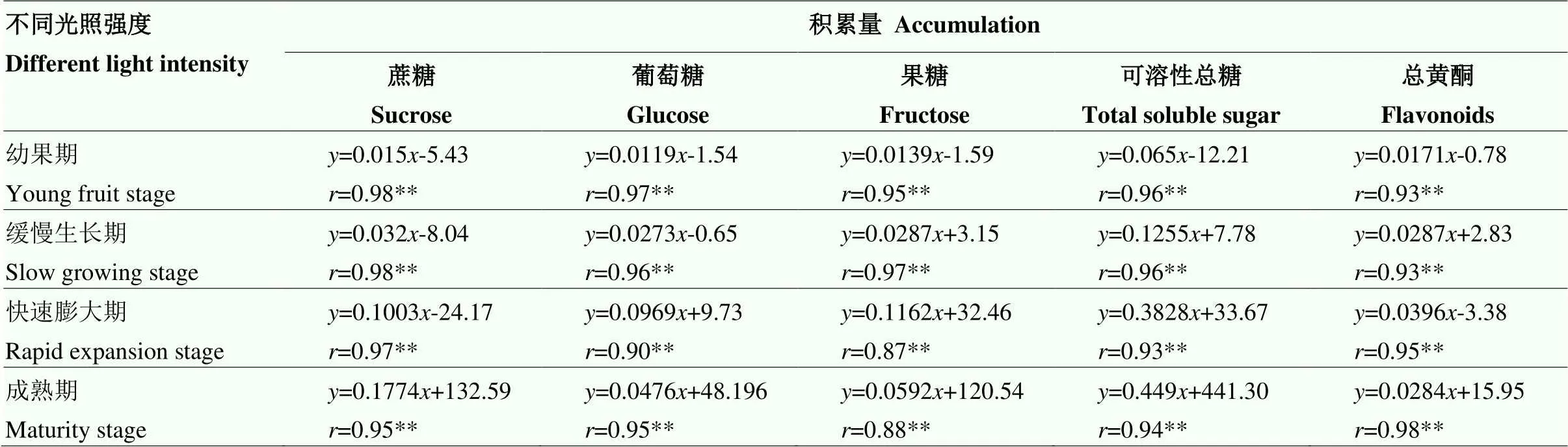
表2 不同光照强度与不同发育期刺梨果实中可溶性总糖、蔗糖、葡萄糖、果糖和总黄酮积累量的相关性
**表示相关系数达到极显著水平(<0.01)。下同 ** indicate the correlation coefficient at 0.01 significant levels. The same as below

表3 不同光照强度条件下刺梨果实发育过程中总黄酮积累量与蔗糖、葡萄糖、果糖及可溶性总糖积累量的相关性

表4 不同光照强度对不同发育期刺梨果实中可溶性糖合成相关代谢酶活性的影响
同列不同小写字母表示相同发育期不同处理间的差异显著(<0.05),同行不同大写字母表示相同处理不同发育期之间的差异显著(<0.05)。下同
Different small letters in the same column indicate significant difference at 0.05 level in different treatments of the same development stage, and different capital letter of the same row indicated significant difference at 0.05 level in different development stages of the same treatment. The same as below
2.4.2 对果实中黄酮类物质合成关键酶活性的影响 在刺梨果实发育过程中,果实中PAL、C4H、4CL和CHS的活性随光照强度减弱表现出明显的降低趋势(表5)。在黄酮类化合物合成的初始过程中,PAL是将初始物质苯丙氨酸转化为肉桂酸的关键酶。从表5看出,果实中PAL活性随光照强度的减弱而明显降低,不同处理间的差异均达到显著水平(<0.05),说明光照强度减弱会抑制黄酮类化合物合成的初始物质苯丙氨酸转化为肉桂酸。C4H是调控合成黄酮类物质的中间产物P-香豆酸的关键酶,虽然不同发育期果实中C4H的活性总体表现出随光照强度减弱而降低的趋势(表5),但在不同发育期这种趋势仍然有一些差异。在刺梨果实成熟期,C4H的活性随光照强度减弱而明显降低,不同处理间的差异均达到显著水平(<0.05)。而在幼果期和果实快速膨大期,C4H的活性在R40与R60处理间差异不显著,但它们明显低于R0(CK)和R20处理,说明光照强度减弱至自然全光照强度的40%以下之后,对这两个时期果实中C4H活性进一步减弱的影响差异不明显。在刺梨果实缓慢生长期,果实中的C4H活性在R0(CK)与R20处理间的差异不显著。4CL的作用是催化P-香豆酸与辅酶A结合生成对香豆酰辅酶A,这一过程直接影响查尔酮的合成。从表5看出,在刺梨果实发育过程中,4CL的活性随光照强度减弱而明显降低,其中,在缓慢生长期,不同处理间的4CL活性差异显著,但幼果期R20与R40处理、快速膨大期R40与R60处理和成熟期CK与R20处理间的差异不显著。在黄酮类化合物合成过程中,CHS催化合成查尔酮,再由其衍生转化为多种类黄酮物质。由表5可见,光照强度减弱能明显降低不同发育期刺梨果实中的CHS活性,但是幼果期R40与R60处理、缓慢生长期和成熟期R20与R40处理、快速膨大期CK与R20处理间,CHS活性的差异也不显著。

表5 不同光照强度对不同发育期刺梨果实中黄酮类化合物关键合成酶活性的影响
从表5还可看出,不同光照强度下PAL的活性都以果实成熟期最高,CHS的活性则在幼果期最高。而自然全光照强度下,C4H的活性以幼果期较弱,4CL的活性在果实缓慢生长期最高,但在光照强度减弱的条件下,缓慢生长期的果实中C4H和4CL活性高于其他发育时期。以上结果表明,不同光照强度对不同发育期刺梨果实中的黄酮类物质合成代谢过程具有明显的差异性影响。
2.5 光照强度变化与不同发育期刺梨果实中可溶性糖合成、转化酶和黄酮合成关键酶活性的关联性
2.5.1 与不同发育期刺梨果实中可溶性糖合成、转化相关酶活性的相关性 在刺梨果实的不同发育期,光照强度变化与SS、SPS和IVR的活性变化均呈显著或极显著正相关(表6),除果实成熟期的光照强度变化与IVR活性变化的相关系数达到显著水平外,其他的相关系数均达到极显著水平(<0.01),说明光照强度变化与果实中SS、SPS和IVR的活性密切关联,并对刺梨果实中可溶性糖的合成及转化过程有着重要的生理影响。因此,光照强度减弱不利于刺梨果实中蔗糖、葡萄糖和果糖的合成与积累。
2.5.2 与不同发育期刺梨果实中黄酮合成关键酶活性的相关性 在刺梨果实的不同发育期,光照强度变化与果实中黄酮类物质合成的PAL、C4H、4CL和CHS活性均表现出极显著的正相关(<0.01)(表7),说明光照强度与果实中合成黄酮类物质的上述4种关键酶活性密切关联。因此,光照强度减弱不利于刺梨果实中黄酮类物质的合成与积累。

表6 光照强度变化与不同发育期刺梨果实中蔗糖合成酶、蔗糖磷酸合成酶和转化酶活性的相关性
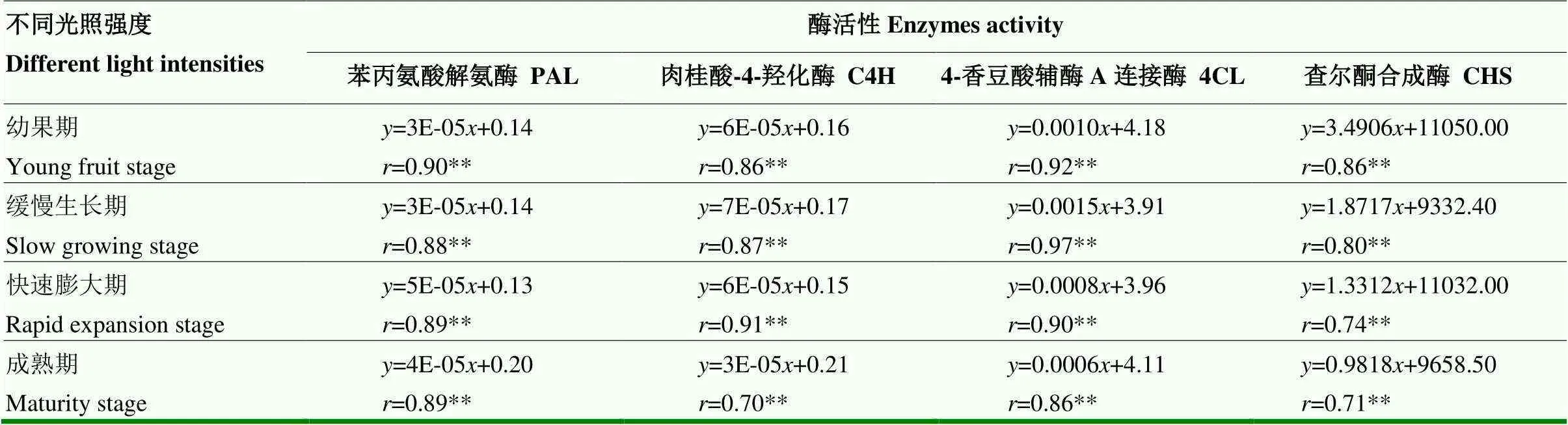
表7 光照强度变化与不同发育期刺梨果实中PAL、C4H、4CL及CHS活性的相关性
3 讨论
3.1 刺梨果实中糖和总黄酮的积累规律及其关联性
蔗糖、葡萄糖、果糖是果实中主要的糖组分,不同果实中糖分组成及积累有较大差异[29-30]。根据果实成熟时所积累的主要糖的含量,可将果实分为淀粉转化型(猕猴桃、香蕉、芒果等)、蔗糖积累型(柑橘、杏、桃等)和己糖积累型(葡萄、苹果、枸杞等)[31]。在幼果期,刺梨果实中蔗糖、葡萄糖和果糖的积累量差异不明显,但从果实缓慢生长期开始,各自的积累量迅速增长,其中,蔗糖到成熟期的积累量占可溶性总糖的比例高达36.99%,而葡萄糖和果糖分别仅占10.50%和18.18%,在刺梨果实发育过程中,无论光照强度如何变化,刺梨果实中蔗糖、葡萄糖、果糖的积累量与总黄酮的积累量均呈极显著正相关。幼果期和缓慢生长期,蔗糖、葡萄糖、果糖的积累量不多,这除了与果实生长发育的组织构建对糖的消耗有关外,可能还与果实中黄酮类物质快速合成对糖的消耗有关。
3.2 光照强度变化对刺梨果实中糖分积累的生理影响
在刺梨果实发育进程中,无论在何种光照强度下,果实中SS和SPS活性均表现出不断增强的趋势,在成熟期的活性达到最高,而IVR的活性变化正好相反。由此可见,这种变化趋势并不会因光照强度的变化而改变,说明SS和SPS在果实蔗糖的积累过程中具有主导作用,其中SPS对蔗糖积累的贡献最大。
光照条件还影响果实中糖的合成与转化。在糖的合成、转化和积累过程中,SS、SPS和IVR扮演着极其重要的角色,其中,SS催化蔗糖的代谢是可逆的,即蔗糖+UDP←→UDP-葡萄糖+果糖,SPS则是催化蔗糖的合成,IVR是将蔗糖水解为葡萄糖和果糖[32-33]。在光照强度减弱的情况下,刺梨果实中SS、SPS和IVR的活性降低,且光照强度变化与SS、SPS和IVR的活性和糖的积累量都表现出极显著正相关,说明光照减弱导致果实中糖合成转化的关键酶活性降低后,对糖的积累量产生了极其不利的生理影响,这种结果在梨[7]、杨梅[34]和厚皮甜瓜[6,35]等果实上也有类似的报道。已有研究发现,光照条件能够影响果实中糖合成代谢关键酶基因的表达,对甜瓜果实延长光照后,能够诱导的表达从而增加SPS的活性[36]。对梨果实进行套袋遮光处理后,果实中和的相对表达量降低了,果实中的SPS和IVR活性及糖的积累量也相应降低[37],说明光照对果实糖合成积累的影响与相关酶基因的表达水平及酶活性密切相关。刺梨果实糖的合成积累与相关酶基因表达的联系有待进一步研究。
3.3 光照强度变化对刺梨果实中黄酮积累的生理影响
植物体内的黄酮类物质合成代谢过程极其复杂,光对黄酮类物质合成代谢的影响主要是光照对苯丙烷合成途径中、、、等关键酶基因表达的调控[16],、、和的基因表达量及酶活性增强为黄酮类物质合成的下游反应提供充足的底物,从而对黄酮类化合物的合成产生影响[38-39]。遮阴条件下,茶树新梢中的和表达量降低,减少茶叶中总黄酮的含量[19,40],相似的研究结果在葡萄[41-42]和银杏[43]中也有报道。苹果中的PAL活性也受光的诱导[44],光照强度减弱能够降低苹果中PAL的活性[45],没有进行套袋遮光处理的酥梨果实中,PAL的活性也比套袋遮光处理的果实高[46]。在本研究中,光照强度减弱不仅使刺梨果实中合成黄酮类化合物的糖类基础物质减少,同时使PAL、C4H、4CL、CHS的活性明显减弱,导致总黄酮积累量降低。因此,建议在生产上选择光照良好的区域进行刺梨栽培,并通过合理密植改善光照条件,从而增加果实中的糖,以促进刺梨果实中黄酮的合成。
4 结论
刺梨果实属于蔗糖积累型,果实中糖的积累量与总黄酮的积累量密切相关。果实缓慢生长期之后,可溶性总糖和其中的蔗糖开始快速积累,果实中总黄酮的积累量从幼果期开始迅速增长,一直持续到果实快速膨大期。在刺梨果实的生长发育过程中,果实中糖分和总黄酮的积累量以及SS、SPS、IVR、PAL、C4H、4CL、CHS的活性均与光照强度变化表现出显著或极显著的正相关。光照强度减弱会明显抑制SS、SPS、Ivr、PAL、C4H、4CL、CHS的活性,不利于刺梨果实中糖和黄酮类物质的合成积累。在生产中可以通过改善光照条件,以增加刺梨果实中糖和黄酮类物质的含量,提高刺梨果实的品质。
[1] 秦孟根, 舒伟. 刺梨总黄酮的含量测定. 中草药, 1999(2): 106-107.
Qin M G, shu W. determination of total flavonoids in fruit ofTratt. chinese Traditional and Herbal Drugs, 1999(2): 106-107. (in Chinese)
[2] 杜薇, 刘国文. 刺梨总黄酮的含量测定及资源利用. 食品科学, 2003(1): 112-114.
DU W, LIU G W. Determination of content of total flavonoids in Cili and resources development prospect. Food Science, 2003(1): 112-114. (in Chinese)
[3] 杜薇. 不同采收期刺梨黄酮含量的影响. 中国中药杂志, 2002, 27(5): 379-380.
DU W. Effects on flavonoids content ofTratt.at different harvesting stages. China Journal of Chinese Materia Medica, 2002, 27(5): 379-380. (in Chinese)
[4] 王慧, 杜薇. 贵州不同产地刺梨总黄酮的含量分析. 微量元素与健康研究, 2007, 24(6): 22-23.
WANG H, DU W. Content analysis of total flavonoids in fruit ofTratt.from different producing areas in guizhou. Studies of Trace Elements and Health, 2007, 24(6): 22-23. (in Chinese)
[5] 程水源, 顾曼如, 束怀瑞. 银杏叶黄酮研究进展. 林业科学, 2000, 36(6): 110-115.
CHENG S Y, GU M R, SHU H R. Advances in research on flavonoids inleaf. Scientia Silvae Sinicae, 2000, 36(6): 110-115. (in Chinese)
[6] 安翠香, 张玉鑫, 杨世梅, 陈年来. 遮阴对甜瓜果实蔗糖积累及其代谢酶活性的影响. 西北农林科技大学学报(自然科学版), 2011, 39(9): 167-173.
AN C X, ZHANG Y X,YANG S M, CHEN L N. Effects of light intensity on sucrose accumulation and sucrose-metabolizing enzymea ctivities of melon fruit. Journal of Northwest A&F University (Natural Science Edition), 2011, 39(9): 167-173. (in Chinese)
[7] 杨绍兰, 王玫, 张晓菲, 王成荣, 王然. 套袋对‘茌梨’果实蔗糖代谢及相关酶基因表达的影响. 园艺学报, 2013(10): 1887-1896.
YANG S L, WANG M, ZHANG X F, WANG C R, WANG R. Effects of bagging treatment on sugar metabolism and related gene expression in‘Chili pear fruits. Acta Horticulturae Sinica, 2013(10): 1887-1896. (in Chinese)
[8] 刘敏, 成正龙, 张晋升, 鞠延仑, 房玉林, 孟江飞, 张振文. 遮阳网对酿酒葡萄果实及葡萄酒品质的影响. 西北植物学报, 2017, 37(9): 1764-1772.
LIU M, CHENG Z L, ZHANG J S, JU Y L, FANG Y L, MENG J F, ZHANG Z W. Influence of shading net on qualities of cabernet sauvignon and Syrah berries and wines. Acta Botanica Boreali- Occidentalia Sinica, 2017, 37(9): 1764-1772. (in Chinese)
[9] 闫静, 王德炉, 郝家孝, 谢双喜. 光照强度对贵州兔眼蓝莓果实品质的影响. 经济林研究, 2017, 35(4): 118-123.
YAN J, WANG D L, HAO J X, XIE S X. Effects of light intensity on fruit quality of rabbiteye blueberry in Guizhou. Nonwood Forest Research, 2017, 35(4): 118-123. (in Chinese)
[10] 徐友, 王欢利, 汪贵斌, 曹福亮. 温度和光照强度对银杏叶黄酮合成的影响. 中南林业科技大学学报, 2016, 36(4): 30-34.
Xu Y, Wang H l, Wang G b, Cao F l.Effects of temperature and light intensity on flavonoid biosynthesis of ginkgo (L.) leaves.Journal of Central South University of Forestry & Technology, 2016, 36(4): 30-34. (in Chinese)
[11] 陆胜波, 陈静, 张文娥, 潘学军. 遮光对铁核桃青皮多酚物质及相关酶活性和基因表达的影响. 植物生理学报, 2020, 56(6): 1231-1242.
LU S B, CHEN J, ZHANG W E, PAN X J. Effect of shading on polyphenols, related enzyme activity and gene expression in green husk of. Plant Physiology Communications, 2020, 56(6): 1231-1242. (in Chinese)
[12] Spayd S E, Tarara J M, Mee D L, Ferguson J C. Separation of sunlight and temperature effects on the composition ofcv. Merlot berries. American Journal of Enology and Viticulture, 2002, 53(3): 171-182.
[13] 周君, 陈宗玲, 张琼, 王红清. 套袋对桃果实成熟过程中酚酸类和类黄酮类物质积累的影响. 园艺学报, 2009, 36(12): 1717-1724.
ZHOU J, CHEN Z L, ZHANG Q, WANG H Q. Effects of bagging on accumulation of phenolic acids and flavonoids it peach pericarp during fruit maturity. Acta Horticulturae Sinica, 2009, 36(12): 1717-1724. (in Chinese)
[14] 杨蓓芬, 李钧敏. 东魁杨梅叶片次生代谢产物对光照与水分胁迫的响应. 河南农业科学, 2011, 40(7): 118-122.
YANG B F, LI J M. Responses of the secondary metabolites contents in the leaves ofcv.Dongkui to light and water stress. Journal of Henan Agricultural Sciences, 2011, 40(7): 118-122. (in Chinese)
[15] Winkel-Shirley B. Biosynthesis of flavonoids and effects of stress. Current Opinion Plant Biology, 2002, 5(3): 218-223.
[16] 潘俊倩, 佟曦然, 郭宝林. 光对植物黄酮类化合物的影响研究进展. 中国中药杂志, 2016, 41(21): 3897-3903.
PAN J Q, TONG X R, GUO B L. Progress of effects of light on plant flavonoids. China Journal of Chinese Materia Medica, 2016, 41(21): 3897-3903. (in Chinese)
[17] WHETTEN R, SEDEROFF R. Lignin biosynthesis. The Plant Cell, 1995, 7(7): 1001-1013.
[18] Duthie G, Crozier A. Plant-derived phenolic antioxidants.Current Opinion in Lipidology, 2000, 3(6): 447-450.
[19] WANG Y S, GAO L P, SHAN Y, LIU Y J, TIAN Y W, XIA T. Influence of shade on flavonoid biosynthesis in tea ((L.) O. Kuntze). Scientia Horticulturae, 2012, 141: 7-16.
[20] 王峰, 王秀杰, 赵胜男, 闫家榕, 卜鑫, 张颖, 刘玉凤, 许涛, 齐明芳, 齐红岩, 李天来. 光对园艺植物花青素生物合成的调控作用. 中国农业科学, 2020(23): 4904-4917.
WANG F, WANG X J, ZHAO S N, YAN J R, BU X, ZHANG Y, LIU Y F, XU T, QI M F, QI H Y, LI T L. Light regulation of anthocyanin biosynthesis in horticultural crops. Scientia Agricultura Sinica, 2020, 53(23): 4904-4917. (in Chinese)
[21] FENG F J, LI M J, MA F W, CHENG L L. Phenylpropanoid metabolites and expression of key genes involved in anthocyanin biosynthesis in the shaded peel of apple fruit in response to Sun exposure. Plant Physiology and Biochemistry, 2013, 69: 54-61.
[22] 何春丽, 樊卫国. 遮光对刺梨果实和叶片中维生素C与糖含量以及相关酶活性的影响. 西北植物学报, 2020, 40(12): 2081-2092.
HE C L, FAN W G. Effects of shading on vitamin C and sugar contents and related enzymes activities in fruits and leaves of. Acta Botanica Boreali-Occidentalia Sinica, 2020, 40(12): 2081-2092. (in Chinese)
[23] 王学奎. 植物生理生化实验原理和技术. 2版. 北京: 高等教育出版社, 2006.
WANG X K. Principles and Techniques of Plant Physiological and Biochemical Experiments. 2nd ed. Beijing: Higher Education Press, 2006. (in Chinese)
[24] 杜改改, 李泰山, 刁松锋, 张嘉嘉, 傅建敏, 李芳东, 杨绍彬. 6个杏李品种果实甜酸风味品质分析. 果树学报, 2017, 34(1): 41-49.
DU G G, LI T S, DIAO S F, ZHANG J J, FU J M, LI F D, YANG S B. Evaluation of flavor quality in relation to sugars and acids of six×cultivars. Journal of Fruit Science, 2017, 34(1): 41-49. (in Chinese)
[25] 罗锋, 汪河滨, 杨玲, 周忠波. 超声-微波协同萃取法提取甘草黄酮的研究. 食品研究与开发, 2006, 27(8): 127-128.
LUO F, WANG H B, YANG L, ZHOU Z B. Studying on ultrasonic-microwave synergistic extraction flavonoids of. Food Research and Development, 2006, 27(8): 127-128. (in Chinese)
[26] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006.
GAO J F. Experimental Guidance for Plant Physiology. Beijing: Higher Education Press, 2006. (in Chinese)
[27] Brödenfeldt R, MOHR H. Use of immunotitration to demonstrate phytochrome-mediated synthesisof chalcone synthase and phenylalanine ammonia lyase in mustard seedling cotyledons. Zeitschrift fur Naturforschung, 1986, 41: 61-68.
[28] 范存斐, 毕阳, 王云飞, 任亚琳, 杨志敏, 王毅. 水杨酸对厚皮甜瓜采后病害及苯丙烷代谢的影响. 中国农业科学, 2012, 45(3): 584-589.
FAN C F, BI Y, WANG Y F, REN Y L, YANG Z M, WANG Y. Effect of salicylic acid dipping on postharvest diseases and phenylpropanoid pathway in muskmelon fruits. Scientia Agricultura Sinica, 2012, 45(3): 584-589. (in Chinese)
[29] 吕英民, 张大鹏. 果实发育过程中糖的积累. 植物生理学通讯, 2000, 36(3): 258-265.
LÜ Y M, ZHANG D P. Accumulation of sugars in developing fruits. Plant Physiology Communications, 2000, 36(3): 258-265. (in Chinese)
[30] 罗霄, 郑国琦, 王俊. 果实糖代谢及其影响因素的研究进展. 农业科学研究, 2008, 29(2): 69-74.
LUO X, ZHENG G Q, WANG J. Advances in research on sugar metabolism and its influencing factor in fruits. Journal of Agricultural Sciences, 2008, 29(2): 69-74. (in Chinese)
[31] 闫梅玲, 王振平, 范永, 周明, 孙盼, 单守明, 代红军. 蔗糖代谢相关酶在赤霞珠葡萄果实糖积累中的作用. 果树学报, 2010, 27(5): 703-707.
YAN M L, WANG Z P, FAN Y, ZHOU M, SUN P, SHAN S M, DAI H J. Roles of sucrose-metabolizing enzymes in accumulation of sugars in Cabernet Sauvignon grape fruit. Journal of Fruit Science, 2010, 27(5): 703-707. (in Chinese)
[32] 陈俊伟, 张良诚, 张上隆. 果实中的糖分积累机理. 植物生理学通讯, 2000, 36(6): 497-503.
CHEN J W, ZHANG L C, ZHANG S L. Sugar accumulation mechanism in fruits. Plant Physiology Communications, 2000, 36(6): 497-503. (in Chinese)
[33] 秦巧平, 张上隆, 谢鸣, 陈俊伟. 果实糖含量及成分调控的分子生物学研究进展. 果树学报, 2005, 22(5): 519-525.
QIN Q P, ZHANG S L, XIE M, CHEN J W. Progress on the research of the molecular regulation of sugar content and composition in fruit. Journal of Fruit Science, 2005, 22(5): 519-525. (in Chinese)
[34] Shi L Y, Cao S F, Shao J R, Chen W, Yang Z F, Zheng Y H.Chinese bayberry fruit treated with blue light after harvest exhibit enhanced sugar production and expression of cryptochrome genes. Postharvest Biology & Technology, 2016, 111:197-204.
[35] 任雷, 胡晓辉, 杨振超, 邹志荣, 李鹏飞. 光照强度对厚皮甜瓜糖分积累与蔗糖代谢相关酶的影响. 西北农林科技大学学报(自然科学版), 2010, 38(6): 120-126.
REN L, HU X H, YANG Z C, ZOU Z R, LI P F. Effects of light intensity on sugar accumulation and sucrose-metabolizing enzymes in muskmelon. Journal of Northwest A & F University (Natural Science Edition), 2010, 38(6): 120-126. (in Chinese)
[36] Yang L Y, Chen J J, Sun X M, Li J X, Chen N L. Inhibition of sucrose and galactosyl-sucrose oligosaccharide metabolism in leaves and fruits of melon (L.) under low light stress. Scientia Horticulturae, 2019, 244: 343-351.
[37] ROY CHOUDHURY S, ROY S, DAS R, SENGUPTA D N. Differential transcriptional regulation of banana sucrose phosphate synthase gene in response to ethylene, auxin, wounding, low temperature and different photoperiods during fruit ripening and functional analysis of banana SPS gene promoter. Planta, 2008, 229(1): 207.
[38] KOYAMA K, IKEDA H, POUDEL P R, GOTO-YAMAMOTO N. Light quality affects flavonoid biosynthesis in young berries of Cabernet Sauvignon grape. Phytochemistry, 2012, 78: 54-64.
[39] ZORATTI L, KARPPINEN K, LUENGO ESCOBAR A, HÄGGMAN H, JAAKOLA L. Light-controlled flavonoid biosynthesis in fruits. Frontiers in Plant Science, 2014, 5: 534.
[40] Takeuchi A, Matsumoto S, Hayatsu M. Effects of shading treatment on the expression of the genes for chalcone synthase and phenylalanine ammonia-lyase in tea plant (). Bulletin of the National Research Institute of Vegetables Ornamental Plants & Tea, 1995, 8: 1-9.
[41] MATUS J T, LOYOLA R, VEGA A, PEÑA-NEIRA A, BORDEU E, ARCE-JOHNSON P, ALCALDE J A. Post-veraison sunlight exposure induces MYB-mediated transcriptional regulation of anthocyanin and flavonol synthesis in berry skins of. Journal of Experimental Botany, 2009, 60(3): 853-867.
[42] AZUMA A, YAKUSHIJI H, KOSHITA Y, KOBAYASHI S. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions. Planta, 2012, 236(4): 1067-1080.
[43] XU Y, WANG G B, CAO F L, ZHU C C, WANG G Y, EL-KASSABY Y A. Light intensity affects the growth and flavonol biosynthesis of(L.). New Forests, 2014, 45(6): 765-776.
[44] Bakhshi D, Arakawa O. Induction of phenolic compounds biosynthesis with light irradiation in the flesh of red and yellow apples. Journal of Applied Horticulture,2006, 8(2): 101-104.
[45] Wang H Q, ARAKAWA O, MOTOMURA Y. Influence of maturity and bagging on the relationship between anthocyanin accumulation and phenylalanine ammonialyase (PAL) activity in ‘Jonathan’ apples. Postharvest Biology & Technology, 2000, 19(2): 123-128.
[46] 王斌, 张楠, 闫冲冲, 金青, 林毅, 蔡永萍, 张金云. 套袋对砀山酥梨果实石细胞发育及木质素代谢的影响. 园艺学报, 2013, 40(3): 531-539.
Wang B, Zhang N, Yan C c, Jin Q, Lin Y, Cai Y p, Zhang J y.Bagging for the development of stone cell and metabolism of lignin in‘Dangshan Suli’. Acta Horticulturae Sinica, 2013, 40(03):531-539. (in Chinese)
Accumulation of Sugar and Flavonoids as Well as Their Association with Changes of Light Intensity During Fruit Development of
FAN WeiGuo, pan xueJun, HE ChunLi, chenhong, zhouyuJia
Guizhou University/Engineering Technology Research Centre for Rosa Roxburghii of National Forestry andGrassland Adminstration, Guiyang 550025
【Objective】The accumulation of sugar and total flavonoids and their association with changes of light intensity during fruits development ofTratt. were studied, so as to provide a scientific basis for the fruit quality control of. 【Method】 Four-year-old‘Guinong 5’fruit-bearing trees ofwas used as the material in the experiment, the natural light intensity was used as control (R0, CK), and three treatments were set up with the light intensity reduced by 20% (R20), 40% (R40) and 60% (R60), respectively. The accumulations of soluble sugar and total flavonoids as well as activities of related anabolic enzymes in fruits were analyzed, and the relationship between them and light intensity was determined.【Result】Sugar and total flavonoids were accumulated continuously during the growth and development offruit, but their accumulation of different development periods had significant differences. The sugar in fruits began to accumulate rapidly after the slow growth stage, and the accumulation of total soluble sugar and sucrose reached the highest at maturity stage, in which the accumulation of sucrose accounted for 36.97% of the total soluble sugar. The accumulation of glucose and fructose in the rapid expansion period was the largest, but only accounted for 10.50% and 18.18% of the maximum accumulation of total soluble sugar at fruit maturity stage, respectively.fruit was sucrose accumulation type. The total flavonoids in fruits were rapidly accumulated from young fruit stage to rapid fruit expansion stage, and then the accumulation of total flavonoids did not increase significantly. During the development offruit, the accumulation of sugar and total flavonoids under different light intensities was significantly different, while the decrease of light intensity was not conducive to the accumulation of sugar and total flavonoids in fruits. Sucrose synthase (SS), sucrose phosphate synthase (SPS), invertase (IVR) were the key enzymes affecting the metabolism of sugar in fruit. Alanine ammonia lyase (PAL), cinnamic acid-4-hydroxylase (C4H), 4-coumaric acid coenzyme A ligase (4CL) and chalcone synthase (CHS) were the key enzymes affecting the metabolism of flavonoids in fruit. The changes of light intensity were closely related to the accumulation of sugar, total flavonoids and the activities of related anabolic enzymes in fruits, while the activities of SS, SPS, IVR, PAL, C4H, 4CL and CHS were significantly inhibited by the decrease of light intensity. SS and SPS were sensitive to the decrease of light intensity during the whole fruit development of. There was a significant positive correlation between sugar and total flavonoids accumulation in fruits, while the accumulation of sugar and total flavonoids and the activities of SS, SPS, IVR, PAL, C4H, 4CL and CHS were significantly or extremely significantly positively correlated with the changes of light intensity.【Conclusion】fruit were sucrose accumulation type, and the sugar in fruits began to accumulate rapidly after the slow growth stage, while the total flavonoids in fruits were rapidly accumulated from young fruit stage to rapid fruit expansion stage. The decrease of light intensity was not conducive to the accumulation of sugar and flavonoids in fruits. The contents of sugar and flavonoids in fruits could be increased by improving light conditions in production, which was conducive to improving the quality offruit.
; fruit; light intensity; sugar; total flavonoids

2021-02-25;
2021-06-28
国家林业和草原局林业科技创新平台建设(2019133002)、国家重点研发计划(2014BAD23B03)
通信作者樊卫国,E-mail:wgfan@gzu.edu.cn
(责任编辑 赵伶俐)
