苹果转录因子MdWRKY40b抗白粉病的机理
2022-01-17沙仁和兰黎明王三红罗昌国
沙仁和,兰黎明,王三红,罗昌国
苹果转录因子MdWRKY40b抗白粉病的机理
沙仁和1,兰黎明1,王三红1,罗昌国2
1南京农业大学园艺学院,南京 210095;2贵州省农业科学院果树科学研究所,贵阳 550006
【目的】探究苹果白粉病相关基因调控苹果抗白粉病的机理,为苹果白粉病的抗性育种提供理论依据。【方法】以苹果品种‘嘎拉’叶片为材料提取总RNA,并以cDNA为模板克隆552 bp特异性片段,采用Gateway技术将该基因片段的正反向序列构建入RNAi表达载体pB7GWIWG2(Ⅱ)中,然后利用农杆菌介导法对苹果叶片进行转化获得转基因植株,苹果叶片选用组培苗茎尖处幼嫩叶片;利用RT-qPCR技术对转基因植株中、超氧化物歧化酶基因()过氧化氢酶基因()、过氧化物酶基因()以及-1,3-葡聚糖酶基因()的表达量进行分析;进一步以1年生植株为材料,通过白粉病菌()接种试验,分析转基因植株对白粉病的抗病性;然后以接种白粉病菌后0、5、10、15、20 d的转基因植株及其对照植株叶片为材料,进行氯化硝基四氮唑蓝液(NBT)和二氨基联苯胺法(DAB)染色来分析病菌侵染期间植物材料中超氧阴离子和过氧化氢的积累量,进一步对病菌侵染期间植株中SOD、POD、CAT和-1,3-葡聚糖酶等酶活性进行测定。【结果】经过PCR检测,确定获得3个基因沉默株系,分别为RNAi-1、RNAi-2和RNAi-3;RT-qPCR结果显示3个转基因株系基因沉默效率分别为95.2%、92.2%、79.8%,转基因植株中、的表达量相较野生型显著上调;人工接种白粉病菌后发现,与野生型植株相比,转基因植株叶片中的粉状病斑显著减少,超氧阴离子和过氧化氢的积累量显著降低,SOD、CAT、POD等调节植物超氧阴离子代谢的抗氧化酶以及抗病相关的-1,3-葡聚糖酶的活性显著增强。【结论】的沉默使得苹果植株对白粉病的抗病性增强,推测转基因植株中、的上调表达提高了苹果植株对白粉病的基础抗性,导致植物对超氧阴离子的清除能力增加,维持了植物体在响应病菌侵染过程中的低浓度超氧阴离子含量,从而减少高浓度超氧阴离子对植物的损伤。
苹果;白粉病;;转基因;活性氧;抗氧化酶
0 引言
【研究意义】苹果白粉病的病原为白叉丝单囊壳(),属于子囊菌门叉丝单囊壳属,是一种专性寄生型真菌[1]。苹果白粉病主要危害苹果叶片、嫩枝、花器和幼果,发病严重时造成果树叶片脱落,新梢枯死,花器受害,幼果脱落等,在中国苹果栽培区域均有发生,严重危害苹果产业的发展[2]。白粉病抗性育种是防治白粉病的有效手段之一,而抗性基因的挖掘则为抗性育种提供重要依据。WRKY转录因子参与了植物对生物、非生物胁迫的响应[3],可作为抗性基因进行研究。因此,探究调控苹果抗白粉病的机理,对白粉病抗性育种具有重要意义。【前人研究进展】植物的WRKY转录因子是1994年被发现并且命名的[4],保守的WRKY结构域包含约60个氨基酸残基[5],WRKY转录因子通过结合特定的DNA序列来激活或抑制多个靶基因的转录[6]。Eckey等[7]在小麦研究中发现,WRKY转录因子与小麦白粉病抗性之间存在联系;MENG等[8]研究发现,大麦转录因子HvWRKY10、HvWRKY19和HvWRKY28调节增强大麦对白粉病的免疫和基础防御。近年来,Wang等在对葡萄抗真菌病害的研究中发现,葡萄转录因子VqWRKY52和VlWRKY48在拟南芥中的异源表达均提高了其对白粉病的抗病性[9-10];Wei等[11]研究发现,二倍体森林草莓中WRKY转录因子FvWRKY42在拟南芥中的异源表达同样增强了拟南芥对白粉病的抗性。【本研究切入点】大麦、编码的蛋白通过与编码的蛋白互作来调控大麦对白粉病的抗性[12],值得注意的是,这两个大麦基因分别与拟南芥的、基因同源。Pandey等证实了拟南芥、参与拟南芥对白粉病抗性的调控[13-14]。在之前的研究中,以苹果品种‘富士’为材料,克隆了并发现该基因与拟南芥同源,受白粉病菌侵染的强烈诱导[15]。【拟解决的关键问题】以苹果品种‘嘎拉’为材料,利用RNAi技术沉默,并分析相关抗病基因的表达,在接种白粉病菌的条件下,观察转基因植株的抗病性,检测转基因植株中活性氧(ROS)的积累量及抗氧化酶活性,探究调控苹果抗白粉病的机理。
1 材料与方法
试验于2017年6月至2020年6月在南京农业大学园艺学院果树分子生物技术实验室完成。
1.1 材料
‘嘎拉’组培苗由沈阳农业大学张志宏教授惠赠,现保存于本实验室。白粉病菌新鲜孢子采自本实验室苹果温室中感病苹果叶片。
克隆载体pMD19-T购自TaKaRa公司;pENTR/ D-TOPO入门载体购自Invitrogen公司;植物表达载体pB7GWIWG2(Ⅱ)由国家大豆改良中心实验室惠赠;DH5大肠杆菌感受态及EHA105农杆菌感受态购自上海唯地生物技术有限公司。
1.2 方法
1.2.1 基因克隆及载体构建 取‘嘎拉’叶片,参照RNAprep Pure Plant Plus Kit说明书(TIANGEN)方法提取RNA,参照PrimeScript RT reagent Kit with gDNA Eraser试剂盒(TaKaRa)说明书方法反转录得到cDNA。根据序列设计特异性克隆引物(表1),利用Gateway技术,构建植物表达载体pB7GWIWG2(II)。对构建完成的植物表达载体用限制性内切酶dⅢ和Ⅰ双酶切鉴定和测序鉴定,测序所用引物为LOCUS1和LOCUS2(表1)。
1.2.2 农杆菌介导的遗传转化以及转基因植株检测 将重组质粒转化入农杆菌菌株EHA105中,并利用叶盘法使转化成功的农杆菌侵染‘嘎拉’组培苗叶片,通过培养使其再生成苗[16]。采用CTAB法[17]提取转基因植株和对照植株DNA。PCR检测引物根据载体上的基因设计(表1)。
1.2.3 转基因苹果植株对白粉病的抗性鉴定 对转基因株系以及对照植株采用压片法进行白粉病菌接种试验,并在接菌后25 d观察白粉病发病情况。利用photoshop软件进行病斑面积统计分析。
1.2.4 超氧阴离子和过氧化氢(H2O2)含量及抗氧化酶活性测定 取接种白粉病菌后0、5、10、15、20 d的叶片分别置于氯化硝基四氮唑蓝液(NBT)和二氨基联苯胺法(DAB)溶液(1 mg·mL-1)中进行组织化学染色,溶液完全淹没叶片,抽真空(1.2 psi)90 min。取出叶片分别光照30 min和6 h后,置于75%的酒精中水浴(50℃)脱色至叶绿素完全消失,拍照留存。
超氧化物歧化酶(SOD)过氧化氢酶(CAT)、过氧化物酶(POD)抗氧化酶活性的测定参考何斐[18]的方法。-1,3-葡聚糖酶活性的测定使用-1,3-葡聚糖酶试剂盒,购于Solarbio生物公司。
1.2.5 基因表达量分析 RT-qPCR参照SYBRTMII试剂盒(TaKaRa)说明书,选择作为内参基因[19]。抗病相关基因表达分析所用引物见表2。目的基因沉默效率计算方法:沉默效率(%)=(Exp未转基因- Exp转基因)/Exp未转基因×100[20]。
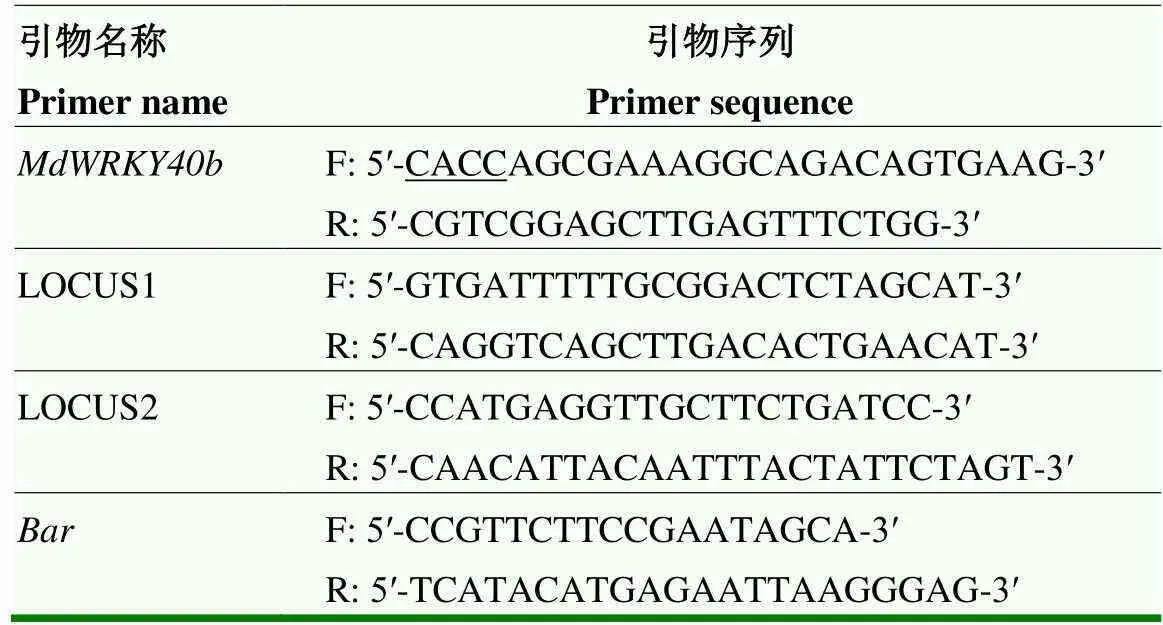
表1 MdWRKY40b克隆及表达载体构建引物序列

表2 RT-qPCR所用引物
2 结果
2.1 MdWRKY40b克隆及表达载体构建
从苹果品种‘嘎拉’中克隆得到552 bp的特异性片段(图1-A)。构建RNAi表达载体pB7GWIWG2(Ⅱ)::(图1-B),Ⅰ、d Ⅲ双酶切检测(图1-C),随后转化农杆菌感受态EHA105,并进行菌液PCR检测(图1-D),结果显示表达载体构建成功。
2.2 转基因株系PCR鉴定及目的基因表达量分析
利用PCR技术,对转基因株系进行DNA水平鉴定。扩增引物以表达载体中的序列为模板进行设计(表1),产物长度为1 393 bp。结果显示,3个转基因株系(泳道6—8)扩增出一条1 393 bp大小的片段(图2-A),说明外源表达载体pB7GWIWG2(Ⅱ)::整合到‘嘎拉’基因组中。对3个转基因植株中的表达量进行分析,结果显示,与野生植株相比,转基因植株表达量显著降低,3个株系沉默效率分别为95.2%、92.2%、79.8%(图2-B)。
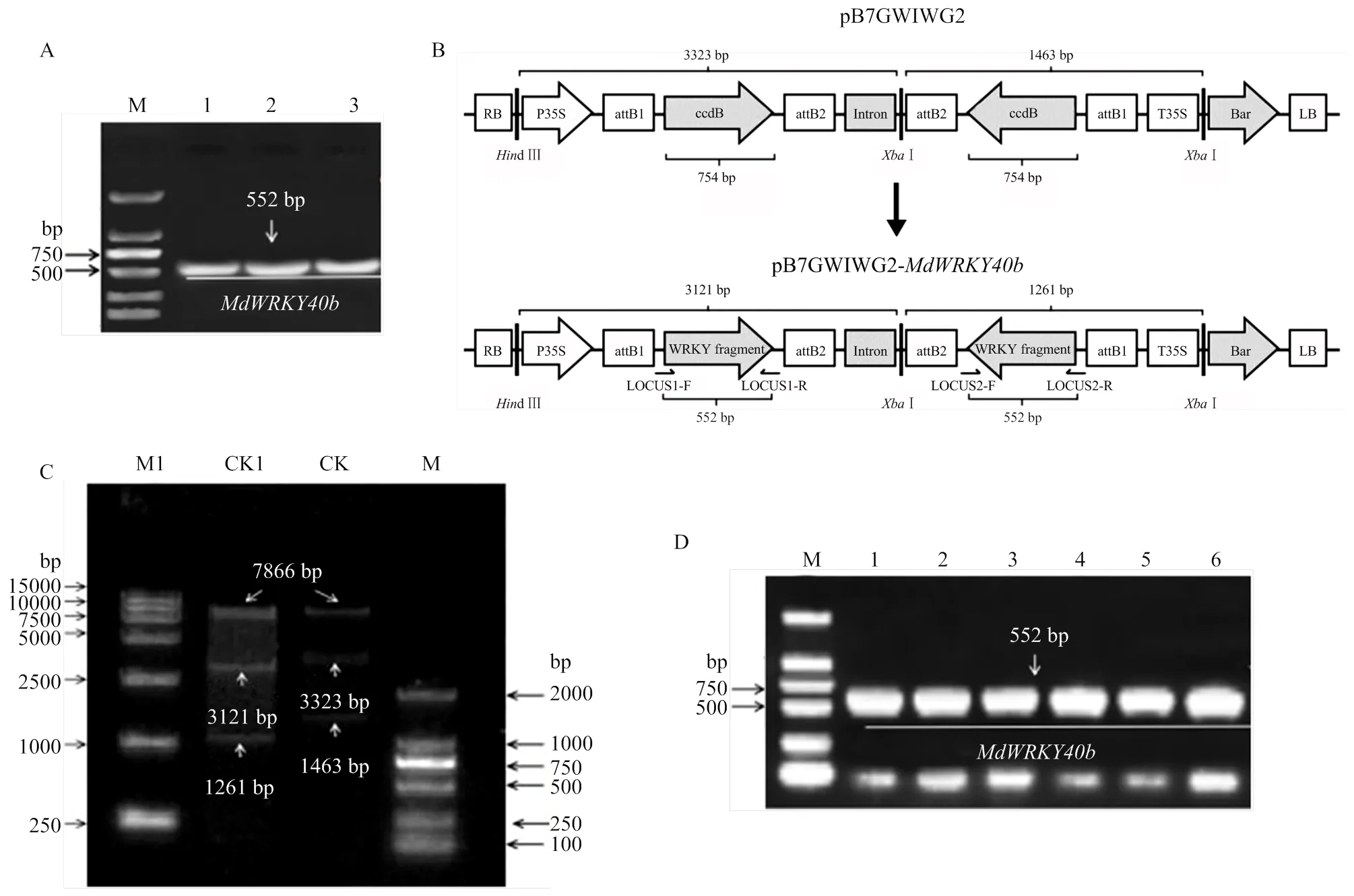
A:基因克隆Gene cloning。M:DL 2000 marker;1—3:MdWRKY40 552 bp片段的3个生物学重复The three biological replicates of the 552 bp fragment of MdWRKY40b。B:pB7GWIWG2(Ⅱ)::MdWRKY40b载体示意图Schematic illustration of pB7GWIWG2(Ⅱ)::MdWRKY40b vector。C:MdWRKY40b连接表达载体pB7GWIWG2(Ⅱ)的双酶切检测Double enzyme digestion detection of MdWRKY40b linked vector pB7GWIWG2(Ⅱ)。M:DL 2000 marker;M1:DL 15000 marker;CK:pB7GWIWG2(Ⅱ)空载pB7GWIWG2(Ⅱ) vector;CK1:pB7GWIWG2(Ⅱ) ::MdWRKY40b载体pB7GWIWG2(Ⅱ) ::MdWRKY40b vector。D:载体转化农杆菌PCR检测PCR detection of Agrobacterium of vector transformation。M:DL 2000 marker;1—6:MdWRKY40 552 bp片段的6个生物学重复The six biological replicates of the 552 bp fragment of MdWRKY40b
2.3 抗性基因的表达分析
利用RT-qPCR技术,对转基因植株和表达量进行了分析。结果如图3所示,与野生型植株相比,转基因植株的和均显著上调表达,的表达量无显著变化。以上结果说明沉默增强了抗性基因的表达。
2.4 转基因株系白粉病抗性表型观察
为探究RNAi-转基因株系对白粉病抗性表型,选取长势一致的‘嘎拉’苹果和3个转基因株系进行白粉病菌的接种试验,白粉病菌处理后的苹果叶片表型(图4)以及病斑面积统计(图5)结果显示,3个RNAi-转基因苹果株系相较其对照植株叶片上的粉状病斑面积显著减少,且RNAi-1号转基因株系叶片上的病斑面积最小。
2.5 苹果叶片活性氧和过氧化氢含量
采集白粉病菌处理0、5、10、15和20 d后的RNAi-转基因株系及对照植株叶片,进行氯化硝基四氮唑蓝液(NBT)(图6)和二氨基联苯胺法(DAB)(图7)染色和脱色处理,并对染色后的形态进行对比观察。结果显示,随着白粉病菌处理时间的延长,叶片染色面积逐渐加大,颜色逐渐加深,分别对应超氧阴离子和过氧化氢在叶片中的积累量越来越多。在处理0—20 d内,叶片中超氧阴离子和过氧化氢的含量在持续增长,其中,在15 d时,野生型株系的超氧阴离子就几乎遍布整个叶片,在20 d时,野生型株系的过氧化氢也基本遍布整个叶片,而RNAi-转基因株系的超氧阴离子和过氧化氢的积累量相较同一时期的野生型要少得多,且RNAi-1号株系中的超氧阴离子和过氧化氢的含量在同时期的转基因株系中是最少的。

A:转基因植株PCR鉴定PCR identification of transgenic plants。1:野生型植株Wild-type (WT) line;2:pB7GWIWG2(Ⅱ)-MdWRKY40b表达载体pB7GWIWG2(Ⅱ)-MdWRKY40b vector;3、4:非阳性植株Non-positive line;5:DL 5000 marker;6—8:阳性植株Positive line;9:水water。B:转基因植株MdWRKY40b表达量分析expression level analysis of MdWRKY40b in transgenic plants。C:转基因株系transgenic line

图3 转基因株系抗性基因的表达分析

图4 接种白粉病菌后25 d的表型观察
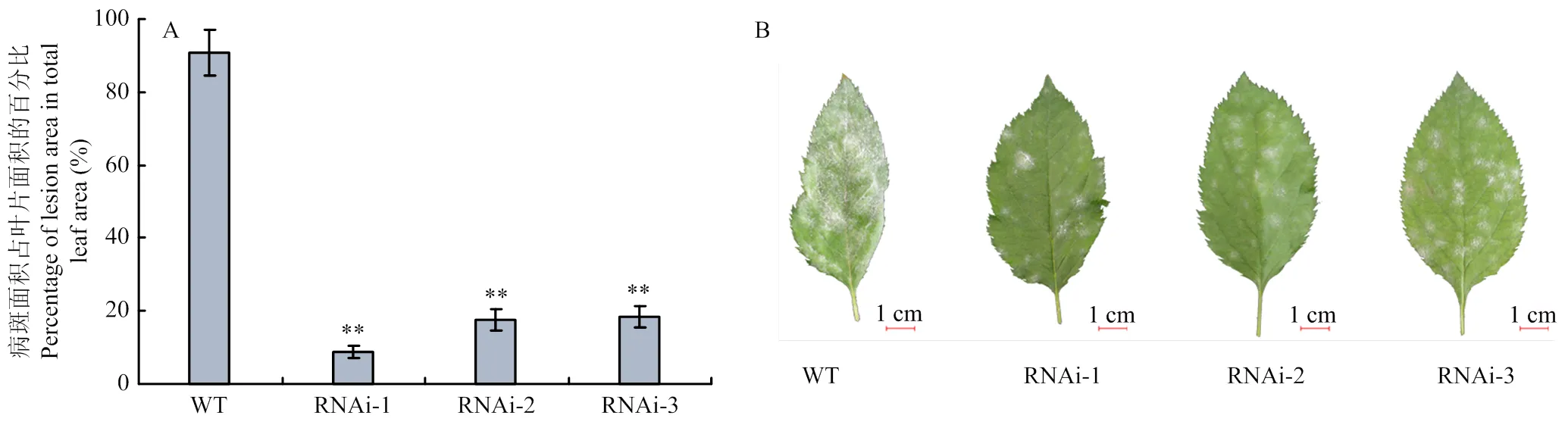
A:病斑面积占叶片总面积百分比。平均百分比由20个叶片生物学重复计算得来,误差线表示的是数值的标准误,根据Tukey和Games-Howell的显著性检验(p<0.01),与对照相比存在显著性差异用星号标识Percentage of lesion area in total leaf area. Average percentage was calculated from 20 biological replicates. Error bars show the standard errors of the mean. Statistically significant differences in the comparisons with CK, according to the Tukey and Games-Howell post hoc tests (p<0.01), are indicated with asterisks。B:接种白粉病菌后25 d的叶片表型The observation of the leaf phenotype 25 days after inoculated with P. leucotricha
2.6 苹果叶片相关抗氧化酶活性
为了进一步探究苹果防御白粉病过程与相关酶活性的关系,测定了各侵染时间点相关酶的活性(图8)。在白粉病菌侵染后的15 d,SOD与CAT活性在4个株系中达到峰值,之后转基因株系的酶活性趋于平稳,而野生型株系的酶活性开始快速降低;经白粉病菌处理的叶片POD活性随侵染时间不断增加,在侵染后10 d达到峰值;在白粉病菌侵染过程中,4个株系叶片的-1,3-葡萄糖酶活性一直急剧上升到侵染后5或10 d达到峰值,随后酶活性急剧下降。在整个白粉病菌侵染过程中,转基因株系中的4种酶活性始终高于对照株系的酶活性。在3个转基因株系中,RNAi-1号株系中的4种酶活性在白粉病菌侵染后期较RNAi-2号和RNAi-3号株系的酶活性高。

图6 接种白粉病菌后叶片超氧阴离子积累量

图7 接种白粉病菌后叶片过氧化氢积累量
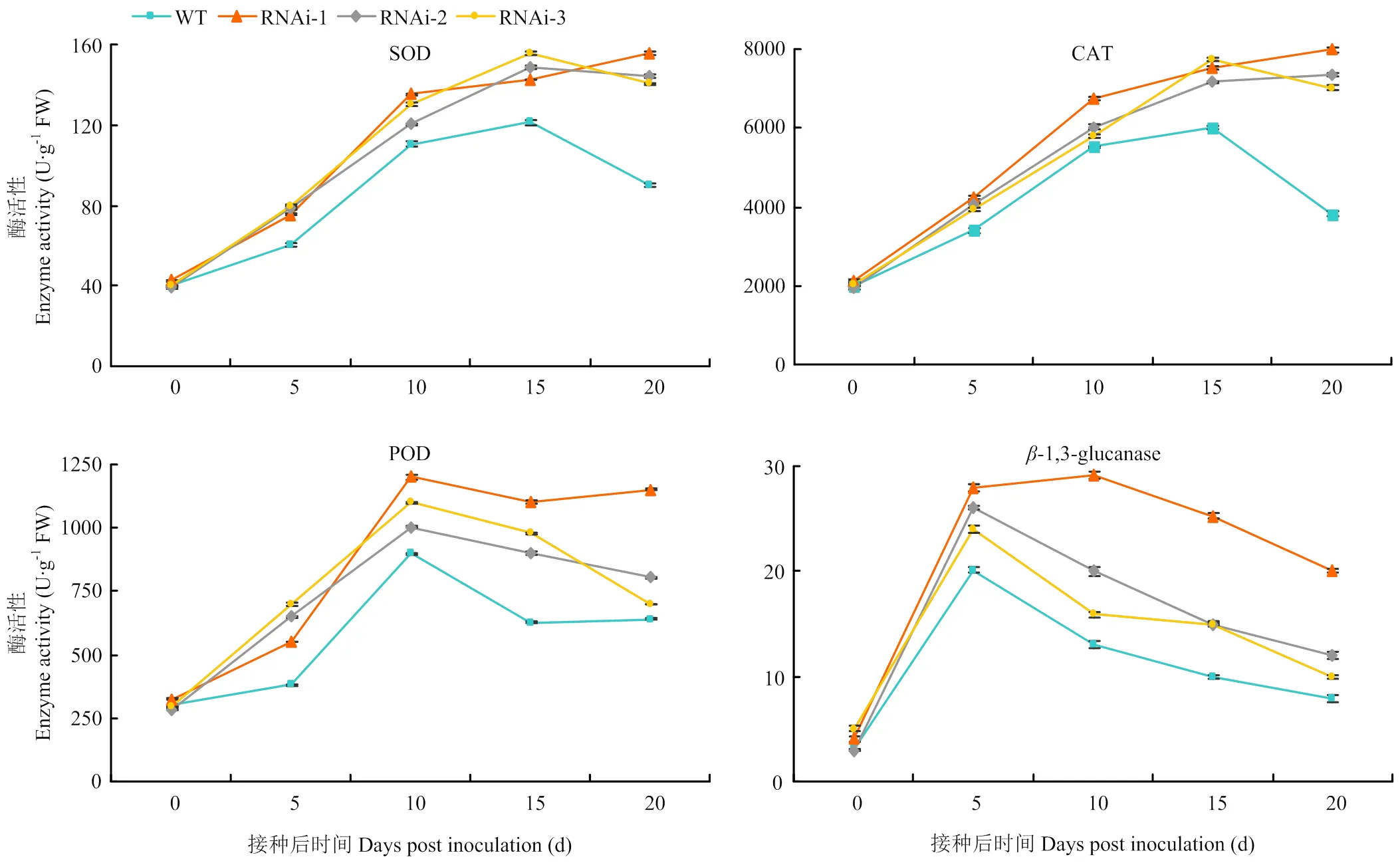
图8 接种白粉病菌后叶片抗性酶活性定量分析
3 讨论
活性氧产生是有氧代谢的必然结果,包括氧的一电子还原产物超氧阴离子(O2-)和二电子还原产物过氧化氢等[21]。病原菌胁迫会使植物体细胞大量累积活性氧,低浓度的活性氧可以作为信号分子来调控植物的抗病性[22],但是如果植物体长时间处于胁迫条件下,植物体内的活性氧含量会随时间不断累积,研究表明,过多的活性氧会氧化细胞内半胱氨酸和蛋氨酸的含硫基团,使Cu/Zn-SOD、Fe-SOD和卡尔文循环中的一些酶类失活,它也能氧化蛋白激酶、磷酸酶以及含硫醇残基的转录因子,损伤植物体的细胞组织,最终影响植物正常的生长代谢[23]。因此,增强植物对超氧阴离子的清除能力是增强植物抗逆能力的一种途径。
活性氧合成、清除以及信号介导的调控网络在植物防御病原菌入侵中起着重要作用[24]。活性氧的产生和清除二者间必须达到完全平衡才能避免氧化胁迫,植物体酶促反应通过调节活性氧的代谢来达到清除活性氧的目的,主要包括SOD、POD及CAT等[25]。黄世文等[26]以对纹枯病具有不同抗性的水稻品种为研究对象,发现在接种病菌条件下,抗性强的水稻品种中SOD和POD的活性显著高于感病品种;LJl是从土壤中分离得到的一株对瓜类白粉病有良好防治效果的生防细菌,谷医林[27]在验证生防菌防治黄瓜白粉病的过程中发现,喷施生防菌LJ1可以诱导黄瓜内SOD和POD等抗氧化酶活性的增强;Polidoros等[28]研究表明,在烟草中异源表达玉米的可以显著增加烟草对病原菌的抗病性;张亮等[29]在筛选对番茄枯萎病有广谱防治效果生防菌的过程中发现,-1,3-葡萄糖酶响应真菌的侵染并可以提高番茄的抗病性。
在抵御病原菌侵染的过程中抗性酶活性的提高往往受到转录因子的调控,如WRKY转录因子。研究表明,通过增强抗氧化酶系统,维持活性氧动态平衡和膜脂稳定性来正调控拟南芥对生物胁迫的响应[30];在提高葡萄对白粉病抗性的研究中发现,的过表达提高了SOD、POD和CAT等抗氧化酶的活性,而且防御相关基因的表达量也随之增加[10];在黄瓜霜霉病菌()的侵染下,黄瓜的过表达植株中抗氧化酶表达水平相较对照植株更高,积累的活性氧较少,水杨酸和茉莉酸信号通路相关基因的表达量显著增加[31]。本研究将苹果品种‘嘎拉’中白粉病相关基因沉默表达,转基因植株中、和的表达量增加,在接种白粉病菌的条件下,发现转基因植株对白粉病的抗病性增强,抗氧化酶活性提高,产生的活性氧更少。结合前人研究结果,笔者推测转基因植株中抗性基因的上调表达提高了苹果植株对白粉病的基础抗性,使得转基因植株中的抗性酶活性提高,导致植物体对超氧阴离子的清除能力增加,维持了植物体在响应病菌侵染过程中的低浓度超氧阴离子含量,从而减少高浓度超氧阴离子对植物的损伤。随着病菌侵染时间的延长,转基因植株也无法维持活性氧产生和清除的平衡,但是转基因植株的这一失衡点时间较野生型植株的晚。
4 结论
以苹果品种‘嘎拉’为材料,利用RNAi技术获得3个沉默的转基因株系。转基因植株中的、和表达量显著增加;在接种白粉病菌后,发现的沉默使得苹果对白粉病的抗病性增强,超氧阴离子和过氧化氢的积累量显著降低,SOD、CAT、POD等调节植物超氧阴离子代谢的抗氧化酶以及抗病相关的-1,3-葡聚糖酶活性显著增强。综上推测,转基因植株中、、的上调表达提高了相应酶的活性,导致植物对超氧阴离子的清除能力增加,减少了高浓度超氧阴离子对植物的损伤,最终表现为苹果植株对白粉病基础抗性的提高。
[1] 王丽丽. 苹果白粉病病害及其防治. 农业科技与信息, 2014(7): 40.
WANG L L. Apple powdery mildew disease and its control. Agricultural Science-Technology and Information, 2014(7): 40. (in Chinese)
[2] 闫文涛, 岳强, 冀志蕊, 周宗山, 仇贵生, 王雅偲. 苹果白粉病的诊断与防治实用技术. 果树实用技术与信息, 2019(9): 28-30.
YAN W T, YUE Q, JI Z R, ZHOU Z S, QIU G S, WANG Y S. Practical techniques for diagnosis and control of apple powdery mildew. Practical Technology and Information of Fruit trees, 2019(9): 28-30. (in Chinese)
[3] Pieterse C M J, VAN DER Does D, Zamioudis C, Leon-Reyes A, VAN Wees S C M. Hormonal modulation of plant immunity. Annual Review of Cell and Developmental Biology, 2012, 28: 489-521.
[4] Ishiguro S, Nakamura K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizessequences in the 5′ upstream regions of genes coding for sporamin and-amylase from sweet potato. Molecular and General Genetics, 1994, 244(6): 563-571.
[5] 郑超, 郑二松, 王栩鸣, 李冬月, 杨勇, 余初浪, 周洁, 严成其, 陈剑平. 水稻WRKY转录调控因子研究进展. 生物技术通讯, 2018, 29(2): 286-294.
ZHENG C, ZHENG E S, WANG X M, LI D Y, YANG Y, YU C L, ZHOU J, YAN C Q, CHEN J P. Research progress on rice WRKY transcription factors. Letters in Biotechnology, 2018, 29(2): 286-294. (in Chinese)
[6] Yang P, Chen Z. A family of dispersed repetitive DNA sequences in tobacco contain clusters of W-box elements recognized by pathogen-induced WRKY DNA-binding proteins. Plant Science, 2001, 161(4): 655-664.
[7] Eckey C, Korell M, Leib K, Biedenkopf D, Jansen C, Langen G, Kogel K H. Identification of powdery mildew-induced barley genes by cDNA-AFLP: functional assessment of an early expressed MAP kinase. Plant Molecular Biology, 2004, 55(1): 1-15.
[8] MENG Y, Wise R P. HvWRKY10, HvWRKY19, and HvWRKY28 regulate-triggered immunity and basal defense to barley powdery mildew. Molecular Plant-Microbe Interactions, 2012, 25(11): 1492-1505.
[9] Wang X, Guo R, Tu M, Wang D, Guo C, Wan R, Li Z, Wang X. Ectopic expression of the wild grape WRKY transcription factorinenhances resistance to the biotrophic pathogen powdery mildew but not to the necrotrophic pathogen. Frontiers in Plant Science, 2017, 8: 97.
[10] Zhao J, Zhang X, Guo R, Wang Y, Guo C, Li Z, Chen Z, Gao H, Wang X. Over-expression of a grape WRKY transcription factor gene,, inincreases disease resistance and drought stress tolerance. Plant Cell, Tissue and Organ Culture, 2018, 132: 359-370.
[11] Wei W, Cui M Y, Yang H, Gao K, Xie Y G, Jiang Y, Feng J Y. Ectopic expression of, a WRKY transcription factor from the diploid woodland strawberry (), enhances resistance to powdery mildew, improves osmotic stress resistance, and increases abscisic acid sensitivity in. Plant Science, 2018, 275: 60-74.
[12] Shen Q H, Saijo Y, Mauch S, Biskup C, Bieri S, Keller B, Seki H, Ulker B, Somssich E, Schulze-Lefert P. Nuclear activity of MLA immune receptors links isolate-specific and basal disease-resistance responses. Science, 2007, 315(5815): 1098-1103.
[13] Pandey S P, Roccaro M, SchÖn M, Logemann E, SOMSSICH I e. Transcriptional reprogramming regulated by WRKY18 and WRKY40 facilitates powdery mildew infection of. The Plant Journal, 2010, 64(6): 912-923.
[14] Schön M, Töller A, Diezel C, Roth C, Westphal L, Wiermer M, Somssich I E. Analyses ofplants reveal critical roles of sa/eds1 signaling and indole-glucosinolate biosynthesis forresistance and a loss-of resistance towardspv.. Molecular Plant-Microbe Interactions, 2013, 26(7): 758-767.
[15] 罗昌国, 袁启凤, 裴晓红, 吴亚维, 郑伟, 章镇. 富士苹果基因克隆及其对白粉病的抗性分析. 西北植物学报, 2013, 33(12): 2382-2387.
LUO C G, YUAN Q F, PEI X H, WU Y W, ZHENG W, ZHANG Z. Cloning ofgene in Fuji apple and its response to powdery mildew stress.Acta Botanica Boreali-Occidentalia Sinica, 2013, 33(12): 2382-2387. (in Chinese)
[16] 李厚华, 阙怡, 费昭雪, 王亚杰. 红肉苹果组织培养及转基因体系的建立与优化. 北方园艺, 2011(15): 175-179.
LI H H, QUE Y, FEI Z X, WANG Y J. Establishment and optimization of tissue culture and transgenic system ofvar.. Northern Horticulture, 2011(15): 175-179. (in Chinese)
[17] Mundy D C, Vanga B R, Thompson S,Bulman S. Assessment of sampling and dna extraction methods for identification of grapevine trunk microorganisms using metabarcoding. New Zealand Plant Protection, 2018, 71: 10-18.
[18] 何斐. 黄土高原丛枝菌根真菌(AMF)提高刺槐抗旱性机制[D]. 杨凌: 西北农林科技大学, 2016.
HE F. Arbuscular mycorrhizal fungi (AMF) in the loess plateau and mechanisms of amf in drought resistance of[D]. Yangling: Northwest A&F University, 2016. (in Chinese)
[19] 周兰, 张利义, 张彩霞, 康国栋, 田义, 丛佩华. 苹果实时荧光定量PCR分析中内参基因的筛选. 果树学报, 2012, 29(6): 965-970.
ZHOU L, ZHANG L Y, ZHANG C X, KANG G D, TIAN Y, CONG P H. Screening of reference genes for real-time fluorescence quantitative PCR in apple (×). Journal of Fruit Science, 2012, 29(6): 965-970. (in Chinese)
[20] 王蕾, 顾婷婷, 甘立军. 森林草莓基因RNAi干扰载体的构建及功能分析. 生物学杂志, 2020, 37(5): 39-43.
WANG L, GU T T, GAN L J. Construction and functional analysis ofgene RNAi interference vector in forest strawberries. Journal of Biology, 2020, 37(5): 39-43. (in Chinese)
[21] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, 2004, 55: 373-399.
[22] Rizhsky L, Liang H, Mittler R. The combined effect of drought stress and heat shock on gene expression in tobacco. Plant Physiology, 2002, 130(3): 1143-1151.
[23] 薛鑫, 张芊, 吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用. 生物技术通报, 2013(10): 6-11.
XUE X, ZHANG Q, WU J X. Research of reactive oxygen species in plants and its application on stress tolerance. Biotechnology Bulletin, 2013(10): 6-11. (in Chinese)
[24] Baxter A, MITTLER R, SUZUKI N. ROS as key players in plant stress signalling. Journal of Experimental Botany, 2014, 65(5): 1229-1240.
[25] 田小敏. 基于转录组水平的苹果抗白粉病基因筛选与感病叶片生理指标分析[D]. 杨凌: 西北农林科技大学, 2019.
TIAN X M. Study on physiological indicators response to powdery mildew of apple and screening of the resistant gene based on transcriptome analysis[D]. Yangling: Northwest A&F University, 2019. (in Chinese)
[26] 黄世文, 王玲, 王全永, 唐绍清, 陈惠哲, 鄂志国, 王磊, 朱德峰. 纹枯病菌对不同水稻品种叶片中抗病性相关酶活性的影响. 中国水稻科学, 2008, 22(2): 219-222.
HUANG S W, WANG L, WANG Q Y, TANG S Q, CHEN H Z, E Z G, WANG L, ZHU D F. Rice sheath blight pathogen () impacts the activities of disease resistance-related enzymes in leaves of different rice varieties. Chinese Journal of Rice Science, 2008, 22(2): 219-222. (in Chinese)
[27] 谷医林. 瓜类白粉病生防菌LJ1的鉴定和诱导抗病性研究及生物安全性评价[D]. 郑州: 河南农业大学, 2013.
GU Y L. The studies of the identification, the induced resistance against cucurbits powdery mildew and the biological safety of biocontrol agent LJ1[D]. Zhengzhou: Henan Agricultural University, 2013. (in Chinese)
[28] Polidoros A N, Mylona P V, Scandalios J G. Transgenic tobacco plants expressing the maizegene have altered catalase levels that affect plant-pathogen interactions and resistance to oxidative stress. Transgenic Research, 2001, 10(6): 555-569.
[29] 张亮, 王改兰, 段建南, 赵兰凤, 李华兴. 广谱生防菌对番茄枯萎病的防病效果及其机理. 中国生物防治学报, 2015, 31(6): 897-906.
ZHANG L, WANG G L, DUAN J N, ZHAO L F, LI H X. Suppression of tomato Fusarium wilt disease by bacteria strains and their mechanism. Chinese Journal of Biological Control, 2015, 31(6): 897-906. (in Chinese)
[30] Xiang X Y, Chen J, Xu W X, Qiu J R, Song L, Wang J T, Tang R, Chen D, Jiang C Z, Huang Z. Dehydration-induced WRKY transcriptional factor MfWRKY70 ofenhanced drought and salinity tolerance in. Biomolecules, 2021, 11(2): 327.
[31] Luan Q, Chen C, Liu M, Li Q, Wang L, Ren Z.mediates defense responses toinfection in. Plant science, 2019, 279: 59-69.
The Resistance Mechanism of apple Transcription Factor MdWRKY40b to powdery mildew
SHA Renhe1, LAN Liming1, WANG Sanhong1,LUO Changguo2
1College of Horticulture, Nanjing Agricultural University, Nanjing 210095;2Institute of Fruits Sciences, Guizhou Academy of Agricultural Sciences, Guiyang 550006
【Objective】The research aims to explore the mechanism of apple resistance to powdery mildew regulated by transcription factor gene, and to provide a theoretical basis for apple powdery mildew resistance breeding.【Method】the 552 bp specific fragment ofwas cloned using the cDNA obtained from the ‘Gala’ leaf tissue, the forward and reverse sequence of this gene specific fragment was constructed into the RNAi expression vector pB7GWIWG2(Ⅱ) by the Gateway technique, and then transgenic plants were obtained by an-mediated method. Notably, the young leaves at the stem tips of tissue culture seedlings were chosen as the materials for-mediated infection experiments. The expression levels of, superoxide dismutase gene (), catalase gene (), peroxidase gene (), andin transgenic plants were analyzed by RT-qPCR technology. Furthermore, using one-year-old plants as materials, the resistance of transgenic plants to powdery mildew was analyzed through the inoculation test of the powdery mildew pathogen (). The leaves of transgenic and control plants at 0, 5, 10, 15, and 20 d after inoculation withwere used as materials, and the accumulation of superoxide anion and hydrogen peroxide in plant materials duringinfection was analyzed by staining with nitrotetrazolium chloride solution (NBT) and diaminobenzidine (DAB). Furthermore, the activities of SOD, POD, CAT, and-1,3-glucanase in plants were determined duringinfection.【Result】Threegene silencing lines were identified by PCR detection. The RT-qPCR results showed that the gene silencing efficiency of RNAi-1, RNAi-2, and RNAi-3 was 95.2%, 92.2%, and 79.8%, respectively. The expression level of,, andin transgenic plants was significantly up-regulated compared with the wild-type. Under the condition ofinfection, compared with wild-type plants, the area of powdery disease spots in the leaves of transgenic plants decreased significantly, the accumulation of superoxide anion and hydrogen peroxide was reduced significantly, and the activities of antioxidant enzymes such as SOD, CAT, and POD regulating superoxide anion metabolism and-1,3-glucanase related to disease resistance were significantly enhanced. 【Conclusion】The silencing ofenhances the resistance of apple plants to powdery mildew. It is speculated that the up-regulated expression level of,, andin transgenic plants improves the basic resistance of apple plants to powdery mildew, and increases the scavenging ability of plants to superoxide anions. It can maintain a low concentration of superoxide anion content in response toinfection, so as to reduce the damage of high concentrations of superoxide anion to plants.
apple; powdery mildew;; transgene;reactive oxygen species (ROS); antioxidant enzyme

2021-04-19;
2021-05-31
国家自然科学基金(31560551)、贵州省落叶果树特色种质资源收集保存和创新利用(黔农科院自主创新科研专项字(2014)08号)
沙仁和,E-mail:1091595079@qq.com。通信作者王三红,E-mail:wsh3xg@njau.edu.cn。通信作者罗昌国,E-mail:376258195@qq.com
(责任编辑 岳梅)
