骨髓间充质干细胞旁分泌IGF-1体外调节胰岛瘤细胞
2022-01-17张勇群郝豆豆陈思媛葛志静
张勇群,施 静, 郝豆豆, 万 莎,陈思媛 ,葛志静
(1.西藏自治区人民政府驻成都办事处医院,四川成都 610041;2.西藏大学医学院,西藏 拉萨850000)
糖尿病是是一种自身免疫性疾病,能造成机体本身的胰岛素分泌不足,从而引发各种糖代谢综合征,如糖尿病肾病、糖尿病脑病、糖尿病视网膜病变、糖尿病足病等一系列的并发症[1-3].是目前除了心血管疾病、癌症之外对人类造成的致残性和致死率都很高的一种慢性疾病,对人体的健康危害极大,且随着全球人口的增加及老龄化的加剧,糖尿病的发病率越来越高,也越来越年轻化[4].有报道表明,目前我国糖尿病的发病率从10~80岁均明显增加[5].根据推断,预计到2030年,我国糖尿病的发病人数将达到1.5亿,全球将有5.5亿糖尿病患者,糖尿病的治疗迫在眉睫[6].糖尿病的发生多因胰岛β细胞功能损害或者减退、胰岛素分泌水平降低、甚至胰岛素抵抗等[7- 8].因此,改善胰岛β细胞功能是改善糖尿病症状的必要手段.
骨髓间充质干细胞(BMSCs)是一类具有向多种细胞分化潜能的细胞,是一种理想的组织工程种子细胞,易于提取,分离及扩增,具有自我更新能力强、多向分化、诱导免疫耐受等功能[9].有报道显示BMSCs能通过旁分泌作用抑制肝星状细胞的增殖,促进肝星状细胞的凋亡,且BMSCs的旁分泌作用也在免疫、炎症领域有很好的应用[10-11].在我们的前期研究中已证实BMSCs与胰岛β细胞联合移植对糖尿病大鼠的治疗效果较单独胰岛β细胞移植治疗效果更好,在不存在免疫排斥的体外实验中我们也发现BMSCs与胰岛β细胞联合培养时胰岛β细胞的存活时间比单独胰岛β细胞存活时间更长[12].但当时对于BMSCs能延长胰岛β细胞存活时间的原因并未找到,随着BMSCs旁分泌的研究越来越多,我们推测可能也与BMSCs旁分泌一些保护因子对胰岛β细胞进行保护有关, 因大鼠胰岛瘤细胞(INS-1)更容易获得,且具有胰岛β细胞的功能.因此,为了进一步探究BMSCs旁分泌对胰岛β细胞功能的改善作用,本实验通过BMSCs的上清液与大鼠胰岛瘤细胞(INS-1)建立直接共培养体系,初步探讨BMSCs旁分泌调节胰岛功能的机制.
1 资料与方法
1.1 实验材料、试剂
1周龄的SPF级SD雄性大鼠供分离BMSCs用,购自四川成都恩斯特尔动物研究所、大鼠胰岛瘤细胞INS-1细胞系(美国ATCC公司)、胎牛血清(国产,四季青)、1640培养基(美国Gibco公司)、0.25%胰蛋白酶(美国Hyclone公司),CD90抗体(ab181547, Abcam公司)、胰岛素抗体(ab181547, Abcam公司);胰岛素样细胞生长因子(IGF-1)(Medchem Express LLc)、IGF-1R受体抑制剂NVPAEW-541(Medchem Express LLc)、大鼠胰岛素酶联免疫吸附测定试剂盒(中国Elabscience 公司)、大鼠胰岛素样生长因子酶联免疫吸附试剂盒(中国联科生物)、荧光二抗(山羊抗兔ZF-511,山羊抗鼠ZT-0513,北京中杉金桥生物科,技有限公司);酶标仪(MOLECULHR Spectra Max i3X);生物安全柜(ESCO,LA2-4A1),CO2恒温细胞培养箱(力康 Heal Force),低速离心机(Centrifuge 5810R),相差倒置光学显微镜(Nikon Ts2R).
1.2 研究方法
1.2.1 BMSCs的分离与培养鉴定
取4只一周龄SD雄性大鼠,1%戊巴比妥钠麻醉大鼠,无菌条件下取出胫骨和股骨,1640培养基反复冲洗骨髓腔,制成单细胞悬液,收集至10 ml离心管轻柔吹散,过滤.清除杂质及细胞团,1 200 rmp离心5 min,弃上清,接种于含10%胎牛血清、1%青霉素、链霉素的1640培养基中,置于37 ℃、5%CO2饱和湿度的培养箱中培养,培养24 h后进行换液.待长满至80%~90%时取细胞上清液进行后续实验.
1.2.2 大鼠胰岛细胞瘤细胞INS-1培养
将购置的细胞在含有10%胎牛血清的RPMI1640培养基中培养,置于37 ℃和5%浓度的CO2培养箱培养.待细胞长满80%~90%时传代至放入爬片的6孔板内,将细胞分为培养的INS-1系(对照组)、培养的INS-1系+IGF-1组、培养的INS-1系+NVPAEW541组共3组,置于37 ℃、 5%CO2饱和湿度的培养箱中培养,培养24 h后进行换液,培养48 h后取细胞上清液、细胞、细胞爬片进行后续实验.
1.2.3 建立直接共培养体系
将BMSCs的细胞上清液与INS-1细胞进行混合培养,混合培养组中均向INS-1细胞加入2mlBMSCs的上清液,分为分为BMSCs上清液+培养的INS-1系(混合对照组),BMSCs上清液+培养的INS-1系+IGF-1组,BMSCs上清液+培养的INS-1系+NVPAEW541组共3组,加的IGF-1为BMSCs上清液稀释为150 ng/ml的刺激因子、加的NVPAEW541为BMSCs上清液稀释为5 umol/L的抑制剂,BMSCs上清液为培养的BMSCs细胞培养液离心后收集的上层培养液.培养48 h后取细胞上清液、细胞、细胞爬片进行后续实验.
1.2.4 酶联免疫法(ELISA)检测细胞培养液的胰岛素与IGF-1的分泌水平
取培养的INS-1系(对照组)、培养的INS-1系+IGF-1组、培养的INS-1系+NVPAEW541组、BMSCs上清液+培养的INS-1系、BMSCs上清液+培养的INS-1系+IGF-1组、BMSCs上清液+培养的INS-1系+NVPAEW541组共6组培养48 h后的细胞上清液,按各检测试剂盒说明书进行检测.
1.2.5 免疫荧光检测
将上述6组细胞爬片进行4%多聚甲醛浸泡15 min,PBS洗涤3次,每次5 min,0.5%Triton X-100室温通透20 min,PBS浸洗玻片3次,每次3 min,吸水纸吸干PBS,在爬片上滴加正常山羊血清,室温封闭30 min;甩掉封闭液,滴加一抗,4 ℃孵育过夜.洗涤,滴加与一抗相应种属的二抗浸泡爬片,避光室温孵育50 min.洗涤后滴加DAPI染液,避光室温孵育10 min、封片.倒置荧光显微镜下观察各组细胞的荧光显色情况,根据图像的细胞发光强弱来推测细胞在各组条件下的生存状态(蓝光激发波长330~390 nm,发射波长420 nm;绿光激发波长465~495 nm,发射波长534 nm;红光激发波长510~560 nm,发射波长530 nm).
1.3 统计学处理
应用SPSS25.0软件进行数据分析与作图,各组间的胰岛素分泌、IGF-1分泌水平采用随机区组方差分析,P<0.05为差异有统计学意义.
2 结果
2.1 细胞培养结果
结果显示各组细胞培养48 h后,培养的INS-1系加抑制剂NVPAEW541组的细胞形态较培养的INS-1系和培养的INS-1系加IGF-1组细胞形态呈缩小状,数量也较少(图1),混合培养组的三组细胞形态未见明显差异,但加NVPAEW541组中的细胞数量较两组少(图2).

图1 INS-1单独培养结果

图2 混合培养组 BMSCs上清液+培养的INS-1系结果Fig2 Results of BMSCs supernatant + ins-1 in the mixed culture group
ELISA结果(图3)显示BMSCs上清液+培养的INS-1系+IGF-1组的胰岛素分泌水平(161.6±4.48)与胰岛素样生长因子分泌水平(928.4±59.8)比培养的INS-1系+IGF-1组的胰岛素分泌水平(132.9±1.54)及IGF-1分泌水平(763.40±25.74)高;BMSCs上清液+培养的INS-1系组的胰岛素分泌水平(121.20±0.05)与IGF-1分泌水平(159.30±39.30)较培养的INS-1系组中的胰岛素分泌水平(12.35±0.20)和IGF-1分泌水平(99.72±5.65)高,表明对培养的INS-1系而言,BMSCs上清液能促进INS-1细胞分泌胰岛素及IGF-1因子.且BMSCs上清液+培养的INS-1系组的胰岛素分泌水平(121.20±0.05)与培养的INS-1系+IGF-1组的胰岛素分泌水平(132.9±1.54)差距不大,表明BMSCs上清液对INS-1细胞的促进作用与IGF-1的效果类似.培养的INS-1系+NVPAEW541组的胰岛素分泌水平(11.13±2.49)及IGF-1因子的分泌水平(95.95±8.67)较培养的INS-1系组的胰岛素分泌水平(12.35±0.20)和IGF-1因子分泌水平(99.72±5.65)低;BMSCs上清液+培养的INS-1系+NVPAEW541组的胰岛素分泌水平(92.45±4.06)及IGF-1因子分泌水平(137.90±20.76)较BMSCs上清液+培养的INS-1系组的胰岛素分泌水平(121.20±0.05)与IGF-1因子分泌水平(159.30±39.30)也低,表明NVPAEW541对INS-1细胞而言有抑制INS-1细胞分泌胰岛素及胰岛素样生长因子的作用.
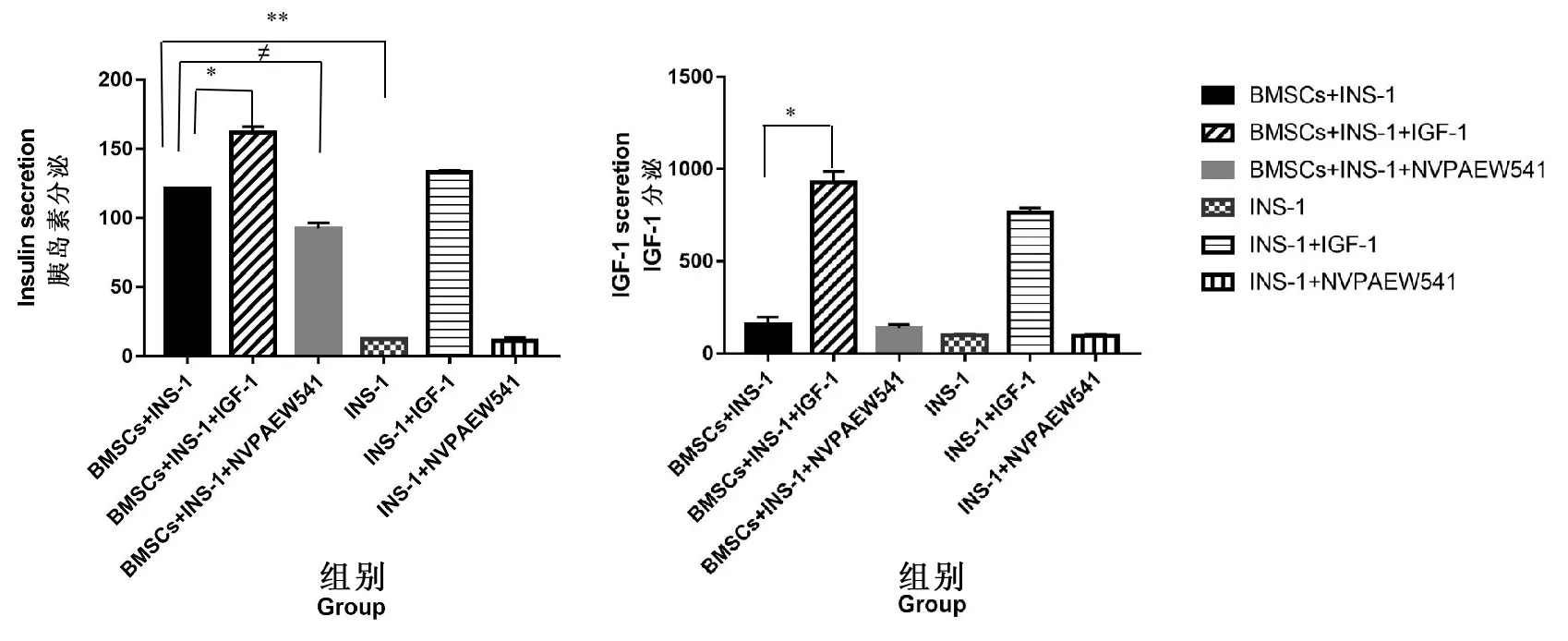
图3 各组细胞体外干预后的胰岛素分泌水平和IGF-1分泌水平
2.2 免疫荧光结果
在对各组细胞干预培养48 h后进行培养的细胞系INS-1组的胰岛素表达的结果中也很明显的可以看到加入BMSCs上清液后的混合培养组的三组荧光强度对应高于细胞系INS-1的三组的荧光强度,再次表明BMSCs上清液能增强细胞系INS-1的胰岛素表达.且BMSCs上清液+培养的细胞系INS-1组的免疫荧光强度仅稍弱于培养的细胞系INS-1+IGF-1组的免疫荧光强度,表明BMSCs上清液对INS-1细胞分泌胰岛素的促进作用与刺激因子IGF-1对INS-1细胞分泌胰岛素的效果类似,但弱于刺激因子IGF-1对细胞INS-1的刺激效果.培养的细胞系INS-1+NVPAEW541组的荧光强度明显弱于培养的细胞系INS-1组的荧光强度,且BMSCs上清液+培养的细胞系INS-1+ NVPAEW541组的荧光强度也弱于BMSCs上清液+培养的细胞系INS-1组的荧光强度,表明NVPAEW541确实对INS-1细胞分泌胰岛素有抑制作用(图4).

图4 各组免疫荧光结果
3 讨论
糖尿病的发生多因胰岛β细胞功能受损导致胰岛素的分泌不足进而造成血糖水平难以控制从而发生一系列的代谢性疾病,对人体的危害极大,能引起包括眼、肾、心血管及神经系统的全身组织器官病变,胰岛β细胞的治疗及改善是治疗糖尿病的有效途径[13].因此,越来越多的学者开始探索改善胰岛β细胞功能的方法.我们的前期研究也证实了BMSCs与胰岛细胞共培养能一定程度改善胰岛细胞的存活情况,但对于发生此现象的原因,只是猜测可能与BMSCs旁分泌某种保护因子有关[12].为了进一步探究BMSCs调节胰岛功能的机制,我们开展了此次研究.
BMSCs不仅能增殖分化成多种细胞,也能调节和改善炎症反应,还能分泌多种生长因子、细胞因子等旁分泌因子对损伤组织起修复作用[14].有研究就表明BMSCs旁分泌的肝细胞生长因子(HGF)可能通过抑制肝星状细胞的增殖并促进其凋亡,从而减轻肝脏炎症反应和肝细胞的破坏[15].旁分泌的血管内皮因子(VEGF)能改善薄型子宫内膜[16].而旁分泌的骨髓基质细胞衍生因子-1(SDF-1)能抑制细胞凋亡和诱导血管生成而改善梗死心肌的功能[17].以及旁分泌的神经营养因子(NGF)也能修复受损的脑组织[18].BMSCs还能旁分泌转化生长因子β(TGF-β)、胰岛素样生长因子(IGF-1)、血小板衍生生长因子(PDGF)、角质化细胞生长因子(KGF)等众多因子,对不同受损组织都可起到修复作用[19].
IGF-1是与胰岛素类似的生物因子,是多种细胞自分泌和旁分泌的产物,其中就包括本研究采用的BMSCs细胞,IGF-1因其具有促进细胞生长、分化、修复受损组织等功能被广泛应用于各类研究[20].IGF-1R为IGF-1的受体,在正常组织中广泛表达,而在受损组织中表达降低,IGF-1与IGF-1R的结合可激活IGF-1R通路对人体内多种生物学功能起到关键的调控作用[21].NVPAEW541为IGF-1R信号通路抑制剂,能抑制此通路的多种生物学效应[22].在本研究我们也证实了无论是单独培养的细胞系INS-1组还是共培养的培养的细胞系INS-1+IGF-1组,在加入BMSCs上清液后培养的细胞系INS-1的胰岛素分泌水平以及胰岛素样生长因子分泌水平或是免疫荧光强度均高于不加BMSCs上清液的分泌水平,而BMSCs上清液对细胞系INS-1的作用与培养的INS-1系组加入IGF-1后的效果不明显差异,因此,我们推测BMSCs上清液对细胞系INS-1的促进作用是BMSCs旁分泌产生的IGF-1在起作用.而无论是培养的INS-1系还是培养的INS-1系+BMSCs上清液,在加入抑制剂NVPAEW541后胰岛素分泌、胰岛素样生长因子的分泌以及荧光强度均低于不加抑制剂NVPAEW541的水平,表明抑制剂NVPAEW541对细胞系INS-1能起到抑制作用,而NVPAEW541能抑制IGF-1R通路.因此,我们推测BMSCs旁分泌的IGF-1可能通过刺激IGF-1R通路对细胞系INS-1起作用.结合我们前期BMSCs联合胰岛细胞能改善胰岛细胞的存活功能,推测可能与BMSCs旁分泌某种因子有关的实验结果.因原代胰岛β细胞的分离后存活率及数量均较难满足实验需求,因此本研究先采用大鼠胰岛瘤细胞系INS-1进行了前期探索实验,所以目前我们不确定BMSCs旁分泌的IGF-1因子对原代胰岛β细胞的改善作用是否与对胰岛瘤细胞系的作用一致,但现在可以肯定的是BMSCs旁分泌的IGF-1因子肯定参与了胰岛功能的调节,且是通过刺激IGF-1R通路进行改善的.
