大承气汤对脑出血模型大鼠小胶质细胞的作用及机制探讨*
2022-01-16杨树升
杨树升, 林 丽
1武汉市红十字会医院中医科,武汉 430015 2湖北中医药大学基础医学院医学分子细胞生物学实验室,武汉 430065
脑出血(intracerebral hemorrhage,ICH)是指非外伤性脑实质内血管脆性增加、破裂而引起的出血。在美国、欧洲和澳大利亚,ICH约占卒中病例的10%~15%;而在亚洲,该比率为20%~30%;我国脑出血的发病率呈现逐年上升趋势,约占脑卒中的35%[1]。同时ICH有着死亡率高和致残率高的特点,幸存者多遗留不同程度的运动障碍、认知障碍、言语障碍或吞咽障碍等后遗症,给社会和家庭带来了沉重的护理负担和经济负担[2]。虽然该病的发病机制和病理生理改变仍不十分明确,但研究表明80%以上的ICH患者有高血压病史,认为与脑血管在长期的高压下发生退行性变和动脉硬化有关,血肿和脑水肿构成ICH原发性损伤。ICH后的继发性损伤则可造成一系列并行的、持续的有害反应,包括炎症及氧化应激等。ICH后的神经炎症反应包括脑内小胶质细胞激活、促炎因子释放、外周血白细胞入脑等,这些反应是ICH继发性损伤中极为关键的环节[3]。目前临床上对ICH除了对症支持疗法,尚缺乏有效的治疗方法和手段,外科使用较多的血肿清除术的临床意义还有待进一步考证。
脑出血属中医“中风”(出血性)范畴,其病因病机变化多端,总体属本虚标实之症。临床医家发现80%以上的中风患者伴随腑气不通症,更有甚者长达数日不排大便,因此通腑法常被现代中医临床医家纳为脑出血的治疗方法之一[4]。本团队前期研究发现通腑法的代表方“大承气汤”(出自汉代“医圣”张仲景的《伤寒论》,由大黄、厚朴、枳实、芒硝四味药组成)可通过Nrf2介导的信号通路改善ICH后神经功能缺损、减少脑组织铁沉积、增加抗炎因子Arg1的表达,从而促进ICH后脑组织恢复而发挥神经保护作用[5]。但大承气汤对ICH防治的分子机制还有待进一步挖掘,尤其是其对与炎症高度相关联的小胶质细胞的影响及其规律,此类问题均需深入探讨,从而为古方经方的应用与传承提供有力支撑和证据。
1 材料与方法
1.1 材料
1.1.1 动物 Sprague-Dawley(SD)雄性大鼠45只,3月龄,体重(280±15)g,购自武汉大学实验动物中心。
1.1.2 试剂及药材 大承气汤的各种药物比例用量等均与本团队前期实验一致[5-6]。胶原酶Ⅶ(Collagenase Ⅶ)购自Sigma公司(美国),先用0.9% NaCl将其稀释成2.5 U/μL的原液,置-20 ℃冰箱备用,使用前再用0.9% NaCl将原液稀释成0.2 U/μL待用;Iba-1(标识小胶质细胞)、GFAP(标识星形胶质细胞)抗体分别购自Wako公司(日本)和Invitrogen公司(美国),p38和磷酸化p38(P-p38)抗体购自Cell Signaling公司(美国)均分装成10 μL小支,置-20 ℃冰箱保存备用,临用前用抗体稀释液按1∶200稀释后行免疫荧光染色、1∶1000稀释后行Western blot等检测。IL-1β、IL-10 ELISA试剂盒购自武汉默沙克生物科技有限公司(中国)。
1.2 动物分组及流程
所有动物适应性饲养1周并进行行为学测定(神经功能缺损评定),剔除不合格大鼠后根据随机原则将其分为假手术对照组(CON)、模型组(ICH)、大承气汤组(DCQ),每组各15只。于脑立体定位注射后1、3、7、14、28 d各组分别进行神经功能缺损评价。根据前期实验结果于14 d各组均处死5只大鼠取新鲜脑组织行ELISA检测和Western blot检测;并于14、28 d各组处死5只,灌流后做免疫荧光双重染色。饲养环境和实验操作流程均遵循动物伦理学和“实验动物使用和管理条例”中相关规定进行。
1.3 ICH模型的建立及干预
SD雄性大鼠用2%戊巴比妥钠腹腔注射(0.2 mL/100 g体重),麻醉满意后将大鼠常规消毒、备皮、固定于脑立体定位仪上,于左侧尾壳核处(前囟后0.8 mm、左侧旁开3.5 mm、深5.5 mm)行定位注射。假手术对照组定位注射等量生理盐水,另2组30只大鼠按照本课题组前期方法定位注射0.4 U胶原酶Ⅶ[5-6]。术后6 h开始灌胃,依据前期实验结果,大承气汤组选取含1 g/mL的大承气汤煎剂浓缩液灌胃,剂量为1 g/(100 g体重·次),2次/d;假手术对照组和模型组每次均用5 mL 0.9% NaCl灌胃,2次/d;以上各组均灌胃7 d。
1.4 神经功能缺损评价
于ICH后1、3、7、14及28 d时采用平衡木实验和悬尾实验分别进行神经功能缺损评价。
1.4.1 平衡木实验 取2.0 cm×1.5 cm×80 cm的木条,一端固定,同时固定端处设挡板以防大鼠逃逸,另一端悬空于离地50 cm高度,保持木条与地面平行。木条下方地面放置约40 cm×80 cm的泡沫板,以防大鼠从木条上掉落时摔伤。
将大鼠放置于木条悬空端,开始计时。观察大鼠在木条上的姿态、坚持时间及掉落时左右侧偏向。大鼠从木条上掉落即终止实验,最长2 min时亦终止实验,并予以评分。平衡木实验评分标准:1分,在木条上站稳,无摇晃,持续2 min;2分,在木条上站稳,左右摇晃,但未滑下,持续2 min;3分,在木条上站立,下滑至一侧,但未掉落,持续2 min;4分,在木条上站立超过30 s不到2 min即从木条上掉落;5分,试图在木条上站稳、但在30 s内即掉落;6分,无任何站立能力,立即从木条上掉落。得分越高,神经受损越严重。
1.4.2 悬尾实验 单手提起大鼠尾部,令大鼠头部距离地面约10 cm。此时大鼠身体会不停摇摆、向一侧扭转以试图逃脱。当大鼠头部纵轴与垂直轴的夹角≥90°时,记录1次悬体扭转,同时记录扭转偏向(左侧/右侧)。将大鼠放置于地面,让其休息2 min,再进行下一次悬体扭转。记录悬体扭转共20次时实验结束。分析其向左扭转的比率[即L/(L+R)]。
1.5 脑组织切片制备
依据本团队前期实验结果,于14 d时每组选取5只大鼠用4%的多聚甲醛进行灌注,具体方法参照本课题组前期实验[5-6]。灌注后取出脑组织修块(0.5 cm×0.5 cm×0.5 cm),然后浸泡于4%多聚甲醛进行后固定。将后固定至少24 h的脑组织取出后放入20%蔗糖-PBS溶液中至少24 h,沉底后更换30%蔗糖-PBS溶液再次浸泡至少24 h,使其再次沉底以彻底脱水。取出后用干净滤纸吸干脑组织表面水分,然后用冰冻包埋剂包埋后在冰冻切片机下切片,设置20μm的切片厚度,50%甘油-PBS置于4 ℃保存备用。
1.6 免疫荧光双重染色
挑选含尾壳核出血区截面的脑片,漂洗破膜后进行封闭,在4 ℃冷库中孵育第1个一抗(用5% BSA-PBS液按1∶200稀释,具体浓度可根据抗体特性摸索调整)至少达48 h,回收第1个一抗后用PBS液漂洗(可加0.1% Triton-X100)。加入第2个来源不同的抗体,再次放入4 ℃冰箱孵育(建议与第1个一抗孵育时间相同)。回收第2个一抗,再次漂洗10 min×3。吸弃漂洗液,室温避光孵育第1个二抗2 h(可根据室温调整孵育时间,越冷孵育时间越长)。吸弃第1个二抗,漂洗10 min×5后再加入第2种相应的荧光二抗,室温孵育2 h。漂洗、染核、漂洗、贴片(在PBS液中,注意避光),稍干后50%甘油-PBS封片,4 ℃避光保存,1周内用710双光子荧光显微镜进行图像采集并分析。
1.7 ELISA实验
从-80 ℃冰箱中取出样品,按照ELISA试剂盒中的说明准备好样品和标准品,并设置空白孔、标准孔和待测样品孔,相关孔板均需设3个平行孔板。按ELISA试剂盒中步骤要求逐一进行,每孔加酶结合工作液后置37 ℃恒温箱中孵育30 min,吸弃孔内液体、甩干、洗涤。然后在每孔板中加入适量显色底物,37 ℃避光孵育15 min(可据显色情况酌情调整显色时间),加入终止液(加入顺序与底物溶液的加入顺序一致),尽快用酶标仪检测450 nm波长处吸光度值(A)。依据不同浓度标准品的A值和浓度绘制标准曲线,然后根据样品A值利用标准曲线计算出样品中的细胞因子浓度。
1.8 Western blot实验
取出样品匀浆、BCA法检测蛋白质浓度后按照制胶、上样、电泳、转膜、封闭、孵育一抗(p38和P-p38均为多克隆抗体)、孵育二抗(辣根过氧化物酶标记的羊抗兔IgG)、显色等步骤进行,具体方法参见文献[5-7]。
1.9 统计学方法
2 结果
2.1 大承气汤对ICH模型大鼠神经功能缺损的影响
ICH模型大鼠术后3 d时神经功能缺损情况有加重趋势,主要表现为平衡木实验得分明显增加和悬尾实验向左偏比率明显赠加。大承气汤可逆转ICH模型大鼠平衡木得分情况和向左侧偏屈现象,尤其在14 d时是神经功能缺损恢复的转折点(P<0.05)。结果见表1、2,其中除28 d时每组为5只大鼠外,其余时间段每组均为15只。
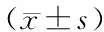
表1 大承气汤对ICH模型大鼠平衡木实验得分的影响Table 1 Effect of Dachengqi Decoction on the balance beam testresults in ICH
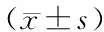
表2 大承气汤对ICH模型大鼠悬尾实验左偏比率的影响Table 2 Effect of Dachengqi Decoction on the left deviation ratio of the tail suspension test in ICH
2.2 大承气汤对ICH模型大鼠小胶质细胞和星形胶质细胞病理改变的影响
胶质细胞在ICH后呈何种变化是本研究关注的问题之一,因此接下来采用免疫荧光双重标记方法观察了各组采用不同方式干预后14 d和28 d时小胶质细胞和星形胶质细胞的情况。结果显示:与假手术对照组比较,ICH后小胶质细胞和星形胶质细胞均出现明显激活、聚集现象,表现为细胞数量的增加、细胞核的增大、突起变少等,且假手术对照组、模型组14 d与28 d比较无显著变化。大承气汤干预ICH模型大鼠14 d后上述现象明显逆转,28 d后进一步缓解。具体情况见图1,每组5只大鼠,每只选取出血灶周围不同的3个区域进行统计。
2.3 大承气汤对ICH模型大鼠炎性因子的影响
ICH后大承气汤对细胞因子的影响是我们接下来想探讨的问题,结合我们前期的实验数据及上述行为学和免疫荧光检测结果[5,7],选取了14 d时各组大鼠新鲜含尾壳核的脑组织,以ELISA法检测IL-1β和IL-10(分别作为促炎性反应和抗炎性反应的细胞因子)的水平。结果提示:模型组IL-1β和IL-10水平明显上升;大承气汤组IL-1β水平明显下降、IL-10水平明显上升,与假手术对照组和模型组相比差异均有统计学意义(P<0.05或P<0.01),表明大承气汤干预后能降低促炎性因子的水平并能增加抗炎性因子的水平,见表3。
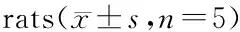
表3 大承气汤对ICH模型大鼠脑出血区IL-1β、IL-10水平的影响Table 3 Effect of Dachengqi Decoction on IL-1β and IL-10 in brain bleeding area of ICH
2.4 大承气汤对脑出血模型大鼠p38 MAPK信号通路的影响
p38属于丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路分子,在调节炎性介质方面发挥着重要作用。选取了14 d时各组大鼠新鲜脑组织匀浆,应用Western blot检测p38和P-p38的水平,结果显示:与对照组相比,模型组、大承气汤组p38水平均无明显变化;模型组的P-p38水平明显上升(P<0.01),大承气汤干预可逆转这种现象,见图2。
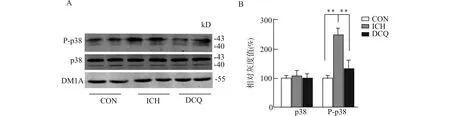
A:各组p38和P-p38的Western blot检测结果;B:各组Western blot条带相对灰度值统计结果(n=5),**P<0.01图2 大承气汤对ICH模型大鼠脑组织p38和P-p38水平的影响Fig.2 Effect of Dachengqi Decoction on p38 and P-p38 in brain tissues of ICH rats
3 讨论
ICH的病因病机概括起来,不外乎风、火、痰、气、虚、瘀六端。本病以肝肾阴虚为本,以风、火、痰、气、瘀为标,证属本虚标实。通腑法治疗中风早在《内经》、《伤寒论》诸书已有提示,张元素是最早使用通腑法之承气汤类方治疗中风的医家。王永炎则是主张中风急性期用通腑化痰法治疗的现代中医代表医家,其学术观点影响深远[8]。王老认为中风一病,乃为内风挟痰瘀阻滞脑窍,同时痰浊阻于中焦,郁而化热,因而腑气不通,浊气上逆,清浊相干,损及脑腑,致神机失用。有报道称痰热腑实证型占中风患者的74.17%[9],因此大承气汤治疗ICH不仅有充分的理论依据而且还有确凿的临床依据。
运动障碍是ICH的主要临床表现,也是神经功能受损的标志。本研究在平衡木实验中发现造模后ICH模型大鼠出现行动不稳、两侧肌力不对称、容易从平衡木上跌落等情况;悬尾实验则表现为患侧肌力减弱,头部向健侧歪斜比率增加。大承气汤干预后上述现象可得到明显改善,提示大承气汤可逆转ICH模型大鼠神经功能受损情况。
神经功能受损是ICH后的主要临床征象,同时因血脑屏障被破坏,血液中各种成分(如红细胞、白细胞、巨噬细胞和血浆蛋白质等)进入脑组织,继而会引发一系列炎症反应,包括小胶质细胞及星形胶质细胞激活[3,5,7,10]。小胶质细胞被大多学者认为是大脑中的巨噬细胞。生理情况下,小胶质细胞胞体很小、带有三级和四级分枝结构,常常被称为“静息态”小胶质细胞。“静息态”小胶质细胞并非静止不动,而是以一定频率与神经元突触发生直接接触以监测突触的功能状态,起着重要的免疫监视作用。当脑内发生炎症、感染、创伤、理化刺激或其他神经系统疾病时,小胶质细胞会迅速被激活,表现为胞体增大、突起变短、细胞形态呈杆状或“阿米巴”状,伴随形态变化时其功能也发生显著变化,即获得吞噬功能。ICH后激活的小胶质细胞获得吞噬能力,以清除红细胞、血肿和坏死脑组织,小胶质细胞这种形态和功能的改变对于减轻ICH的临床症状、改善预后非常重要[11]。同时学界认为星形胶质细胞在调节细胞代谢、形成和维护血脑屏障、产生和释放神经营养因子等方面起着重要作用。本团队既往研究发现ICH后小胶质细胞和星形胶质细胞均明显增多,且小胶质细胞相比于星形胶质细胞距离病变核心更近且早期伴随明显形态改变,提示小胶质细胞在ICH发生后可能比星形胶质细胞发挥更重要的作用[6-7]。本研究发现ICH后14 d时小胶质细胞和星形胶质细胞仍有明显增生、胞体较假手术对照组大,多并行存在,提示ICH后14 d时两者均起着协同调控作用。大承气汤干预后小胶质细胞和星形胶质细胞的数量均明显减少。
激活后的小胶质细胞可大致分成M1型和M2型2种,其中M1型小胶质细胞主要分泌促炎性反应(促细胞凋亡)的细胞因子(如IL-1β、IL-6、CD11b等),M2型小胶质细胞主要分泌抗炎性反应(促细胞存活)的细胞因子(如Arg-1、IL-10等)[12]。为了进一步探讨ICH后小胶质细胞功能的变化,本研究应用ELISA方法检测了IL-1β和IL-10水平。结果发现ICH后14 d时,IL-1β和IL-10水平均明显高于假手术对照组,提示此时大脑内炎性反应明显且小胶质细胞被激活后开始分泌抗炎性细胞因子;大承气汤干预后IL-1β的水平明显下降,IL-10水平则进一步明显上升,与正常组和ICH组相比差异均有统计学意义,提示大承气汤可抑制促炎性细胞因子的生成,同时可促进抗炎性细胞因子的生成与释放。
研究表明,小胶质细胞激活相关的神经炎性信号通路主要有Notch信号通路、Toll样信号通路、MAPKs信号通路、NF-κB信号通路、JAK-STAT信号通路等。关于大承气汤在逆转上述现象时可能涉及何种分子机制,研究表明IL-1β主要由单核细胞和巨噬细胞产生,并由先天性免疫细胞在炎性损伤中表达。IL-1β在慢性炎症中过表达时还可通过与血管内皮细胞生成因子(VEGF)间的细胞信号转导相互作用促进血管生成。IL-10是炎性反应后产生较晚的细胞因子,其特殊的生理意义表现为防止过度的免疫应答而将继发性损伤局限化,IL-10在各种神经受损后常常上调。各种内源性和外源性介质作用并激活单核巨噬细胞可致其分泌IL-10,当T细胞受体接受刺激并激活ERK1和ERK2 MAPKs激酶时亦分泌IL-10,同时,c-Maf转录因子的表达亦与IL-10的分泌相关。p38 MAPK属于丝/苏氨酸蛋白激酶,主要参与细胞的早期信号识别,从而在细胞基因表达调控、炎症反应和凋亡中发挥着重要作用。研究表明,LPS可通过激活p38而活化小胶质细胞,并促进IL-1的释放,腺苷酸环化酶激活肽可特异性地抑制该反应。同时研究表明Toll样受体(TLRs)在作为抵御感染的第一道防线中识别病原体来源时发挥着至关重要的作用,p38对调节TLR2配体中IL-10的表达非常关键,是TLR2配体激活诱导巨噬细胞转化为M2型并调控下游分子表达,而非TLR4激活诱导其转化为M1型后发挥作用,该调节与丝裂原活化蛋白激酶磷酸酶-1(Mitogen-activated protein kinase phosphatase-1,MKP-1)的调控有关[13]。我们的实验结果提示ICH时P-p38的活性明显增加,大承气汤可有效地逆转P-p38水平上升。
因此我们推测:ICH后小胶质细胞起着双重调控作用。此外,临床中提倡的长期抑制小胶质细胞作用并非完全有益,因为这种长期抑制作用可能潜在终止了小胶质细胞对坏死组织、细胞碎片的吞噬作用,同时可能会抑制其分泌抗炎因子、神经营养因子等具有神经保护作用的细胞因子[14]。由此可见,小胶质细胞的激活在ICH后是该抑制还是该促进这一问题尚无定论。因此,ICH后小胶质细胞的激活及IL-1β、IL-10的生物学功能还需进一步深入研究。
综上所述,我们的研究证实了大承气汤能显著改善ICH后大鼠神经功能缺损情况,可能涉及大承气汤调节小胶质细胞的功能、减少促炎性细胞因子IL-1β的生成、促进抗炎性细胞因子IL-10的合成与释放等作用,这些作用的实现与p38 MAPK信号通路抑制有关。同时提示ICH后小胶质细胞可能起着双重作用,一方面小胶质细胞的活化会促进促炎性细胞因子的产生从而加重炎性反应,另一方面又会发挥吞噬细胞碎片、促进抗炎性细胞因子的产生。如何找准大承气汤干预ICH时小胶质细胞作用的平衡点,尽可能利用其有利的方面并规避有害的部分是我们需要进一步关注的焦点。
