双配体配位的Ni(Ⅱ)、Cu(Ⅱ)金属配合物的结构和性能
2022-01-14代思玉刘宇奇李杨华王新颖张青青
代思玉,刘宇奇,李杨华,王新颖,李 玮,2,张青青
(1.昆明理工大学理学院,昆明 650500;2.昆明理工大学冶金与能源工程学院,昆明 650093)
0 引 言
近年来,由金属离子/簇和有机配体构成的金属有机框架材料(metal-organic frameworks,MOFs)在多孔晶体框架材料研究领域里备受关注。在过去的20年里,MOFs在能量和气体存储[1-2]、药物运输[3-4]和分子识别[5]等领域展现出优异的性能。结构决定性质,MOFs出色的应用性能主要来源于其固有的多孔结构和高度可调的孔隙环境[6-7]。因此,通过采用具有不同官能团的多个配体来组装复杂、有序且具有潜在应用价值的MOFs,仍然是该领域里的一个重要研究方向[8-9]。
为了构建出结构新颖、性能独特的孔隙空间,将不同长度和不同官能团的有机配体组合起来,希望能够设计出具有潜在应用价值的MOF材料。现如今,使用柔性N-杂环配体和多羧酸配体的混合配体合成新型 MOFs 已经成为一种行之有效的方法[10]。N-杂环配体是构建具有精美结构和特殊物理化学性质MOFs 的理想连接体,N-杂环单元中的氮原子不仅能够与过渡金属原子之间形成刚性配位键,还可以与框架内的其他组件和溶剂中的自由 H2O分子构建复杂的氢键系统。另外,N-杂环有机配体也可以作为质子源,制备具有较强质子传导的MOFs[11-13]。
在诸多N-杂环有机配体中,双氮唑及其衍生物作为高度通用的有机连接体,能够结合咪唑多配位模式的优点,来构建框架结构复杂多样的MOFs[14]。例如:1,4-双(咪唑基-1-甲基)苯(p-bix)是一类配位灵活性较强的多功能N-杂环配体,配体中苯环和咪唑之间的—CH2—连接基可通过自由旋转来实现配合物的顺反配位模式。但相比之下,脂肪类咪唑衍生物1,1’-(1,4-丁二基)二咪唑 (bbi)配体中烷基—(CH2)n—间隔基是良好的辅助N-给体配体,具有很强的弯曲和旋转能力,并且没有苯环刚性骨架的支撑,多个灵活的—CH2—更容易通过各式各样的堆积方式来构建丰富的结构类型[15-18]。
此外,在MOFs的设计组装过程中,作为具有多个配位点的羧酸衍生物也是一类理想的连接体,极强的配位能力、灵活多变的配位方式和优异的环境适应性,使得羧酸配体在MOFs的自组装过程中不可或缺[19-21]。5-硝基间苯二甲酸(5-H2NIP)作为一种具有代表性的二羧酸有机配体,其N、O原子不仅可以为金属有机配合物的组装提供丰富的配位位点,还可以利用两种原子之间的配位能力差异来制备含有单一金属或混合金属的MOF。另外,—NO2的存在有利于氢键的形成,从而促进超分子网络结构的构建[22-24]。不仅如此,灵活的脂肪族多元羧酸配体也早已被广泛用于配位聚合物的构建,例如,3,3-二甲基戊二酸 (H2dmg)可以为中心金属离子提供四个潜在的配位供体,同时还可作为灵活的阴离子连接体用于设计组装金属有机框架材料,在组装过程中,H2dmg通过羧酸盐氧原子桥接金属离子,形成不同维度、结构新颖的晶体框架材料[25-28]。
鉴于以上配体优异的性能,选择双氮唑及其衍生物配体1,4-双(咪唑基-1-甲基)苯、1,1’-(1,4-丁二基)二咪唑,同时引入多羧基配体5-硝基间苯二甲酸和3,3-二甲基戊二酸作为混合配体,共同组装出两种新型配位聚合物{Ni(nip)(p-bix)(H2O)2}n(1)(CCDC:2106024)和{Cu(bbi)(dgc)}n(2)(CCDC:2105929)(nip=5-硝基间苯二甲酸;p-bix=1,4-双(咪唑基-1-甲基)苯;bbi=1,1’-(1,4-丁二基)二咪唑;dgc=3,3-二甲基戊二酸),并对其结构、热稳定性能和磁学性能进行了研究。四种配体的分子式如图1所示。
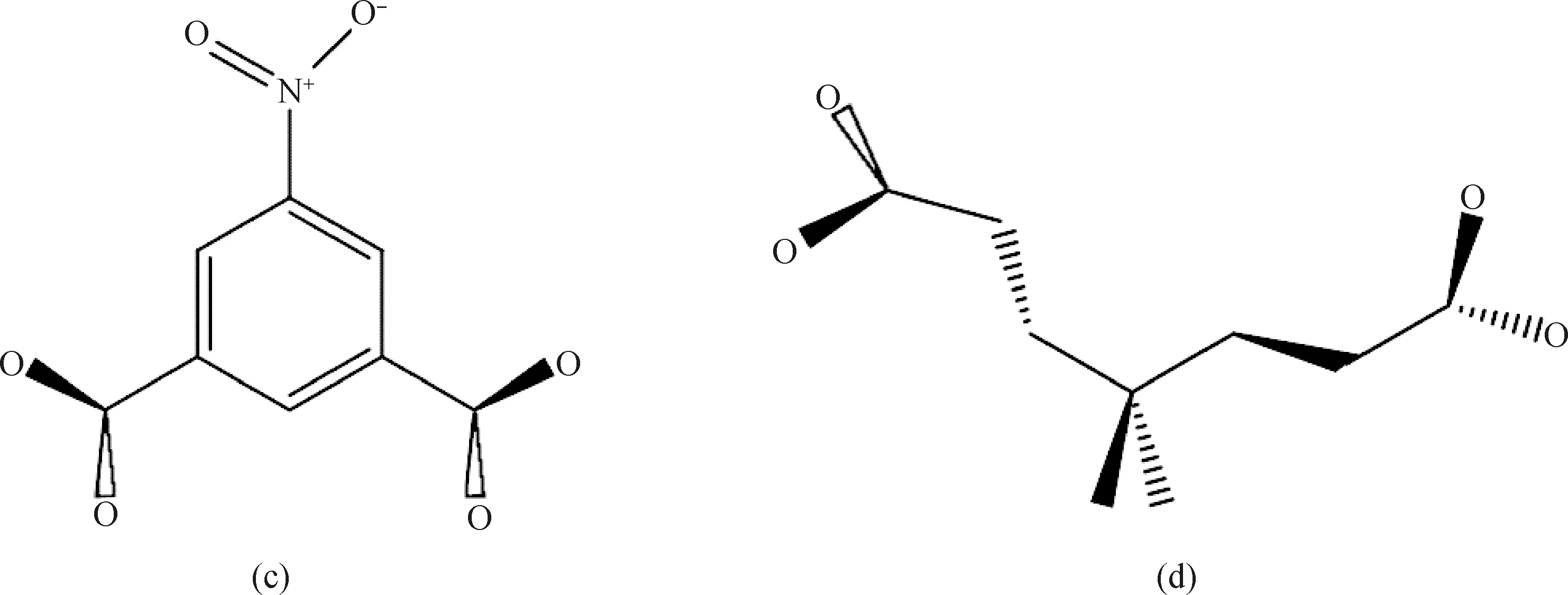
图1 四个配体的结构图。(a)1,4-双(咪唑基-1-甲基)苯(p-bix);(b)1,1′-(1,4-丁二基)二咪唑 (bbi);(c)5-硝基间苯二甲酸(5-H2nip);(d)3,3-二甲基戊二酸 (H2dgc)Fig.1 Structures of four ligands.(a)1,4-bis(imidazolyl-1-methyl)benzene (p-bix);(b)1,1′-(1,4-butanediyl)diimidazole (bbi);(c)5-Nitroisophthalic acid (5-H2nip);(d)3,3-Dimethylglutaric acid (H2dgc)
1 实 验
1.1 试剂及仪器
Ni(NO3)2·6H2O、CuCl2·2H2O、5-硝基间苯二甲酸、3,3-二甲基戊二酸均为市售分析纯试剂,使用前未经处理。
DZ-1 型搅拌器;AVATAR FT-IR 360 型红外光谱仪;DHG-2050C 电热鼓风干燥箱;GmbH VarioEL 型元素分析仪;Bruker SMART 1000 CCD 单晶衍射仪;Bruker D8 Advance 型 X 射线粉末衍射仪;MPMS (SQUID)-XL型磁测量系统。
1.2 实验过程
1.2.1 配体p-bix及bbi 的合成
p-bix (1,4-双(咪唑基-1-甲基)苯)按照文献[29]方案合成,产率约为35.2%。元素分析(质量分数,%,C14H14N4)理论计算值:C,70.59%;H,5.88%;N,23.53%。实验值:C,70.56%;H,5.90%;N,23.51%。
bbi(1,1’-(1,4-丁二基)二咪唑)按照文献[30]方案合成,产率约72%。元素分析(质量分数,%,C10H14N4)理论计算值:C,63.16%;H,7.37%;N,29.47%。实验值为:C,62.93%;H,7.51%;N,29.54%。
1.2.2 配合物的合成
配合物{Ni(nip)(p-bix)(H2O)2}n(1)的合成:将0.15 mmol 5-硝基间苯二甲酸(5-nip)、0.4 mmol NaOH、0.1 mmol p-bix和0.2 mmol Ni(NO3)2·6H2O分别溶于3 mL水中,混匀后再转移至25 mL高压反应釜中,120 ℃下恒温晶化4 d,然后以5 ℃/h的速率程序降温至室温,最终得到绿色块状晶体1,产率为74.2%(基于 Ni 的计算值)。{Ni(nip)(p-bix)(H2O)2}n的元素分析结果(%):理论计算值(C,48.74%;H,3.87%;N,12.91%);实验值(C,48.61%;H,4.03%;N,12.27%)。FT-IR的主要数据(KBr压片,cm-1):3 674(m),1 616(s),1 562(s),1 451(s),1 361(s),201(s),165(m)。
配合物{Cu(bbi)(dgc)}n(2)的合成:将溶解于3 mL水的3,3-二甲基戊二酸(H2dgc)(0.28 mmol)、bbi(0.28 mmol)和CuCl2·2H2O(0.28 mmol)溶液混合搅拌10 min,后加入0.55 mL 1 mol/L的氢氧化钠溶液,后续步骤与配合物1一致,最后得到蓝色块状晶体2,产率为82.7%(基于Cu的计算值)。{Cu(bbi)(dgc)}n的元素分析结果(%):理论计算值(C,49.52%;H,5.83%;N,13.59%);实验值(C,48.76%;H,5.27%;N,13.85%)。FT-IR的主要数据(KBr压片,cm-1):3 125(w),2 955(m),1 630(m),1 519(s),1 383(s),1 238(m),935(w),739(m)。
1.3 配合物的结构解析
在240.00(10)K下用 Bruker-ER SMART 1 000 CCD 型衍射仪,以石墨单色Cu Kα(λ=0.154 184 nm)为辐射源,ω/2θ为扫描方式,对配合物1和2进行衍射实验,后续的全部强度数据经Lp因子矫正和半经验吸收矫正。数据处理过程中,使用 SAINT 程序和SHELXTL-97程序分别对晶体数据进行还原精修和结构解析,对全部非氢原子坐标及其各向异性热参数进行了全矩阵最小二乘法修正[31],配合物1和2的晶体学参数如表1所示,部分键长键角数据如表2所示。
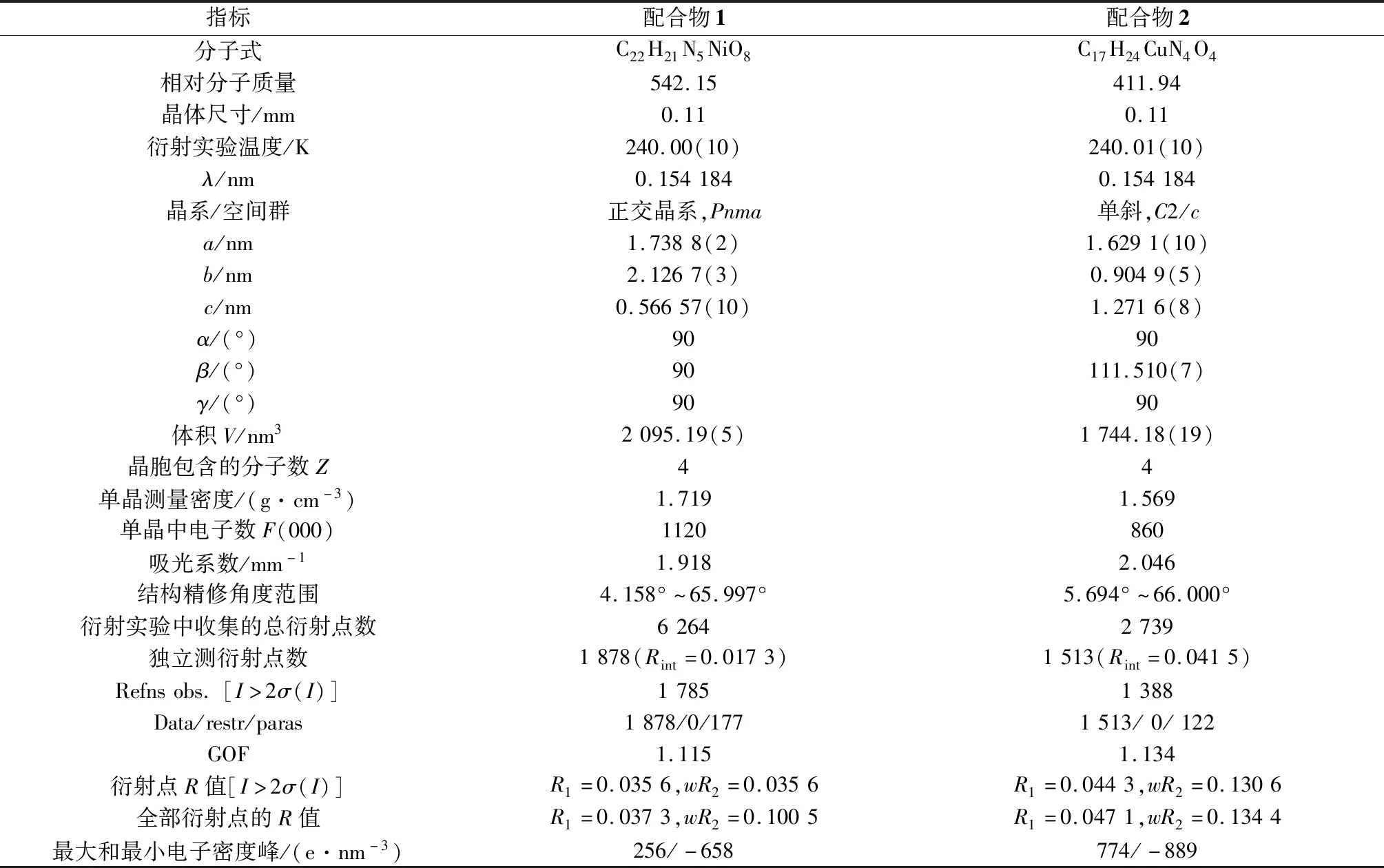
表1 配合物1、2的晶体学参数和测定数据Table 1 Crystallographic data and structural refinements for complexes 1 and 2
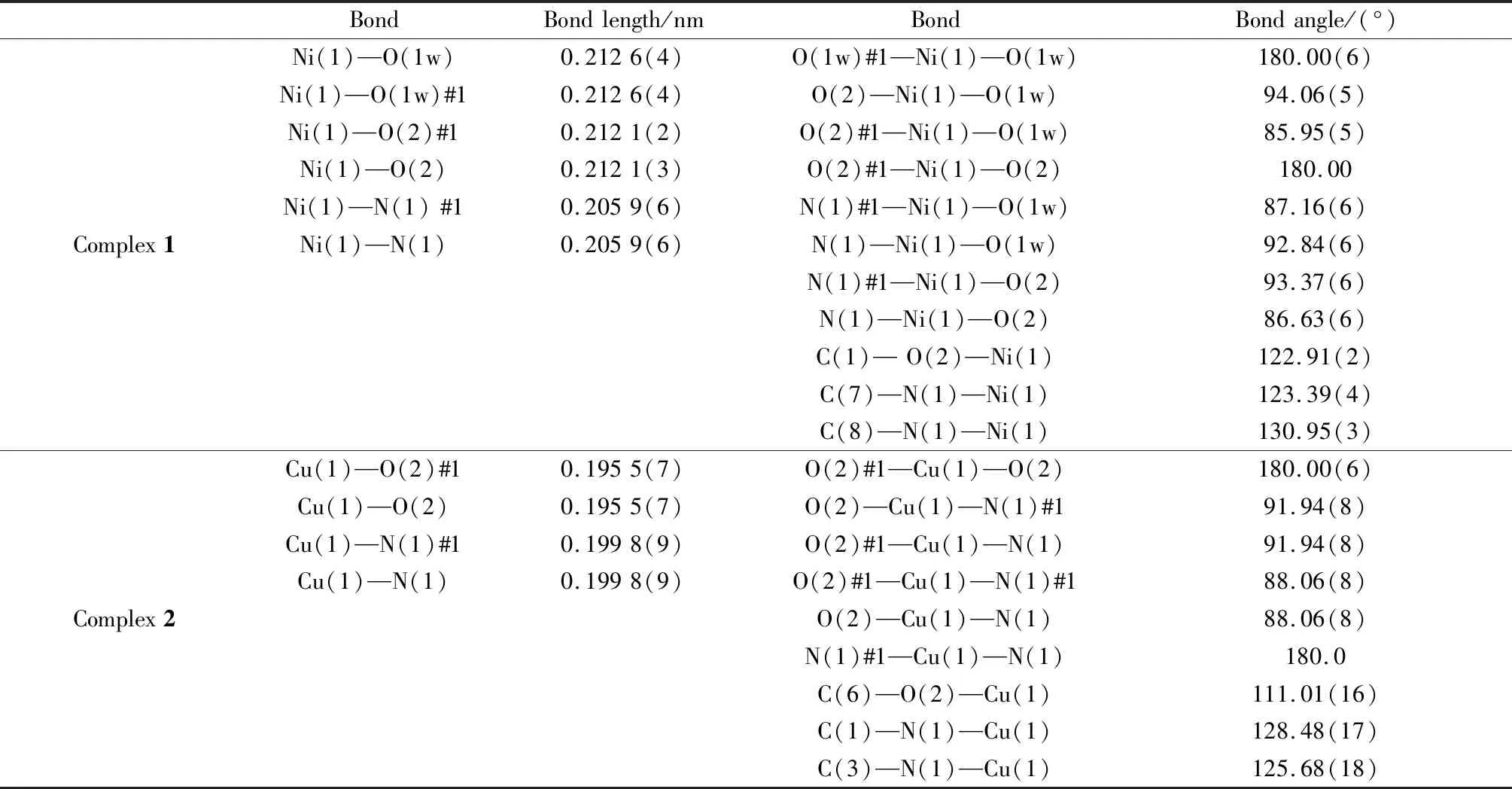
表2 配合物1、2的部分键长和键角Table 2 Selected bond lengths and angles for the complexes 1 and 2
2 结果与讨论
2.1 配合物的晶体结构分析
配合物1是由两种芳香族化合物——咪唑和羧酸类配体与Ni(Ⅱ)自组装形成的一维晶体骨架材料。单晶 X 射线衍射结果表明,配合物1属于正交晶系,Pnma空间群。该配合物的不对称结构单元是由两分子去质子化的5-nip、两个结晶水分子,以及两分子p-bix构成,配位环境图如图2(a)所示。Ni(Ⅱ)中心是由5-硝基间苯二甲酸的氧(O2,O2 A),水分子中的氧(O1W,O1W A)以及p-bix中的氮(N1,N1 A)构成的扭曲八面体几何构型。4个Ni—O键的键长在0.212 1~0.212 7 nm之间,而Ni-N键的键长为0.205 9 nm,围绕Ni的配位角在85.95°~180.00°范围内。
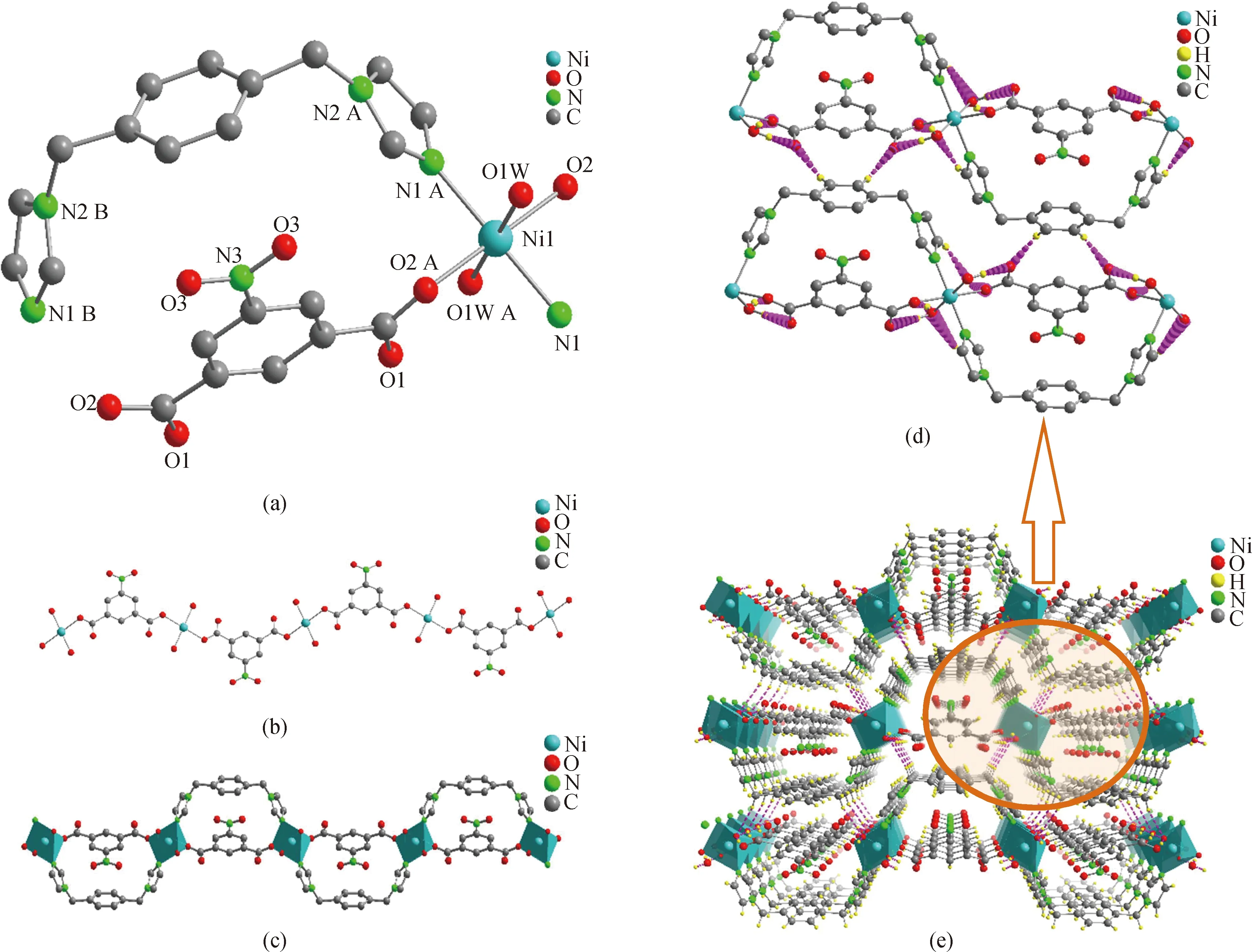
图2 配合物1的(a)配位环境图;(b)羧酸配体连接的一维链;(c)N、O双配体形成的一维双链;(d)氢键展示图;(e)分子间氢键拓展的三维超分子网络结构图。(除(d)、(e)图外,所有的氢原子已被省略)(对称操作:A=1-x,1-y,2-z;B=1-x,-1/2+y,2-z)Fig.2 (a)Coordination environment map;(b)one-dimensional chain linked by carboxylic acid ligand;(c)one-dimensional double chain formed by N and O double ligands;(d)diagram of hydrogen bonds;(e)three dimensional topography with hydrogen bonds of complex 1.(Except for figures (d)and (e),all hydrogen atoms have been omitted)(Symmetric code:A=1-x,1-y,2-z;B=1-x,-1/2+y,2-z)
如图2(b)所示,5-nip中的羧酸O原子通过μ2-η1∶η1桥连模式连接相邻的两个Ni(Ⅱ)离子,在b轴上延展形成一维羧酸链,p-bix中的末端N原子沿着这个一维羧酸链一上一下呈S型反式连接两个相邻的Ni(Ⅱ)离子,最终形成具有规则有序孔洞的双股一维链状结构(见图2(c))。值得一提的是,配合物1中一维双股链与链之间通过羧酸配体和配位水分子之间的O1W—H1W…O2#1(对称操作:#1=1-x,1-y,2-z)氢键以及p-bix配体中苯环和咪唑环与羧酸配体之间的氢键(C8—H8…O1 W#1、C11—H11…O1W#1)连接,最终构建成三维超分子网状结构,见图2(d)、2(e)。相应的氢键键长和键角数据如表3所示。从三维超分子网状结构看(见图2(e)),羧酸配体与氮配体之间形成了有序的封闭孔洞结构,赋予了该配合物较大的比表面积。另外,孔洞结构里还包裹着电负性极强的—NO2,在气体吸附领域具有巨大的潜在应用价值[32]。不仅如此,配合物1没有庞大的框架结构,在离子传导过程中,可以缩短电荷传输路径,提高离子的传输效率[33]。
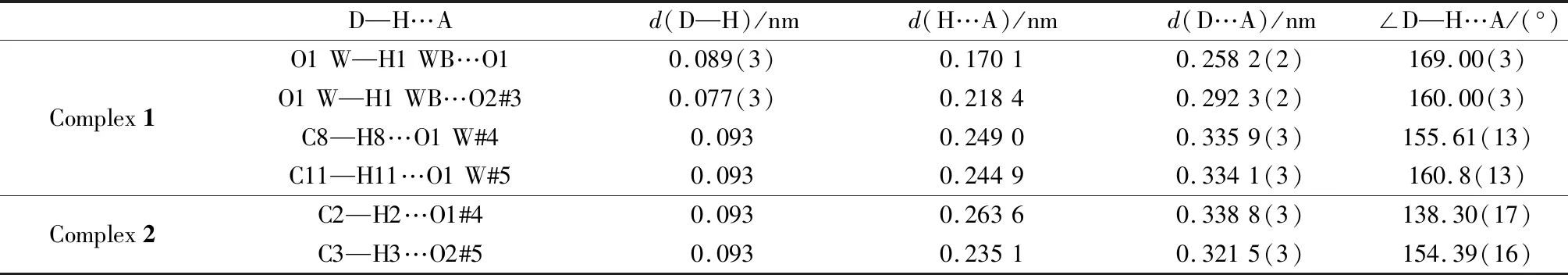
表3 配合物的部分氢键的键长和键角Table 3 Selected H bond distance and angle for complexes
配合物2属于单斜晶系,C2/c空间群,其非对称结构单元中包含一个 Cu(Ⅱ)离子,两个完全去质子化的3,3-二甲基戊二酸和两个bbi分子。如图3所示,在该配合物中,Cu(Ⅱ)离子为四配位,与两个羧酸配体3,3-二甲基戊二酸中的两个O原子(O2、O2 A)和两个bbi配体中的端基N原子(N1、N1 A)形成近似的平面四边形结构,围绕Cu中心的配位角在88.06°~180.00°范围内,详细数据如表2所示。羧酸配体3,3-二甲基戊二酸的O原子通过μ2-η1∶η1桥连模式连接相邻的两个Cu(Ⅱ)离子形成波浪状的一维羧酸链(见图4(a)),柔性配体bbi沿着不同的方向反式连接Cu(Ⅱ)离子形成纵横交错的一维Cu-bbi链(见图4(b))。这些纵横交错的一维Cu-bbi链和一维羧酸链彼此交联穿插,最终形成精美的三维结构,如图4(c)。此外,丰富的氢键作用力又巩固了该三维骨架结构(见图4(d))。从拓扑学角度来看,每个Cu(Ⅱ)离子以四连接模式在上下方向借助于羧酸配体、前后或水平方向借助于bbi配体将周围的Cu(Ⅱ)离子连接起来,呈现规则的三维框架,其拓扑符号表征为{65·8},如图4(e)所示(图中小球代表Cu(Ⅱ);长横线代表p-bix配体;短横线代表羧酸配体3,3-二甲基戊二酸)。结合三维结构图和拓扑图来看,配合物2通过混合配体螺旋式的盘绕也呈现出规则的孔洞结构。
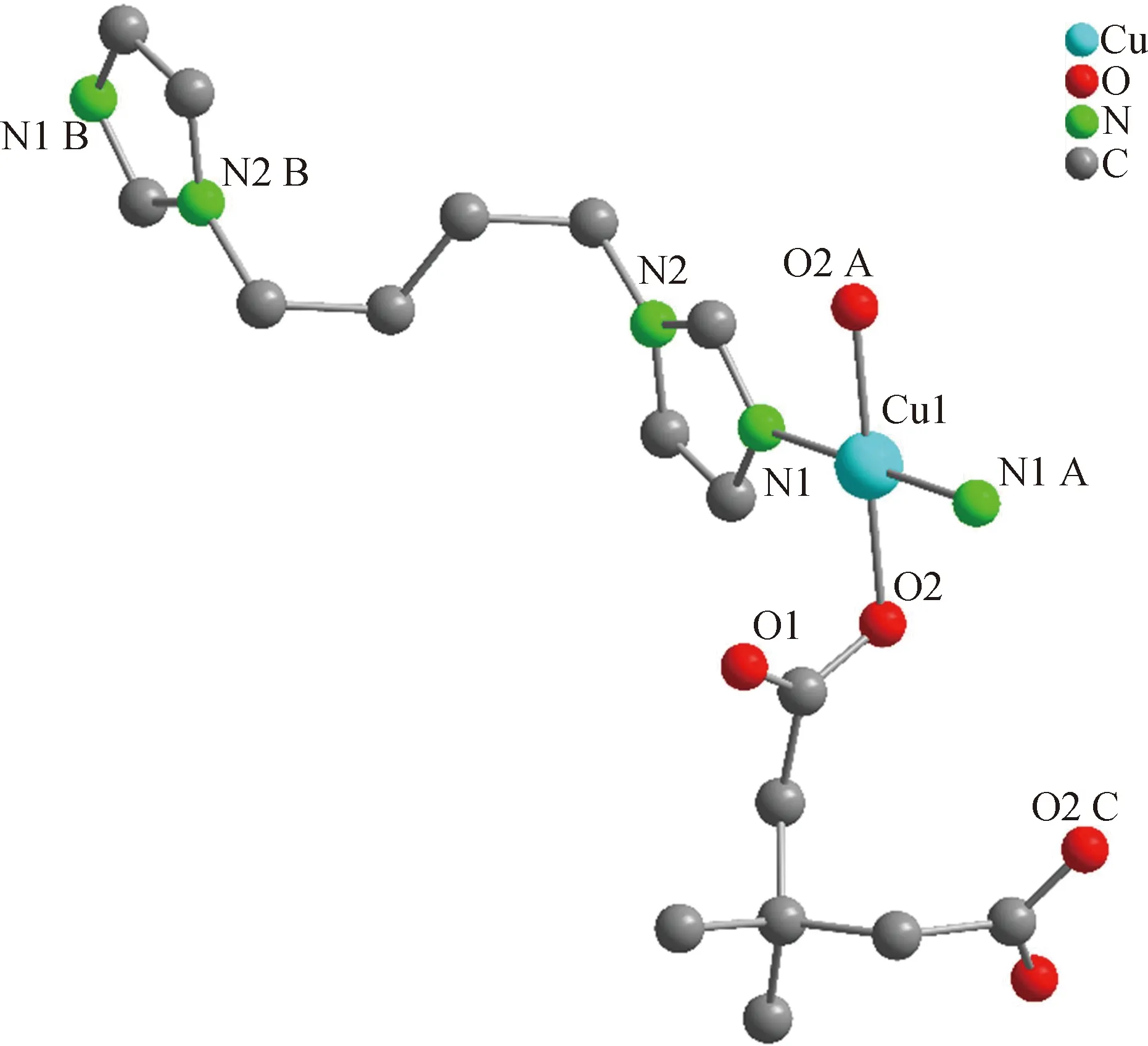
图3 配合物2的配位环境(所有的氢原子已被省略)(对称操作:A=1-x,-y,1-z;B=1/2-x,1/2-y,-z;C=1-x,y,3/2-z)Fig.3 Ligand environment of complex 2 (all hydrogen atoms have been omitted)(Symmetric code:A=1-x,-y,1-z;B=1/2-x,1/2-y,-z;C=1-x,y,3/2-z)
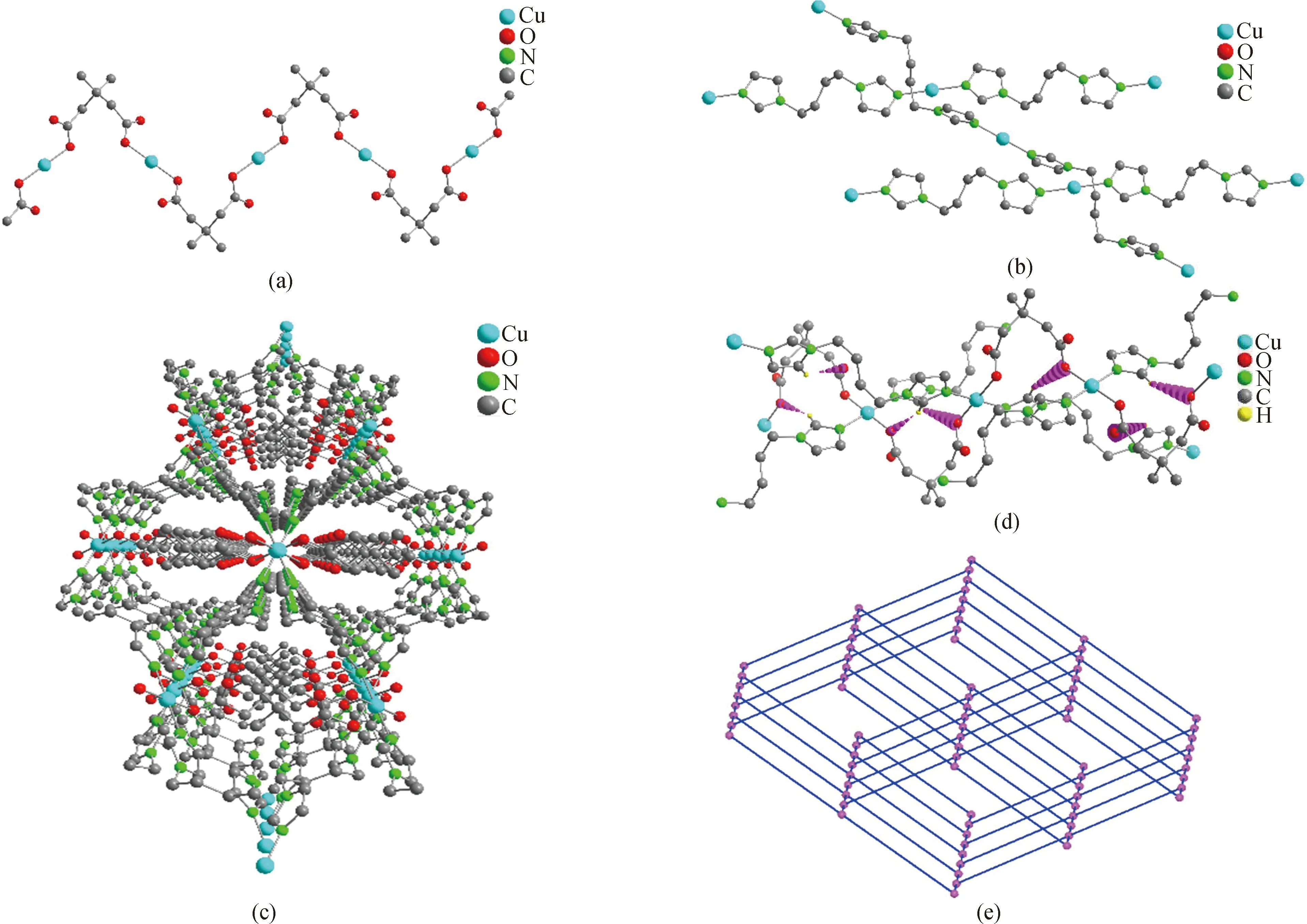
图4 配合物2的(a)羧酸配体形成的一维“S”形链状结构;(b)N配体连接的交错一维链;(c)三维结构图;(d)氢键展示图;(e)拓扑结构图。(除(d)图外,所有的氢原子已被省略)Fig.4 (a)One-dimensional “S”shaped chain structure formed by carboxylic acid ligands;(b)staggered one-dimensional chain linked by N ligands;(c)three-dimensional structure;(d)diagram of hydrogen bonds;(e)topological structure diagram of complex 2.(Except for fig.(d),all hydrogen atoms have been omitted)
2.2 配合物的 X 射线粉末衍射分析
为了检查后续合成结晶产物的相纯度和均匀性,在室温下对配合物进行粉末 X 射线衍射(PXRD)实验,收集的数据与晶体结构的XRD理论模拟数据进行对比。如图5所示,实验所测PXRD图谱与模拟谱图的峰位置重合度较高,表明配合物具有良好的相纯度。另外,从图中可以明显看出,配合物1的峰强度比模拟值大,说明配合物1的结晶度要高于模拟值。然而,在配合物2的实验所测PXRD图谱中,可以发现10°位置的峰略微向较低的2θ角位置偏移,这可能是由于样品在处理过程中有离子半径较大的杂质掺杂,从而导致局部晶格畸变,最终使得个别衍射峰向低角度位置偏移[34]。

图5 配合物Ni和Cu的XRD图谱Fig.5 XRD patterns of complexes Ni and Cu
2.3 配合物的热重分析
在 N2气氛下,对两个配合物进行热重测试 (TGA)以研究其热稳定性 (见图6)。配合物1和2均显示了两步失重。从98 ℃开始,配合物1开始第一步失重,失重率为6.48%(计算值为6.64%),此时的Ni中心由于失去了两个配位水分子而达到配位不饱和状态。配合物2的第一次质量损失出现在184~370 ℃温度范围内,失重率为47.0%(计算值为46.1%),可归因于有机配体bbi从分子骨架中断裂。针对配合物1,在320~642 ℃温度范围内,进行第二步失重,损失的总量达到88.3%(理论计算值为86.2%),归因于有机骨架的分解,最后形成相应的氧化物(NiO)。对于配合物2,在420~516 ℃温度范围内,继续失重,重量损失总量为86.2%(理论计算值为80.7%),这归因于配合物2中有机配体dgc骨架的坍塌,最后也形成相应的氧化物(CuO)。纵观两个配合物2的失重情况,配合物1的整体框架只能稳定到98 ℃,配合物2则可以达到180 ℃,所以配合物2的热稳定性高于配合物1。

图6 配合物1和2的TGA曲线Fig.6 TGA curves of complexes 1 and 2
2.4 配合物的磁性分析
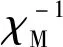

图7 配合物1和2的χM、χMT以及χM-1对温度T变化曲线Fig.7 Temperature dependences of χM,χMT and χM-1 of complexes 1 and 2
配合物1中,当T=300 K时,χMT=1.069 cm3·K·mol-1,比预期唯自旋情况下的Ni2+(S=1,g=2.0)的χMT值(1.000 cm3·K·mol-1,2.828 μB)略大,随温度T逐渐降低,χMT值缓慢增加,当T为22.87 K时,χMT值随着温度T的降低而减小,直到减小至1.091 cm3·K·mol-1(T=10.53 K)。在T=10.53~9.65 K区间内,χMT又随T的减小而增加,并达到最大值,为1.140 cm3·K·mol-1。而后,随着T的逐渐下降,χMT值急剧降低,最后达到最小值0.592 cm3·K·mol-1(T=2 K)。配合物1的这种磁性行为可能是由于Ni(Ⅱ)的零场分裂能和远离的Ni(Ⅱ)的弱的铁磁性耦合的竞争造成的[35]。
在300 K时,配合物2的χMT值为0.28 cm3·K·mol-1,该值略低于室温时独立自旋的Cu(Ⅱ)离子的χMT值(0.38 cm3·K·mol-1,S=1/2,g=2.0)。随着温度的降低,χMT值缓慢增大,当T=14.38 K时,χMT值增大到最大值,为0.385 cm3·K·mol-1。自14.38 K开始,随着温度的降低,χMT值开始急剧降低,当温度T下降到1.99 K时,该值也迅速降低到一个较小值,为0.304 cm3·K·mol-1。
用简单现象方程对配合物2的磁性数据进行非线性拟合,方程如下:
χM=[Aexp(-E1/kT)]/T+[Bexp(-E2/kT)]/T
(1)
式中:A+B等于居里-外斯常数,E1、E2分别对应于自旋-轨道耦合和磁交换相互作用的激活能量。在该配合物中,拟合得到:A=0.356 3 cm3·K·mol-1,B=0.039 0 cm3·K·mol-1,E1/k=0.90 K,E2/k=-1.42 K,R=3.3×10-4。(R=Σ[(χM)obs-(χM)calc]2/Σ[(χM)obs]2)。E2/k为负值进一步证明了配合物2存在铁磁性相互作用。
3 结 论
本文通过水热合成技术设计组装出两个以咪唑和二羧酸为混合配体的MOF材料:{Ni(nip)(p-bix)(H2O)2}n(1)和{Cu(bbi)(dgc)}n(2)(nip=5-硝基间苯二甲酸;p-bix=1,4-双(咪唑基-1-甲基)苯;bbi=1,1′-(1,4-丁二基)二咪唑;dgc=3,3-二甲基戊二酸)。经结构分析和多种性质表征可以得出如下结论:
(1)两个配合物均借助于双氮唑配体形成一维链,在配合物1中,这些一维链都是统一朝向一个方向的,而在配合物2中,一维链则是交错排列成两个不同方向。此外,两个配合物中,羧酸配体中的O原子均通过μ2-η1:η1桥连模式连接相邻的两个金属离子形成一维羧酸链。仔细分析,配合物1中的双氮唑配体的末端N原子沿着这个一维羧酸链一上一下呈“S”型反式连接两个相邻的金属离子,最终形成具有规则有序孔洞的双股一维链状结构。而配合物2中,羧酸配体沿着同一方向继续连接两个不同方向的一维双氮唑配体一维链,最终拓展成具有规则有序孔洞的三维拓扑结构。再者,两个配合物中均含有丰富的分子氢键作用力。配合物1借助于氢键作用力最终拓展成三维超分子结构,配合物2中的氢键则巩固了其三维拓扑结构。
(2)热稳定性研究表明,配合物1的整体框架只能稳定到98 ℃,配合物2则可以达到180 ℃,配合物2的热稳定性高于配合物1。
(3)磁学性质研究则发现,配合物1和2都具有弱的铁磁性,在测定的温度范围内对测试的变温磁化率数据进行居里-外斯线性拟合得到它们的居里-外斯温度分别为1.73 K和6.78 K。
