铝源种类对熔盐法制备超细ZnAl2O4粉体的影响
2022-01-14黄德鹏刘江波付应文周振鹏
黄德鹏,许 欢,刘江波,付应文,周振鹏
(1.九江学院材料科学与工程学院,九江 332005;2.浙江自力高温科技股份有限公司,绍兴 312000)
0 引 言
锌铝尖晶石(ZnAl2O4)属于尖晶石类化合物,其结构通式为AB2O4,空间群为Fd3m,属立方晶系[1]。由于其独特的结构,ZnAl2O4表现出诸多优异的物化性能,如硬度大、熔点高(1 950 ℃)、抗化学腐蚀能力强、热膨胀系数低(25~900 ℃,7.0×10-6/℃)、导热性好、绝缘性好以及抗碱性熔渣作用强等[2]。ZnAl2O4的带隙宽度为~3.8 eV,属于直接宽禁带半导体材料,这决定了ZnAl2O4对波长大于320 nm的可见光具有较好的透过性[3]。另外,以ZnAl2O4作为半导体基体,通过离子掺杂可以灵活调节其光学、磁学以及其他性质。因此,ZnAl2O4被广泛应用于高温耐火材料、催化剂、传感器、半导体、光电材料以及透明陶瓷等领域[4]。
高活性粉体的制备是ZnAl2O4陶瓷材料生产过程中的一个重要环节[5]。目前,合成ZnAl2O4粉体的方法主要有固相反应法[6]、共沉淀法[7]、微波辅助水热法[8]、溶胶凝胶法[9]以及溶液燃烧法[10]等。上述制备方法均存在或多或少的缺陷。例如:传统固相反应法合成温度高,反应时间长,反应结束后还需要进行球磨,既耗时又耗能;共沉淀法对原料纯度要求较高,反应条件不易控制,容易造成局部浓度过高而引发团聚,并且阴离子清洗困难;水热法反应时间长,而且高压环境存在着一定的安全隐患,因此对设备要求苛刻;溶胶凝胶法原料昂贵、工艺复杂、生产周期较长,且反应中常常伴有毒性气体产生;溶液燃烧法过程不易控制,产物粒径分布不均匀。而熔盐法是一种简单易行、可重复性高的无机材料粉体制备方法,具有合成温度低、反应时间短、合成粉体纯度高、粒径小等优点,并且可以通过改变熔盐种类和含量等来控制产物的形貌,因此具有广阔的应用前景[11]。近年来,熔盐法逐渐被引入到尖晶石类陶瓷粉体的合成研究。例如Safaei-Naeini等[12]以KCl为熔盐介质,在850 ℃合成出纳米镁铝尖晶石粉体,发现其合成温度比传统方法降低约500 ℃。还有学者将熔盐法用于合成ZnAl2O4粉体。其中,Li等[13]研究了熔盐种类、合成温度等对熔盐法制备ZnAl2O4粉末的影响,结果表明在LiCl熔盐介质中加热至700 ℃时即开始生成ZnAl2O4相,在1 000 ℃保温3 h即可完成反应,生成单相ZnAl2O4。而在NaCl和KCl的熔盐中,反应开始温度和完成时温度分别推迟100 ℃和50 ℃。原料的种类、纯度、粒径大小与分布以及其在熔盐中的溶解度对熔盐法合成ZnAl2O4粉体具有重要的影响。但是,关于铝源种类对熔盐法合成ZnAl2O4粉体的影响方面的研究工作却鲜有报道。
基于此,本文开展了熔盐法制备超细ZnAl2O4粉体的研究,重点研究了铝源种类对产物粉体的物相组成、显微形貌以及性能的影响,同时探讨了合成温度和熔盐含量对粉体合成的影响,以期为高性能ZnAl2O4粉体的制备提供理论和实验上的参考。
1 实 验
本实验所用原料主要有:ZnO(纯度≥99%,质量分数),Al(OH)3(纯度≥99%,质量分数),纳米氧化铝(纯度≥99.5%,质量分数),煅烧活性氧化铝(纯度≥99.4%,质量分数),NaCl(颗粒尺寸<1 mm,纯度≥99.5%,质量分数),KCl(颗粒尺寸<1 mm,纯度≥99.5%,质量分数),LiCl(粒度<2 mm,纯度≥95%,质量分数)等。
熔盐法制备ZnAl2O4粉体的工艺流程如下:先将ZnO和不同铝源按ZnAl2O4的理论化学计量比配料。将LiCl和 KCl按摩尔比1∶1配制LiCl-KCl混合熔盐,为了研究熔盐含量对ZnAl2O4粉体合成的影响,将熔盐和原料按质量比(Wsalt/Wraw material,以下均简写为Ws/Wr)1∶1、2∶1、3∶1、4∶1混合。将称量好的原料放入行星式球磨罐中,加入适量酒精,以刚玉球为研磨介质,球料比为10∶1。湿混3 h后取出料浆,置于 110 ℃恒温干燥箱中干燥24 h。称取8 g混合物放入带盖的刚玉坩埚中,置于箱式电阻炉内,按5 ℃/min的速率升温至800~1 200 ℃保温3 h。待试样自然冷却后,用去离子水对反应产物进行反复洗涤、抽滤,最后干燥得到ZnAl2O4粉末试样。
采用Bruker公司生产的型号为D8 Advance的X射线衍射仪对试样进行物相分析,扫描角度2θ=10°~80°,步长0.013°,管电压35 kV,管电流35 mA;采用Tescan-VEGAIIRSU型扫描电子显微镜观察产物的微观形貌,并通过牛津仪器公司生产的型号为X-ACT的X射线能量散射谱(energy dispersive X-ray spectroscopy,EDS)进行微区元素分析。采用Autosorb-1-MP/LP 型全自动比表面积分析仪,利用BET多点法测定粉体的比表面积。采用Mastersizer2000型激光粒度分析仪对合成产物进行粒度分析。
2 结果与讨论
2.1 铝源种类的影响
当Ws/Wr为3∶1时,采用不同铝源(纳米Al2O3、煅烧Al2O3、Al(OH)3)的试样在1 000 ℃反应3 h后的XRD图谱如图1所示。从图中可以看出,当温度为1 000 ℃时,含三种不同铝源的试样中均生成了单一的ZnAl2O4,其中以纳米Al2O3为铝源的试样中的ZnAl2O4衍射峰最为尖锐,而以Al(OH)3为铝源的试样中ZnAl2O4的衍射峰强度最低。这表明在三种铝源中,以纳米Al2O3为铝源合成的ZnAl2O4结晶性最好,这是因为纳米Al2O3粒度最小,表面能最大,使其在熔盐中溶解扩散速率显著改善,因而反应最充分,有助于晶粒的形成和发育;而Al(OH)3虽在高温下分解成粒度极小,晶格缺陷高的γ-Al2O3,但是Al(OH)3本身粒径较大,在反应过程中ZnAl2O4晶体缺陷来不及调整,所以产物的半峰全宽最大,结晶程度最低。

图1 Ws/Wr为3∶1时不同铝源在1 000 ℃下合成产物的XRD图谱Fig.1 XRD patterns of the products synthesized at 1 000 ℃ using different aluminum sources with a Ws/Wr of 3∶1
图2为Ws/Wr=3∶1,采用不同铝源为原料的试样在1 000 ℃保温3 h后的SEM照片。从图中可以看出,以不同铝源为原料合成的ZnAl2O4形貌明显不同。从图2(a)中可以看出,以Al(OH)3为铝源合成的ZnAl2O4晶粒粗大,呈不规则颗粒状,通过观察可以看到部分颗粒具有明显的片层结构,且颗粒内部存在丰富的气孔。这是因为Al(OH)3在230~350 ℃会分解形成γ-Al2O3和H2O[14],而H2O蒸发排除时会形成气孔,但是产物依然保持着Al(OH)3的原始形貌,即所谓的“母盐假象”。已有文献表明,熔盐法合成ZnAl2O4主要遵循着“模板法合成机理”,原料本身尤其是在熔盐中溶解度较小的原料粒径和形貌对ZnAl2O4性能有着重要影响[15]。ZnO在氯化物熔盐中的溶解度远远大于Al2O3,因此,ZnAl2O4的形成主要是以Al2O3原料作为模板,随着反应进行,溶解的ZnO逐渐朝着Al2O3颗粒迁移,依附在其表面以多孔状母体为模板进行反应,所以最终产物遗传了原始Al(OH)3颗粒的形貌,因此以Al(OH)3为铝源的试样中ZnAl2O4晶粒粒度较大。由图2(b)可知,以煅烧Al2O3为铝源的试样中生成的ZnAl2O4晶粒发育完整,呈典型的立方体结构,粒径较小,从右上方的放大图可以看出,粒径为300 nm左右,颗粒间存在着轻微团聚。由图2(c)可知,以纳米Al2O3为铝源,ZnAl2O4晶粒的平均粒径明显小于以煅烧Al2O3为铝源的试样,150 nm左右。由于产物粒径过小,颗粒间团聚比较严重。从以上分析可以看出,在三种铝源的试样中,ZnAl2O4粉体均具有和初始铝源相似的尺寸和形貌,进一步证实了熔盐法合成ZnAl2O4的机理主要遵循着“模板法合成机理”。

图2 Ws/Wr为3∶1时以不同铝源为原料在1 000 ℃合成产物的SEM照片。(a)Al(OH)3;(b)煅烧Al2O3;(c)纳米Al2O3Fig.2 SEM images of the products synthesized at 1 000 ℃ using different aluminum sources with a Ws/Wr of 3∶1.(a)Al(OH)3;(b)calcined Al2O3;(c)nano-Al2O3
采用比表面积与孔隙率分析仪在N2吸附条件下测定了以Al(OH)3、煅烧Al2O3和纳米Al2O3三种铝源为原料合成ZnAl2O4粉体的比表面积,分别为2.45 m2/g、3.78 m2/g和6.10 m2/g。图3为Ws/Wr为3∶1时以不同铝源为原料在1 000 ℃合成产物的粒度分析。从图中可以看出,采用Al(OH)3、煅烧Al2O3和纳米Al2O3三种铝源合成ZnAl2O4粉体的平均粒径分别为6.10 μm、2.07 μm、1.19 μm。从检测结果可以看出,产物比表面积和粒度的变化规律和前面显微形貌分析的结果基本相符。其中,以煅烧Al2O3和纳米Al2O3为铝源的试样粒度偏大,可能是由于不同程度的团聚现象。
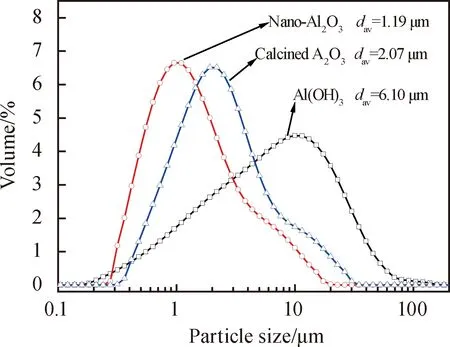
图3 Ws/Wr为3∶1时以不同铝源为原料在1 000 ℃合成产物的粒径分布Fig.3 Particle size distributions of the products synthesized at 1 000 ℃ using different Al2O3 sources with a Ws/Wr of 3∶1
2.2 合成温度的影响
固定Ws/Wr为3∶1,研究了合成温度对产物物相组成的影响,结果如图4所示。由图4(a)中可知,以Al(OH)3为铝源,当反应温度为800 ℃时,试样中主晶相为ZnAl2O4,另外还存在少量ZnO,但是在图谱中并未发现多余Al2O3的衍射峰,可能是因为一方面其剩余量本身较少,另一方面反应在Al2O3表面进行,形成的产物ZnAl2O4将Al2O3包裹在芯部导致其难以被检测到[13]。当温度为900 ℃及以上时,产物中均只检测到单一的ZnAl2O4相(ICDD卡片5-669#),且随着温度升高,ZnAl2O4衍射峰的强度逐渐增加,表明ZnAl2O4的生成量逐渐增多,结晶更加完善。由图4(b)可知,以煅烧Al2O3为铝源,当温度为800 ℃时,产物中除了观察到ZnAl2O4的衍射峰外,还有较多的Al2O3和ZnO残留;当温度为900 ℃时,ZnAl2O4衍射峰强度逐渐增强,ZnO峰强度减弱。当温度在1 000 ℃及以上时,ZnO和Al2O3的衍射峰消失,仅存在单相ZnAl2O4,表明生成了较纯净的ZnAl2O4粉体。从图4(c)可以看出,以纳米Al2O3为铝源,当温度为800 ℃时,和Al(OH)3类似,试样中还存在少许的ZnO未反应完全。当温度达到900 ℃及以上时,ZnO和Al2O3衍射峰消失。由此可以看出,合成温度对ZnAl2O4粉体形成具有显著影响,当有熔盐介质存在时,在温度低于800 ℃时,ZnAl2O4已经开始大量形成,温度升高显著促进了ZnAl2O4晶体的生成和发育。相比于传统固相合成法,采用熔盐法制备纯相ZnAl2O4粉体的温度降低约500 ℃[6]。另外,对比含有三种铝源的试样在800 ℃时的XRD图谱,可以发现以Al(OH)3为铝源的试样中杂质含量相对最少,而以煅烧Al2O3为铝源的试样中杂质含量最多。由此可以推断,以Al(OH)3为铝源的试样反应速率最快,而以煅烧Al2O3为铝源的试样反应速率最慢,这主要是由Al2O3原料的粒径和反应活性共同决定的。
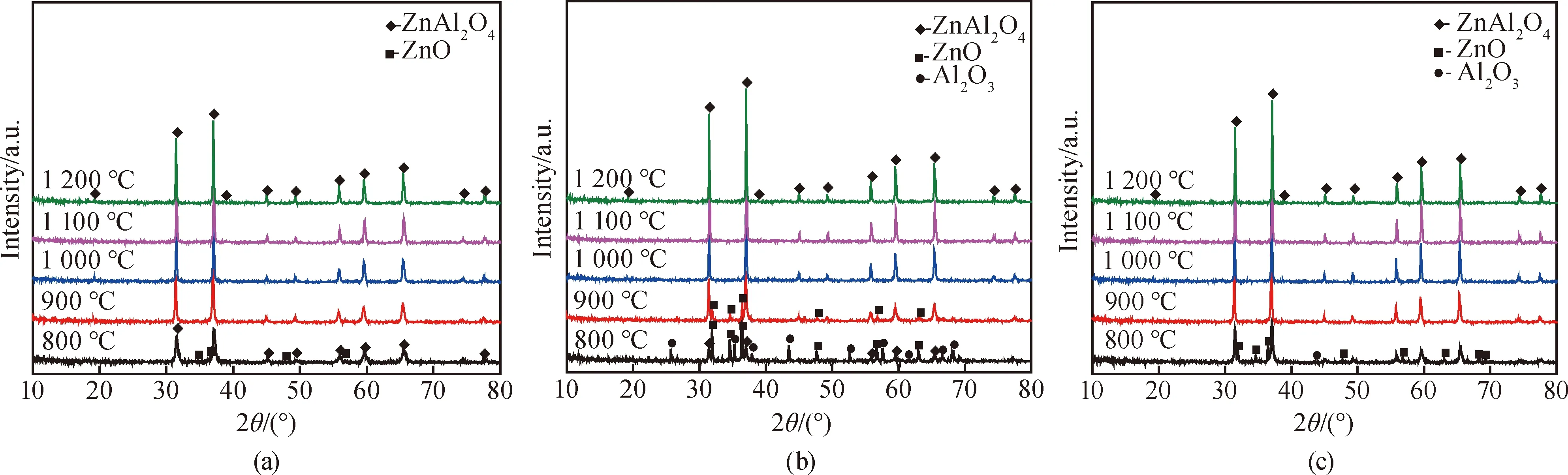
图4 当Ws/Wr为3∶1时以不同铝源为原料在不同温度下合成产物的XRD图谱。(a)Al(OH)3;(b)煅烧Al2O3;(c)纳米Al2O3Fig.4 XRD patterns of the products synthesized at different temperatures using different aluminum sources with a Ws/Wr of 3∶1.(a)Al(OH)3;(b)calcined Al2O3;(c)nano-Al2O3
图5是以煅烧Al2O3为铝源,当Ws/Wr为3∶1时,在不同温度(800~1 200 ℃)下合成产物的SEM照片。从图中可以看出,随着温度升高,粒径变化并不明显,但是试样内部的团聚程度却呈增加趋势。当温度超过1 000 ℃(见图5(d)、(e)),小晶粒间相互接触逐渐长大。前人研究已表明,采用熔盐法制备ZnAl2O4主要遵循着两种机理,即“溶解-沉淀生长机理”和“模板法合成机理”[11]。在本实验中,ZnO在熔盐中的溶解度远远大于Al2O3,所以其形成机理主要以后者为主,溶解的ZnO不断向Al2O3迁移,以Al2O3为模板在其表面进行反应形成尖晶石层,然后ZnO穿透尖晶石层与未反应的Al2O3进一步反应,使ZnAl2O4层不断增厚,直到Al2O3颗粒被完全消耗。所以,温度越高,离子的迁移速度越快,反应的动力学条件越充分,有助于晶粒的形成和发育,但是温度过高,反应速率过快,小颗粒开始逐渐胶结在一起形成大颗粒。综上所述,以煅烧Al2O3为铝源时,最佳的反应温度为1 000 ℃,此时粉体分散性最好。

图5 Ws/Wr为3∶1时以煅烧Al2O3为铝源的试样在不同温度下合成产物的SEM照片(a)~(e)以及EDS图谱(f)Fig.5 SEM images (a)~(e)of the products synthesized at different temperatures with a Ws/Wr of 3∶1 using calcined Al2O3 as aluminum source and EDS spectrum (f)
2.3 熔盐含量的影响
图6为分别以Al(OH)3和煅烧Al2O3为铝源,温度为1 000 ℃时,不同熔盐含量对产物物相组成的影响。从图中可以看出,无论是以Al(OH)3为铝源,还是以煅烧Al2O3为铝源,在所有熔盐含量的试样中均生成了纯相ZnAl2O4,说明通过反复水洗可以有效去除产物中的杂质离子。而且,随着熔盐含量升高,产物中ZnAl2O4衍射峰的强度呈现相同的规律,均在Ws/Wr为2∶1时衍射峰强度达到最大。这是由于当Ws∶Wr为1∶1时,体系中形成的液相量较少,黏度相对较大,提供的熔盐液相环境不充分,导致离子迁移速度较慢;当Ws/Wr大于2∶1时,体系中生成的液相量又过多,熔盐分布于原料之间起到了阻隔的作用,从而降低了反应物的有效浓度,增加了反应物质间的扩散距离,故ZnAl2O4的生成量又开始呈减少的趋势。实验表明,适当的Ws/Wr可有效促进ZnAl2O4的生成和发育。当以Al(OH)3或煅烧氧化铝为铝源时,最合适的Ws/Wr为2∶1。
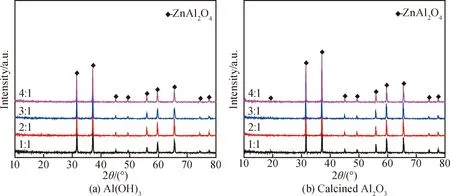
图6 在1 000 ℃时以Al(OH)3(a)和煅烧Al2O3(b)为铝源的试样在不同Ws/Wr下合成产物的XRD图谱Fig.6 XRD patterns of the products synthesized at 1 000 ℃ with different Ws/Wr using Al(OH)3 (a)and calcined Al2O3 (b)as aluminum sources
图7为在1 000 ℃时以Al(OH)3为铝源的试样在不同熔盐含量下合成产物的SEM照片。由图可知,在1 000 ℃以Al(OH)3为铝源时,产物中仅观察到ZnAl2O4,粒径较粗,在2~30 μm之间,而且在晶体内部存在较多的孔隙。随着熔盐含量增加,ZnAl2O4粒径呈逐渐减小的趋势,当Ws/Wr为4∶1时,生成的ZnAl2O4粒径最小。这是由于熔盐含量越高,Al(OH)3分解形成的γ-Al2O3在熔盐中的溶解度越大,从而改善了离子的迁移速度和反应速率。但是熔盐会分散在γ-Al2O3和ZnO之间阻碍产物的进一步长大,所以熔盐含量越高,产物分散性越好,形成的粒度越小。

图7 以Al(OH)3为铝源在1 000 ℃下不同Ws/Wr的试样合成产物的SEM照片Fig.7 SEM images of the products synthesized at 1 000 ℃ with different Ws/Wr using Al(OH)3 as aluminum source
3 结 论
(1)铝源种类显著影响ZnAl2O4的开始形成温度和最终性能。相比于煅烧Al2O3,以Al(OH)3和纳米Al2O3为铝源时合成ZnAl2O4的速率较快,可使ZnAl2O4合成温度降低约100 ℃。以纳米Al2O3为铝源时,产物粒度最小,约为150 nm,但是团聚现象较严重,以Al(OH)3为铝源时,产物粒度最大。ZnAl2O4均在一定程度保持着初始铝源的尺寸和形貌,显示熔盐法合成ZnAl2O4的机理主要遵循着“模板法反应机理”。
(2)以煅烧Al2O3为铝源、熔盐与原料质量比为3∶1时,合成ZnAl2O4的最佳反应温度为1 000 ℃,此时粉体的分散性较好,粒径为300 nm左右。适当的Ws/Wr可以促进ZnAl2O4的生成,以Al(OH)3为铝源,当Ws/Wr=4∶1时,1 000 ℃保温3 h生成的ZnAl2O4粒径最小。
