Keggin型磁性多酸负载型催化剂的制备及其燃油氧化脱硫性能
2022-01-14李斯文张海艳韩天昊吴文琪赵建社
李斯文,张海艳,韩天昊,吴文琪,王 伟,赵建社
(1.长安大学 水利与环境学院,陕西 西安 710061;2.西北大学 化学与材料科学学院,陕西 西安 710127)
众所周知,石油产品中的含硫物质对环境造成了非常严重的影响,尤其是使空气污染越来越严重[1]。硫化物的排放导致PM2.5逐渐升高,其大量来源于燃煤和燃油的燃烧,该污染成为了雾霾的元凶,并直接影响人们的生产和生活。另外,雾霾的出现也诱发了各种疾病:如哮喘、气管炎、脑溢血、高血压、结膜炎、咽炎等,其中呼吸道疾病最为严重。由此可以看出,硫氧化物的危害已经涉及到我们生活中的许多方面[2]。近年来,随着世界经济的飞速发展,汽车的保有量呈现直线上升的趋势。鉴于油品中含硫化合物的危害,为了确保人类社会的可持续发展,世界各国家、地区相继颁布了严格的燃油硫含量标准,自1993年欧盟实施欧Ⅰ标准开始,短短7年时间限制硫质量分数降至150 μg/g,继而不到10年间已于2009年1月1日强制实行硫质量分数低于10 μg/g的欧Ⅴ标准。虽然中国汽柴油质量升级的总体进程落后于欧盟,但为了改善生存环境,中国正加速提高汽柴油质量。因此,降低燃料油中的硫含量,已成为当前一项重要任务[3]。
传统的加氢脱硫(HDS)虽然是目前工业上主要的脱硫工艺,但是其高温、高压等苛刻的反应条件以及对于噻吩类硫化物较低的脱除效果限制了其进一步的广泛应用[4-5]。而作为加氢脱硫的补充,氧化脱硫可在常温、常压下利用氧化剂将汽油中的硫化物氧化为砜和亚砜,从而达到深度脱硫的效果,催化剂经过再生后可重复利用,被认为是较有前景的脱硫工艺[6]。该技术的核心问题是如何设计并找到合适的氧化脱硫催化剂,并与合适的氧化剂配合,达到最高的脱硫率,并采用合适的萃取剂,将氧化后的砜类物质从油品中萃取出来[7]。
杂多酸(POM)具有独特的酸性、多功能性和“假液相”行为,且不同的元素可表现出酸性和氧化还原的差别,使其催化性能可控,有利于催化剂设计,且对环境无污染,在催化反应过程中表现出极高的活性以及选择性,属于绿色催化剂[8-9]。虽然杂多酸催化剂具备优良的氧化脱硫性能,但是其低表面积以及难回收性限制了其在催化领域的应用价值。因此,寻求优良的载体以达到较好的负载是当前需要解决的问题[10]。目前,应用较多的载体主要包括MCM系列[11-12]、ZSM系列[13-14]、MOF系列[15]以及碳材料[16]等,其中MOFs由于孔径可调的特点,被认为是良好的均相催化剂的载体,负载后的催化剂稳定性提升,寿命增长[17-18]。
笔者所在课题组之前将杂多酸负载到MOF-199@MCM-41的孔洞中[19],合成的负载型催化剂成功将反应物脱硫率提高到98.5%,同时催化剂回收5次情况下其催化效果仍然能够保持在90%以上。但是较少的重复使用次数会限制该类催化剂的工业使用价值,磁性材料的引入可以有效解决目前面临的问题。具有磁性的催化剂材料可以在反应结束时,通过引入外加磁场以达到对于催化剂的简单吸附并回收的操作目的,该方法成本较低,回收效果优良,目前也被广泛应用于工业领域[20-21]。
笔者制备了一类磁性MOF基多酸催化剂,即Fe@MOF-POM,通过多种表征手段证实了该类催化剂结构特性,以其为催化剂,空气中O2为氧化剂,催化氧化模拟燃油,通过单因素法探究了反应时间、催化剂用量、温度等对模拟燃油脱硫率的影响,考察了Fe@MOF-POM复合材料的稳定性及再生性能,推测相关反应机制。
1 实验部分
1.1 原料和试剂
十二水合磷酸氢二钠(Na2HPO4·12H2O)、二水合钼酸钠(Na2MoO4·2H2O)、二水合钨酸钠(Na2WO4·2H2O)、三水合硝酸铜(Cu(NO3)2·3H2O))、1,3,5-均苯三酸(H3BTC)、2-氨基-对苯二甲酸(H2BDC-NH2)、六水三氯化铁(FeCl3·3H2O))、乙酸钠(CH3COONa)、二苯并噻吩(C12H8S),均为阿拉丁试剂有限公司产品;浓硫酸(H2SO4),西安化学试剂厂产品;乙醇(C2H6O)、乙二醇(C2H6O2)、正辛烷(C8H18)、正十二烷(C12H26),天津市福晨化学试剂厂产品;N,N-二甲基甲酰胺(DMF)、乙醚(C4H10O),利安隆博华医药有限公司产品。以上试剂均为分析纯。去离子水为实验室自制。MOF-199(Cu)(MOF-199)是通过硝酸铜和均苯三酸合成制得的。
1.2 测试与表征
采用EQUINOX-55 FT-IR光谱仪(德国布鲁克公司产品)测定催化剂样品红外光谱;采用D8-Advance X射线衍射仪(德国布鲁克公司产品)测定催化剂样品的晶相结构;采用IRIS Advantage电感耦合高频等离子光谱仪(美国热电公司产品)测定催化剂样品存在元素情况;采用TM-3000扫描电镜(日本日立公司产品)对催化剂表面形貌结构进行分析;采用LDJ9500磁性测试仪(美国LDJ公司产品)测定催化剂样品磁性情况;采用HP6890气相色谱仪(美国安捷伦公司产品)测定在保留时间内的系统内硫物质的峰面积,进而计算在催化剂作用下的脱硫效率。
1.3 催化剂的制备
Fe3O4@NH2-MOF-199(简称FeCu)的合成:将0.1 g的H2BDC-NH2和H3BTC混合物 (质量比为1∶1)与0.86 mmol Cu(NO3)2·3H2O混合后加入0.15 g Fe3O4中(Fe3O4参考文献[22]合成方法制得),加入1 mL去离子水,研磨30 min。然后,将混合均匀的粉末转移至含10 mL DMF溶液的聚乙烯内衬不锈钢高压釜,100 ℃下恒温12 h。最后,产物用DMF冲洗3次,60 ℃真空干燥24 h。
Fe3O4@NH2-MOF-199-PMoW(简称FeCuP)的合成:将0.1 g的H2BDC-NH2和H3BTC混合物(质量比为1∶1)与0.86 mmol Cu(NO3)2·3H2O混合后加入至0.15 g Fe3O4中,加入1 mL去离子水,研磨30 min。加入0.1 g PMoW(PMoW参考文献[19]合成),搅拌30 min。然后,将混合均匀的粉末转移至含10 mL DMF溶液的聚乙烯内衬不锈钢高压釜中,100 ℃下恒温12 h。最后,产物用DMF冲洗3次,60 ℃真空干燥24 h。
1.4 氧化脱硫实验
将DBT溶于正十二烷中,配制成含硫质量分数为2000 μg/g的模拟燃油。氧化脱硫反应装置如图1所示,过程如下:将一定量催化剂和100 mL模拟燃油置于三颈瓶内,其中三颈瓶口分别接入鼓空气装置、回流管以及温度计,调节反应温度、搅拌速率和通空气速率使体系充分反应。反应开始后,每隔30 min取样一次,离心后吸取上层液,即氧化后的燃油,反应前后硫含量的变化采用Agilent-6890型气相色谱仪进行检测(燃油进样量为0.1 μL,进样口温度为300 ℃,检测器温度为270 ℃,柱温为255 ℃),实际脱硫率计算公式见式(1):

图1 脱硫测试装置图Fig.1 Desulfurization test device diagram
(1)
式中:w0为初始硫质量分数,μg/g;wt为反应时间t时刻的硫质量分数,μg/g;x(DBT)为脱硫率,%。
反应结束后,采用外加磁场对催化剂进行简单分离,经水、乙醇分别清洗3~5次后催化剂可进行重复使用实验。
1.5 催化剂的重复使用
氧化脱硫完成后,用磁铁吸住催化剂样品,倒出反应后的油品。随后对催化剂进行再生处理:用正辛烷、乙醇多次洗涤后得到固体产物,然后用乙醇浸泡2 h,以除去催化剂表面吸附的氧化产物,最后用去离子水洗涤3次、60 ℃烘干12 h,即得到回收的催化剂。回收处理后的催化剂样品及新制的模拟燃油参照1.4节进行重复性探究实验。
2 结果与讨论
2.1 催化剂的物理性质表征
2.1.1 IR分析
图2为各催化剂的IR谱图。由图2可以看出,单纯的Fe3O4磁性材料在603 cm-1处具有明显的特征峰,其主要来自于Fe—O的伸缩振动[23]。MOF-199特征峰则出现在1650、1450和1370 cm-1附近,这些峰归属于MOF-199中的羰基对称和不对称伸缩振动[24]。对于FeCu来说,它具备了Fe3O4和MOF-199的特征峰,说明了两者很好地结合在一起。此外,在引入多酸PMoW后,FeCuP材料在700~1100 cm-1出现了归属于P—O以及Mo/W—O的特征峰,进一步证实了多酸很好地连接在磁性MOF材料上,使之成为一个完整的复合材料。

图2 各催化剂的IR谱图Fig.2 IR spectra of catalysts
2.1.2 XRD分析
图3为各催化剂的XRD谱图。据文献[22]可知,单纯的Fe3O4在2θ为30.39°、35.81°、43.54°、53.87°、57.35°和63.10°处均有较强的峰值,图3中证实该磁性纳米颗粒在整个合成反应过程中结晶相的稳定性。MOF-199材料在2θ为10°附近具有明显的尖峰,在FeCu载体材料中没有出现Fe3O4的特征峰,但出现了MOF-199的特征峰,说明Fe3O4已完全包裹在样品内部,而MOF材料在FeCu载体表面存在;在引入多酸PMoW后,归属于多酸的杂峰出现进一步证实了多酸与磁性MOF材料很好的复合。

图3 各催化剂的XRD谱图Fig.3 XRD patterns of catalysts
2.1.3 SEM表征
图4为各催化剂的SEM照片。由图4看到:单纯Fe3O4呈现出均匀光滑状;随着MOF以及PMoW的引入,颗粒表面逐渐变得粗糙,且颗粒直径有些许变小的趋势。从图4(c)可以清晰地看出,颗粒表面呈现不规则的堆叠状,间接证明了Fe3O4外围附着MOF以及多酸的设计构想的成功。

图4 各催化剂的SEM照片Fig.4 SEM images of catalysts(a)Fe3O4;(b),(c)FeCuP
2.1.4 TEM表征
图5为FeCu和FeCuP样品的TEM照片。由图5可以看出:FeCu载体出现了明显的核-壳结构,即磁性Fe3O4均匀分布于中心;当多酸PMoW引入后,出现了粗糙的颗粒表面,这与SEM照片结果一致,与最初设计结构相吻合。

图5 FeCu和FeCuP的TEM照片Fig.5 TEM images of FeCu and FeCuP(a)FeCu;(b)FeCuP
2.1.5 XPS分析
图6为FeCuP的XPS谱图,其中出现的特征峰分别对应于其表面的C 1s、O 1s、Fe 2p、Cu 2p、P 2p、Mo 3d和W 4f 7种元素。根据不同元素的结合能分析,可充分证明了所合成催化剂的元素组成,其中Fe来自于Fe3O4材料,Cu来自于MOF-199材料,P、Mo和W来自于多酸PMoW。

图6 FeCuP的XPS谱图Fig.6 XPS spectra of FeCuP(a)Survey of FeCuP;(b)C 1s;(c)O 1s;(d)Fe 2p;(e)Cu 2p;(f)P 2p;(g)Mo 3d;(h)W 4f
2.1.6 磁性分析
用振动样品磁力计(VSM)在室温下磁场强度H从-20000 Oe到20000 Oe测试了不同样品的磁特性——磁化强度M,见图7。从图7可以看出,Fe3O4、FeCu和FeCuP均呈超顺磁性,饱和磁化值分别为41.3、18.9和7.6 emu/g,说明Fe3O4已成功地包覆到样品中,减弱的磁化强度主要是由包覆在外的PMoW和MOF-199(Cu)引起的。综上所述,明显的磁化效果可以在回收实验中发挥重要作用,仅采用外磁体进行催化剂的回收,这也是笔者工作的创新点,并将进行工业应用[25]。

图7 Fe3O4、FeCu和FeCuP的VSM谱图Fig.7 VSM profiles of Fe3O4,FeCu and FeCuP(a)Fe3O4;(b)FeCu and FeCuP
2.2 催化剂最佳脱硫反应条件的探究
2.2.1 不同类型催化剂的脱硫性能探究
以含有DBT的正十二烷溶液为模拟燃油进行催化剂的性能评价,如图8所示。由图8可见:未加PMoW的FeCu磁性载体材料,在反应时间达到30 min时,体系脱硫效率由最初的0增加到28.9%,且随着时间的继续增加,脱硫效率保持不变;而加入PMoW后,在反应前75 min内脱硫率呈现接近直线上升的趋势,到75 min时达到峰值100%,且保持恒定不变。这是因为FeCu材料的脱硫效率主要来自于基于MOF材料的吸附作用,但效果不佳;加入PMoW后,催化性能较好的杂多酸承担起催化脱硫反应中举足轻重的作用,在较短的时间(75 min)即实现了燃油中DBT的100%脱除,充分证实了该类多酸型催化剂较优的脱硫性能,也为后期工业的广泛应用奠定了充实的理论与实验基础。

图8 FeCu和FeCuP对DBT脱硫活性对比Fig.8 Comparison of DBT desulfurization activities of FeCu and FeCuPReaction conditions:w(PMoW)=30%;c(Catalyst)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min
2.2.2 不同PMoW负载量的FeCuP催化剂脱硫性能探究
在反应时间为75 min、FeCuP催化剂质量浓度为0.5 g/L、反应温度为60 ℃、通空气速率为700 mL/min、搅拌速率为500 r/min条件下,探究催化剂中PMoW负载量对FeCuP催化氧化脱硫反应的DBT转化率的影响,结果如图9所示。由图9可以看出:当PMoW负载质量分数从10%增加到30%时,脱硫率从59.6%显著提高到100%;随着PMoW负载量继续增加,脱硫率出现明显的下降趋势,这可能是因为过高的负载量会引起PMoW的聚集,多余的PMoW会阻塞MOF孔道进而直接影响最终脱硫效果。因此,选择30%的PMoW作为最佳负载量。

图9 不同PMoW负载量对于DBT脱硫率的影响Fig.9 Influence of PMoW load on DBT desulfurization rateReaction conditions:c(FeCuP)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min;t=75 min
2.2.3 不同FeCuP催化剂用量的脱硫性能探究
在反应时间为75 min、PMoW负载质量分数为30%、反应温度为60 ℃、通空气速率为700 mL/min、搅拌速率为500 r/min条件下,考察催化剂用量对FeCuP催化氧化脱硫反应DBT脱硫率的影响,结果如图10所示。由图10看到:随着催化剂用量从0.2 g/L增加到0.5 g/L,脱硫率从30.5%增加到100%;随着催化剂用量继续增多至0.7 g/L,脱硫率呈现略微下降的趋势。这主要是因为催化剂用量的增加可以在底物含硫组分含量固定条件下增大催化活性组分的量,大大增加与底物DBT接触的机会,充分实现对于DBT的脱除;但是过多的催化剂用量则产生了竞争催化效果。从经济方面考虑,选择0.5 g/L作为实验最佳催化剂用量。

图10 FeCuP催化剂用量对于DBT脱硫率的影响Fig.10 Influence of FeCuP catalyst amount on DBT desulfurization rateReaction conditions:w(PMoW)=30%;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min;t=75 min
2.2.4 不同温度下的脱硫性能探究
在PMoW负载质量分数为30%、FeCuP催化剂用量为0.5 g/L、通空气速率为700 mL/min、搅拌速率为500 r/min条件下,考察反应温度对FeCuP催化氧化脱硫反应的DBT转化率的影响,结果如图11所示。由图11看到:当反应时间相同时,随着反应温度的增加,模拟燃油脱硫率呈现逐渐增加的趋势,60 ℃时可达到最大100%;继续增加温度至80 ℃,DBT脱硫率降低至90%。由此可见,较高的温度不利于脱硫反应的进行,因此,选择60 ℃为最佳反应温度。

图11 反应温度对于DBT脱硫率的影响Fig.11 Influence of reaction temperature on DBT desulfurization rateReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;Agitation rate 500 r/min;Air flowing rate 700 mL/min
2.2.5 不同搅拌速率下的脱硫性能探究
在反应时间为75 min、PMoW负载质量分数为30%、FeCuP催化剂用量为0.5 g/L、反应温度为60 ℃、通空气速率为700 mL/min条件下,考察搅拌速率对FeCuP催化氧化脱硫反应的DBT转化率的影响,结果如图12所示。在该反应体系中,存在着固-液-气三相组分,即固体催化剂、气体氧化剂以及液体模拟燃油,适当地增大搅拌速率可增加三相的有效接触,降低传质阻力的影响[24];但是过大的搅拌速率会加速溶液的挥发。由图12可以看出,当搅拌速率为500 r/min时,脱硫率最大,为100%。故选择500 r/min为最佳搅拌速率。
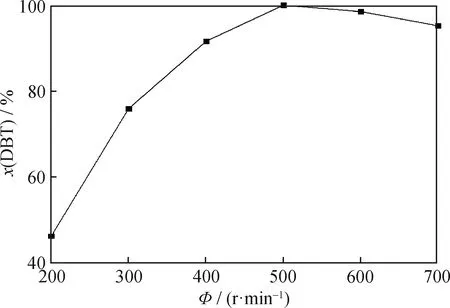
图12 搅拌速率对于DBT脱硫率的影响Fig.12 Influence of agitation rate on DBT desulfurization rateReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;T=60 ℃;Air flowing rate 700 mL/min;t=75 min
2.2.6 不同通空气速率下的脱硫性能探究
在反应时间为75 min、PMoW负载质量分数为30%、催化剂用量为0.5 g/L、反应温度为60 ℃、搅拌速率为500 r/min条件下,考察通空气速率对FeCuP催化氧化脱硫反应的DBT转化率的影响,结果如图13所示。由图13可见,随着空气通入速率的增大,在700 mL/min和900 mL/min时均达到100%的脱硫效果,即充分的氧化剂的引入可以大大增加燃油脱硫率;但是过量的氧化剂则会造成体系溶液挥发,降低催化氧化效率。所以,根据经济及成本两方面考虑,选择700 mL/min为最佳通空气速率。

图13 通空气速率对于DBT脱硫率的影响Fig.13 Influence of air flowing rate on DBT desulfurization rateReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;t=75 min
2.3 FeCuP催化剂的循环性能评价及机理推测
为了研究FeCuP催化剂的重复利用性,在最优条件下对催化剂进行了连续测试,结果见图14。由图14可见,在连续循环10次后,FeCuP催化氧化燃油脱硫率从100%降低至96.56%,仅仅下降了3.44百分点,表明催化剂具有相对稳定的结构,催化性能被很好的保持,重复使用性能良好。

图14 催化剂FeCuP的重复性能Fig.14 Repeatability performance of FeCuP catalystReaction conditions:w(PMoW)=30%;c(FeCuP)=0.5 g/L;T=60 ℃;Agitation rate 500 r/min;Air flowing rate 700 mL/min;t=75 min
图15为催化剂FeCuP在DBT脱硫反应中可能的脱硫反应机理和反应后萃取相的GC-MS图。由图15(a)可以看出,首先,分子氧和DBT被吸附到FeCuP催化剂的通道中,氧与PMoW的末端M=Od(M为Mo或W)基团(M(O)n-)反应,生成中间过氧配合物M(O2)n-,该过氧化物被认为是催化DBT的重要物质。随后,DBT上的硫原子攻击M(O2)n-并形成了对应的亚砜,接下来M(O2)n-以很快的速率被还原为M(O)n-,而亚砜(DBTO)进而变成砜(DBTO2)[26]。由图15(b)观察到DBTO2

DBTO2—Dibenzothiophene sulfonea图15 催化剂FeCuP在DBT脱硫反应中可能的脱硫反应机理和反应后的萃取相GC-MS色谱图Fig.15 Diagram of possible desulfurization reaction mechanism and GC-MS chromatogram(a)Reaction mechanism;(b)GC-MS
对应的清晰峰(m/z=216),表明DBT最终被完全氧化为二苯丙砜,达到了燃油脱硫的效果。
3 结 论
(1)多酸具有较好的脱硫效果,随着多酸活性组分的引入,FeCuP催化氧化脱硫反应的最优反应条件为:PMoW负载质量分数为30%,催化剂用量为0.5 g/L,反应温度为60 ℃,搅拌速率为500 r/min,通空气速率为700 mL/min。最优反应条件下模拟燃油中DBT的脱硫率可在75 min内达到100%。
(2)磁性材料中Fe3O4的引入,即简单的外加磁场使用即可实现催化剂的回收与再利用,且催化剂重复使用10次仍保持95%以上的脱硫率。FeCuP催化剂在脱硫率以及重复使用次数上的明显优化满足了当今脱硫工业化的使用要求,具有较大的利用及推广价值。
