中空介孔二氧化硅纳米粒子负载的鱼藤酮纳米颗粒在黄瓜植株中的吸收和传导特性
2022-01-14郭亚军沈殿晶范添乐王智超陈小军
郭亚军,沈殿晶,赵 明,范添乐,王智超,陈小军
(1 扬州市江都区农业技术综合服务中心,江苏 扬州 225200; 2 扬州大学 园艺与植物保护学院/农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
中空微球是一种具有特殊结构的纳米材料,与相似大小的材料相比,中空微球具有相对密度低、原材料使用少等优点。但是,当中空微球表面没有孔道时,内腔药物很难释放出来,因此微球孔道的连通性至关重要[1-2]。中空介孔二氧化硅纳米粒子(Hollow mesoporous silica nanoparticles, HMSNs)具有介孔和中空内腔结构的双重特点,并且其比表面积可观以及具有较好的生物相容性和稳定性,是负载农药的良好载体[3-6]。近年来,研究者也证明了HMSNs负载农药能够提高农药利用效率。Gao等[7]以HMSNs为载体,制备出一种对pH敏感的阿维菌素纳米农药,结果显示HMSNs能够大大提高阿维菌素的持效期。Tan等[8]通过硬模板法制备出粒径为 80~100 nm 的 HMSNs,负载烯效唑的HMSNs具有良好的控释特性,对水稻生长的阻滞作用有所改善。HMSNs的形成过程中,合成的模板起到了至关重要的作用,按照模板的合成机理主要可以分为硬模板法[9-12]、软模板法[13-16]和自模板法[17-19]。自模板法的优点在于可以以自身为模板,采用刻蚀剂进行刻蚀,从而转换为HMSNs,便捷高效,不添加其他化学药剂。
鱼藤酮(Rotenone)是一种植物源杀虫剂,对蓟马Thrips、蚜虫Aphids和菜青虫Pieris rapae等蔬菜害虫具有良好的杀虫活性[20-21]。但是,鱼藤酮在环境中不稳定,容易发生光解和水解,持效期短。此外,施药后,只有少量鱼藤酮进入植物体内,利用率和防治效果大大降低。据统计,截至2021年2月,鱼藤酮在中国取得登记的制剂产品有20个,原药产品有2个[22],未有相关鱼藤酮纳米剂型登记。斜纹夜蛾Spodoptera litura为鳞翅目夜蛾科杂食性害虫,寄主植物广泛,多达300多种[23],主要危害十字花科蔬菜、烟草、花生、大豆、甘薯等大田农作物。研究人员通过试验发现,7.5%(w)鱼藤酮乳油对斜纹夜蛾3龄幼虫具有较高防效[24],但是其在环境中的持效期较短。为了延长鱼藤酮的持效期,提高其有效利用率,本研究采用自模板法,在合成实心介孔二氧化硅的基础上,以水为刻蚀剂,通过调整刻蚀的时间与温度,制备出粒径250 nm、分散程度良好、内腔体积较大以及介孔结构明显的HMSNs,再采用溶剂挥发法制备负载鱼藤酮的HMSNs纳米颗粒(Rot@HMSNs),旨在提高鱼藤酮的稳定性、在植株中的吸收和传导能力以及杀虫活性。
1 材料与方法
1.1 材料和仪器
鱼藤酮标准品(w为98%)购自美国Sigma-Aldrich公司;鱼藤酮原药(w为95.0%)购自丰顺县汤西嘉兴福利化工厂;十六烷基三甲基氯化铵(CTAB,w为99%)、氨水(w为25%)、无水乙醇和正硅酸四乙酯(TEOS)购自国药集团化学试剂有限公司;异硫氰酸荧光素(FITC)购自北京索莱宝科技有限公司;3-氨基丙基三乙氧基硅烷(APTES,w为98%)购自阿拉丁(上海)有限公司;鱼藤酮微乳剂(w为6%) 购自北京三浦百草绿色植物制剂有限公司。
S-4800Ⅱ场发射扫描电镜,日本日立公司;Tecnai 12透射电镜,荷兰Philips公司;激光光散射仪,德国ALV公司;Autosorb IQ3比表面分析及孔径综合分析仪,美国Quantachrome Instruments公司;Tensor 27傅里叶红外光谱仪,布鲁克光谱仪器公司;L-2000型高效液相色谱,日本Hitachi公司;TEMBS210S型电子天平,德国Sartorius公司;H/T-16MM台式高速离心机,湖南赫西仪器装备有限公司;Milli-Q超纯水器,美国Millipore公司;SB25-12DTN型超声波清洗机,宁波新芝生物科技有限公司;LSM 880NLO双光子激光共聚焦显微镜,德国卡尔蔡司公司。
1.2 供试生物
斜纹夜蛾购自河南省济源白云实业有限公司。在室内培养3代后用于试验,具体养殖条件为:使用纱网制作产卵笼,每个产卵笼放入20头虫蛹,将产卵笼置于光照培养箱中,设置光照12 h,温度保持在25 ℃,保持湿度76%左右,成虫孵出后,用棉球蘸取15%(w)的蜂蜜水为成虫提供营养,将医用纱布置于底部,每天收集纱布中的卵,剪下有卵部分,置于养虫盒中,并加入饲料,以待幼虫长至3龄期。
黄瓜的种植,先采用w为5%的H2O2将种子表面消毒30 min,然后采用去离子水彻底冲洗干净;无菌种子在经去离子水湿润的滤纸上培养7 d后,将幼苗移栽到有营养土壤和蛭石的5 L塑料盆中。当植株发育出第5片叶子时进行试验,采用涂抹法进行施药处理。
1.3 试验方法
1.3.1 HMSNs 和载鱼藤酮 HMSNs(Rot@HMSNs)的合成 采用自模板法[25],先合成实心介孔二氧化硅 (Mesoporous silica nanoparticles, MSNs),再以水为刻蚀剂,通过控制刻蚀的时间和温度,合成HMSNs。将 0.16 g CTAB、26 mL 的无水乙醇和 55 mL的去离子水加入到圆底烧瓶中,混合搅拌使CTAB充分溶解,5 min 后加入 1 mL 氨水,然后以 1 mL/min的速率滴加1 mL的TEOS到上述混合溶液中,使其反应完全,保持室温,待混合液混合反应3 h后,离心收集沉淀,将沉淀分别用乙醇和去离子水洗涤3次,即得到实心二氧化硅纳米粒子,将合成得到的实心介孔二氧化硅纳米粒子加入到100 mL的去离子水中,在60 ℃条件下持续搅拌24 h,随后离心收集沉淀,用去离子水洗涤3次,即得到HMSNs。
分别称取 200 mg 鱼藤酮和 100 mg HMSNs进行载药,具体步骤参考文献[24]的载药方法。
1.3.2 HMSNs和 Rot@HMSNs 的表征 采用多种手段对HMSNs和Rot@HMSN进行表征,具体参考文献[26]的方法,包括采用扫描电镜和透射电镜进行形貌分析;采用激光散射仪进行粒径分析;采用比表面积测定仪测定物理吸附特性;采用傅里叶红外光谱对其是否制备成功进行分析。
1.3.3 Rot@HMSNs 载药率的测定 载药率的测定参考文献 [26]的方法,称取 5 mg Rot@HMSNs,加入25 mL乙腈,超声分散2 h,使所载的鱼藤酮完全从HMSNs中释放出来,试验重复3次。鱼藤酮的含量采用高效液相色谱仪进行检测,具体检测条件参考文献[27-28]。
1.3.4 Rot@HMSNs的缓释性能测定 取 50 g 黄瓜植株提取液,加入100 mL含30%(φ)乙腈的去离子水,制备成稀释的黄瓜汁液,以其作为释放溶液模拟其释放环境,探究Rot@HMSNs在植物体内的释放特性,方法参考文献[26]。为了进一步分析其释放行为和合理解释农药的释放规律,采用4种释放模型进行拟合分析,分别是零阶释放模型[29]、一阶释放模型散[30]、Higuchi释放模型[29]和Ritger-Peppas释放模型[31]。
1.3.5 Rot@HMSNs的杀虫活性 以斜纹夜蛾 3 龄幼虫为供试材料,将Rot@HMSNs分散于含1.0 g/L吐温-80的去离子水溶液中,分别配制成500、250、125、62.5和31.25 mg/L的梯度溶液。试验选取直径为6 cm的新鲜甘蓝叶片,将甘蓝叶片分别浸润于5种溶液中30 s,拿出后待叶片晾干,置于培养皿中。分别选取15头健康的斜纹夜蛾3龄幼虫放入培养皿中,喂养24、48、72 h后观察幼虫的存活情况,每个浓度设置3组重复,并且设置5 g/L的鱼藤酮微乳剂为对照组。随后利用浓度和死亡率计算出对应的毒力回归曲线,计算致死中浓度LC50。
1.3.6 FITC 标记的 HMSNs(FITC-HMSNs)的合成为了示踪HMSNs在黄瓜植物中的系统分布,采用APTES作为交联剂将荧光素FITC接枝到HMSNs上,得到FITC-HMSNs的可视化研究。FITC-HMSNs的合成参照 Hussain 等[32]的方法。将 20 mg HMSNs、20 mL 二甲基甲酰胺和 10 μL APTES 混合后,剧烈搅拌1 d,用乙醇洗涤3次后去除多余ATPES。随后将功能化 HMSNs与 10 mL 乙醇和 1 mg FITC 混合,继续剧烈搅拌1 d,最后分别用去离子水和乙醇洗涤3次,得到FITC-HMSNs。
1.3.7 FITC-HMSNs 的施药、取样和可视化观察取种植的黄瓜植株进行内吸传导性试验,用毛笔将已配制好的200 mg/L的FITC-HMSNs悬浮液轻轻涂布在植株中部的成熟叶片上,待叶片上药液变干后,再重复涂布一定体积的药剂,叶片上涂布的药液总量为0.5 mL。施药24 h后,分别采集处理叶片的叶柄、上部茎秆、下部茎秆和根,并将各部位的切片置于共聚焦显微镜下观察,可视化观察HMSNs在黄瓜植株中的系统分布情况。
1.3.8 黄瓜植株的前处理方法 分别称取 1 g 黄瓜叶片或根于匀浆杯中,加入5 mL乙腈,在匀浆器中高速匀浆 1 min,随后加入 0.3 g 氯化钠和 1.2 g无水硫酸镁,旋涡振荡,4 000 r/min 离心 5 min;取上清液 2 mL 到盛有 150 mg 无水硫酸镁、50 mg PSA 和 25 mg C18 的离心管中,4 000 r/min 离心 5 min;取上清液 0.70 mL,加入 0.30 mL 水后混匀,0.22 μm有机相滤膜过滤处理,高效液相色谱仪检测分析。
1.3.9 Rot@HMSNs中鱼藤酮在黄瓜植株中的系统分布 施药方法同“1.3.7”。待涂布 0、1、3、5、7、10和14 d后,分别取涂布药液的成熟叶片、涂药叶片上部叶片、涂药部位下部叶片和根。同时分别设置6 g/L的鱼藤酮微乳剂、清水的对照处理组,每处理重复3次。采集处理黄瓜植株的各部位,经样品前处理后,采用HPLC检测分析各处理植株各部位中的鱼藤酮含量。并采用转移因子(TFs)[33]评价Rot@HMSNs在黄瓜植株中的转移能力,转移因子的计算公式分别为:
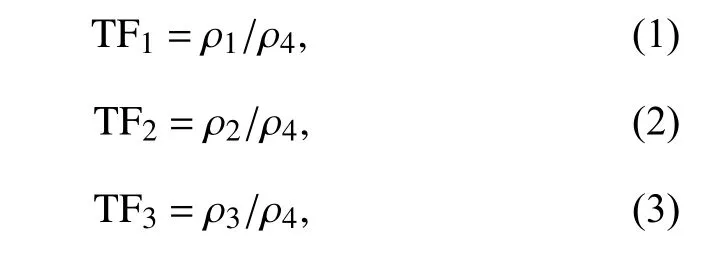
式中,TF1、TF2和TF3分别为上部叶、下部叶和根的转移因子;ρ1、ρ2、ρ3和ρ4分别为上部叶、下部叶、根和处理叶的鱼藤酮质量浓度。
1.4 数据分析
使用SPSS25.0对所有数据进行统计学分析,并通过单因素方差分析(ANOVA)对试验数据进行处理,用LSD法比较处理组及对照组之间的差异显著性。
2 结果与分析
2.1 HMSNs和 Rot@HMSNs的表征
扫描电镜的观察结果显示,所制备的HMSNs呈球形、粒径大小均匀、表面结构粗糙,具有致密的介孔结构(图1A、1B)。进一步的透射电镜观察结果显示,HMSNs的粒径均一、介孔结构清晰以及内腔空间可观(图1C)。负载鱼藤酮之后,HMSNs的内腔空间变小,阴影部分面积加深,说明鱼藤酮被成功负载(图1D)。

图1 电镜图Fig. 1 Electron micrograph
激光光散射仪分析结果表明HMSNs和Rot@HMSNs在水中具有良好的分散性,并且载药后的Rot@HMSNs具有和HMSNs相似的粒径(图2A)。从图2A可知,HMSNs的粒径分布较为集中,粒径主要在250 nm左右。同样地,Rot@HMSNs的粒径分布也较为集中,也主要为250 nm。此外,Rot@HMSNs在 5 000 nm左右存在 1 个弱峰,这可能是由于部分的HMSNs在载鱼藤酮以后发生了团聚。HMSNs和Rot@HMSNs的聚合物分散系数分别为0.259和0.367。上述研究结果表明本研究采用的载药方法在达到可观的载药率的同时,还能保持相似的粒径。
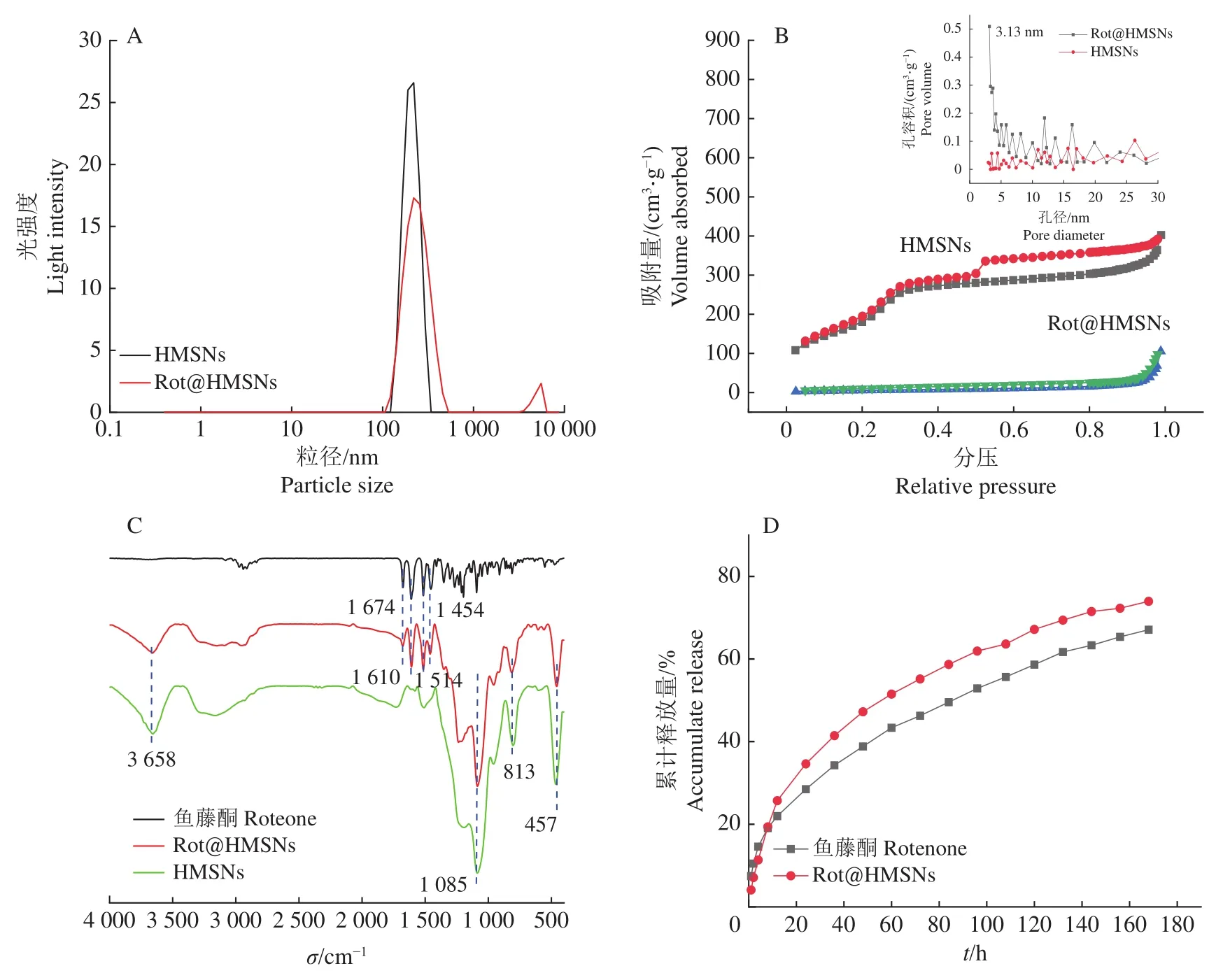
图2 HMSNs 和 Rot@HMSNs 的表征分析Fig. 2 Characterization analysis of HMSNs and Rot@HMSNs
HMSNs等温线为典型的Ⅳ型等温曲线,分压在0.3~1.0时,出现了1个长而宽的H4类滞后环(图2B),表明其具有平行板结构的介孔。Rot@HMSNs的等温线由于鱼藤酮分子的填充而改变,其吸附量远远小于HMSNs。研究表明HMSNs的比表面积为 999.4 m2/g,孔容积为 0.62 cm3/g,孔径为 3.3 nm,而Rot@HMSNs的比表面积等各项指标都因鱼藤酮的负载而急剧下降,比表面积为21.8 m2/g,孔容积为 0.16 cm3/g,孔径为 3.1 nm,因此也证明了鱼藤酮成功占据了HMSNs的介孔结构。
红外光谱测定结果显示Rot@HMSNs在相应的位置出现了鱼藤酮和HMSNs的特征峰,在457、813 cm-1处出现了 Si—O 键对称伸缩峰;在 1 085 cm-1处出现了 Si—O—Si反对称伸缩振动峰,3 658 cm-1处的弱峰为结构水—OH反对称伸缩振动峰;另外在1 454、1 514、1 610 和 1 674 cm-1处出现了与鱼藤酮相同的特征吸收峰(图2C),为苯环的振动峰[34]。由此可以证明,鱼藤酮成功负载到HMSNs孔道中,且未发生氧化光解等变化。此外,并未发现模板剂CTAB的特征峰,说明模板剂已经完全去除。通过HPLC检测超声2 h后含有Rot@HMSNs乙醇溶液的鱼藤酮含量,结果表明HMSNs的载药率为46.7%。
2.2 Rot@HMSNs 的释放性能
释放时间在0~10 h时,鱼藤酮的释放量略大于Rot@HMSNs,此时由于HMSNs孔道的束缚和大量鱼藤酮聚集于HMSNs内腔中,限制了鱼藤酮的释放。当释放时间大于10 h后,HMSNs表面和孔道中的鱼藤酮已经完全释放,内腔的鱼藤酮释放不再受到限制,释放量开始大于鱼藤酮原药,在168 h后Rot@HMSNs的鱼藤酮释放量达到74%,鱼藤酮原药的释放量为67%,并且还有缓慢上升的趋势(图2D)。由表1可知,在4种拟合模型中,Rot@HMSNs的释放曲线在Ritger-Peppas拟合模型下具有最高的拟合度,决定系数为 0.990 3,Rot@HMSNs拟合方程的n值为0.44,介于0.43~0.85,符合不规则扩散行为,说明其释放过程中Rot@HMSNs的释放行为存在Fickian扩散和骨架的溶蚀扩散,这是因为HMSNs的合成方法是通过刻蚀法,将实心MSNs转变为HMSNs,在释放过程中,受到释放介质的侵蚀,球体表面破裂,鱼藤酮从HMSNs中释放出来。
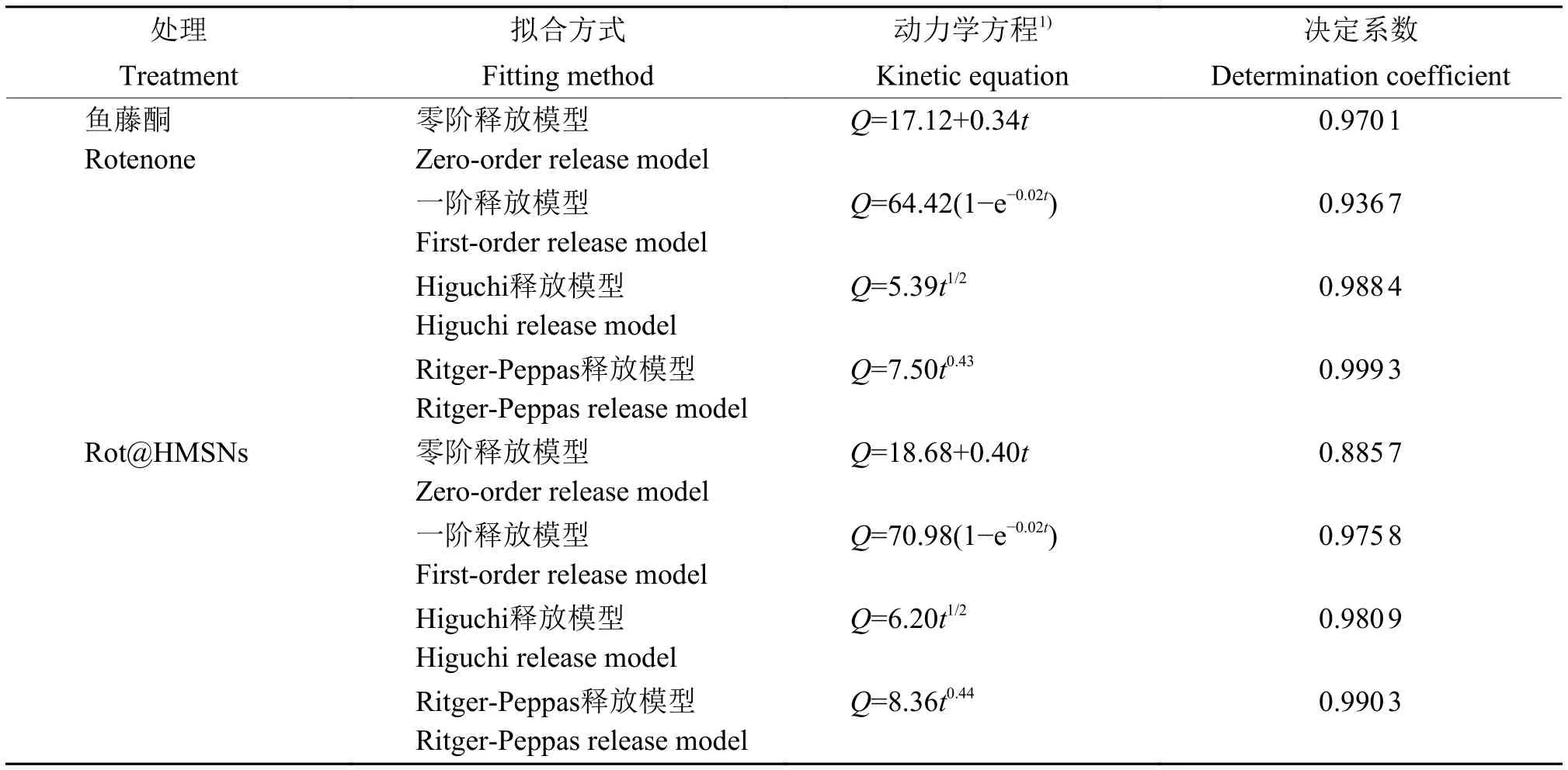
表1 鱼藤酮和 Rot@HMSNs的释放曲线拟合结果Table 1 The release curve fitting results of rotenone and Rot@HMSNs
2.3 Rot@HMSNs的杀虫活性
由表2可知,空白HMSNs对斜纹夜蛾3龄幼虫的 LC50远大于 1 000 mg/L;Rot@HMSNs对斜纹夜蛾3龄幼虫处理24、48和72 h的LC50分别为133.8、104.5 和 84.0 mg/L,并且其杀虫活性高于5 g/L的鱼藤酮微乳剂,说明Rot@HMSNs具有更好的持效性和杀虫活性。取食HMSNs处理的甘蓝叶片以后,斜纹夜蛾3龄幼虫出现了行动缓慢、体积缩小和不取食叶片等现象,说明HMSNs作为鱼藤酮载体具有一定的增效作用。
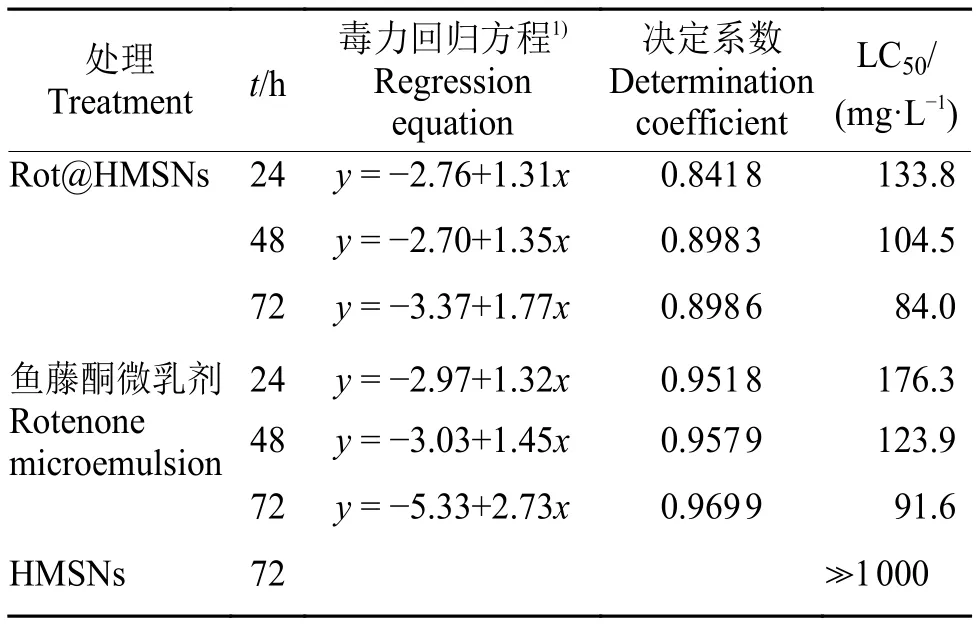
表2 HMSNs 和 Rot@HMSNs 对斜纹夜蛾的杀虫活性Table 2 Insecticidal activity of HMSNs and Rot@HMSNs against Spodoptera litura
2.4 HMSNs在黄瓜植株中的吸收和传导特性
通过激光共聚集显微镜观察到,在经过FITCHMSNs叶面处理24 h以后,在黄瓜植株的处理叶叶柄、处理叶以上部位茎秆、处理叶以下部位茎秆和根部均能够发现较强的绿色荧光,绿色荧光主要集中在植株的细胞壁和维管束,只有少量出现在细胞中,这是由于FITC-HMSNs粒径的限制,无法通过细胞壁的孔进入细胞内部(图3)。为了去除黄瓜植株自发绿色荧光带来的干扰,本研究采用双光子激发,红色荧光显示的即为植物叶绿体,而绿色荧光与红色荧光不重合部分即为被植物吸收的FITCHMSNs,说明HMSNs都能被黄瓜叶片吸收,从而传导到黄瓜植株各个部位,具有负载输送农药的巨大潜力。
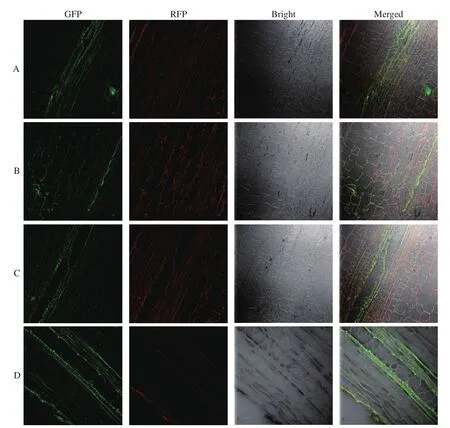
图3 施用 FITC-HMSNs 24 h 后黄瓜植株各部位的激光共聚焦图Fig. 3 Figures of various parts of cucumber plant 24 h after applying FITC-HMSNs using laser confocal microscope
2.5 Rot@HMSNs 在黄瓜植株中的吸收和传导特性
高效液相色谱仪检测分析结果表明,在处理叶片中Rot@HMSNs处理组的鱼藤酮含量远大于鱼藤酮微乳剂处理组,并且在14 d以后还能检测出大量的鱼藤酮,而鱼藤酮微乳剂处理组7 d后已经检测不到鱼藤酮。上部叶片只有在1、3和5 d检测到鱼藤酮,并且Rot@HMSNs处理组的鱼藤酮含量远低于鱼藤酮微乳剂处理组的含量,说明Rot@HMSNs中心鱼藤酮向上传导量较低(图4)。但是,Rot@HMSNs处理组的黄瓜下部叶片和根部均检测出鱼藤酮的存在,并且其含量远高于鱼藤酮微乳剂处理组的含量。研究结果表明Rot@HMSNs具有一定的向上和向下传导的能力,但上部叶片的转移因子远小于下部叶片和根,转移因子的值越大传导能力越强(表3),因此Rot@HMSNs中心鱼藤酮在植株中向下传导的能力远大于向上传导的能力。
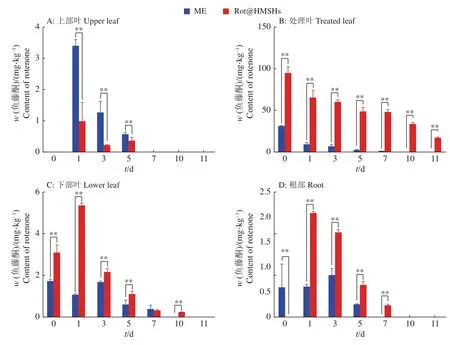
图4 黄瓜植株各部位中鱼藤酮的含量Fig. 4 Content of rotenone in various parts of cucumber plants
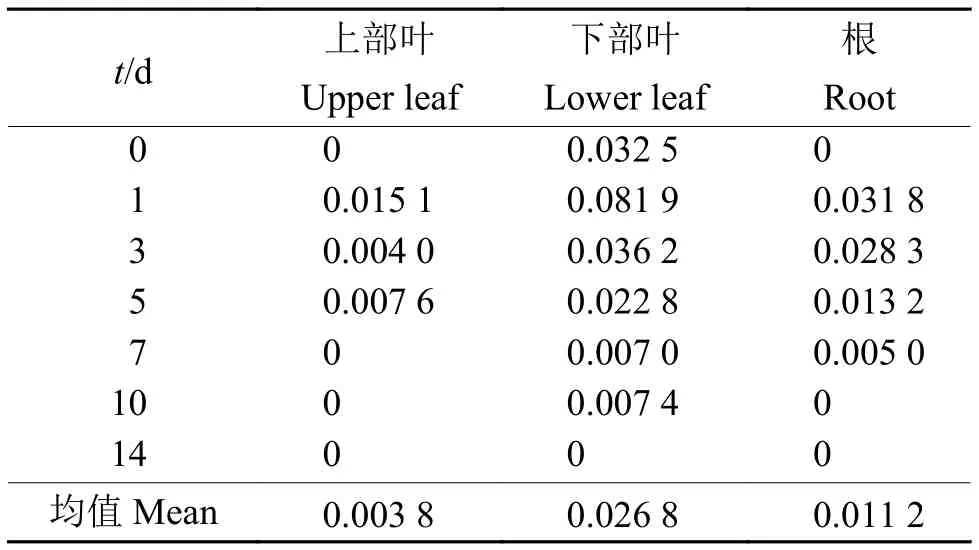
表3 不同处理时间 Rot@HMSNs 在黄瓜植株不同部位中的转移因子Table 3 Transfer factors of Rot@HMSNs in different parts of cucumber plant under different treatment time
由Rot@HMSNs和鱼藤酮微乳剂处理组的黄瓜植株中鱼藤酮的总含量分布图(图5)可知,Rot@HMSNs处理过后,鱼藤酮在黄瓜中的总含量远大于鱼藤酮微乳剂处理组。虽然鱼藤酮微乳剂处理组的黄瓜植株能够使少量鱼藤酮被植物吸收,但是大量的鱼藤酮在施加到处理叶片后,直接裸露于环境中,容易受到光照、空气和水等环境因素的影响,导致鱼藤酮无法到达目标部位,大大降低了利用率。然而HMSNs能够大量负载鱼藤酮于孔道和内腔中,避免鱼藤酮受外界环境影响而发生光降解、水解和氧化等反应,有利于加强鱼藤酮的稳定性,提高持效期,从而提高鱼藤酮的有效利用率。对施药黄瓜植株的果实进行了鱼藤酮含量测定,结果显示黄瓜果实中的鱼藤酮浓度低于检出限0.004 mg/L(在本色谱条件下,鱼藤酮在0.01~25 mg/L内峰面积与其质量浓度间线性关系良好),即黄瓜果实中鱼藤酮的残留量小于0.04 mg/kg,我国规定的鱼藤酮在结球甘蓝中的最大残留限量为0.5 mg/kg[35],此时收获的黄瓜食用安全。
图5 黄瓜植株中鱼藤酮的总含量Fig. 5 Total content of rotenone in cucumber plants
3 结论
采用自模板合成法,制备的HMSNs具有较小的粒径,对鱼藤酮的载药率达46.7%,所制备的Rot@HMSNs的粒径均一,具有较好的分散性和缓释释放特性,增强了鱼藤酮对斜纹夜蛾的杀虫活性,且纳米载体HMSNs有效促进了鱼藤酮在黄瓜植株中的吸收和传导。本研究对减少农药的使用量、降低环境污染、保障粮食、蔬菜食品及生态安全,促进农药产业的可持续发展均具有重要意义。
