丹皮酚通过雌激素受体α调控巨噬细胞表型转换
2022-01-14连娜琦朱子涵殷凡章李文文周喆聿王中扬卞慧敏
连娜琦,朱子涵,殷凡章,李文文,周喆聿,王中扬,吴 祥,李 育,卞慧敏
(南京中医药大学 1. 医学院·整合医学学院,2. 药学院,江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
动脉粥样硬化(atherosclerosis,AS)是一种由脂质代谢紊乱等多种因素引起的血管炎性病变。流行病学研究发现围绝经期女性由于卵巢功能衰竭,体内雌激素水平降低,导致患AS的风险急剧增加[1]。雌激素通过雌激素受体(estrogen receptor,ER)发挥其生物学效应,其主要分为ERα、ERβ两个亚型;研究表明ERα表达下降会促进AS的发生[2]。在AS早期,外周血的单核细胞在趋化因子作用下跨内皮细胞向内皮下迁移并分化成巨噬细胞[3],细胞内脂质代谢异常可促使其表型发生改变,进一步引发炎症反应,并逐步转化为泡沫细胞[4-5]。巨噬细胞表型转化在AS的发生发展过程中发挥了重要作用[6],其可通过血管内微环境改变转化成不同的表型,主要分为经典激活的M1型和非经典激活的M2型。M1型巨噬细胞具有促炎、促氧化应激作用,而M2型巨噬细胞能发挥抗炎和促组织修复作用[7]。丹皮酚(Paeonol)是毛茛科植物牡丹根皮和萝藦科植物徐长卿全草的主要活性成分,具有抗炎症反应、抗氧化应激、抗血栓形成、抗肿瘤等作用。已有研究表明丹皮酚具有减轻动脉粥样硬化炎性损伤的作用[8-9],但是丹皮酚对AS中巨噬细胞表型转化这一方面的研究较少。本研究利用小鼠源Raw264.7巨噬细胞复制M1极化模型,观察丹皮酚是否通过ERα影响巨噬细胞表型转化。
1 材料和方法
1.1 材料
1.1.1细胞株 小鼠巨噬细胞株Raw264.7由上海拜力生物科技有限公司提供。
1.1.2试剂 丹皮酚(北京北纳创联生物公司,150914);肿瘤坏死因子-α(TNF-α)测定试剂盒(南京联科生物公司,ARB13412)、白介素10(IL-10)测定试剂盒(南京联科生物公司,ARB12344)、白介素1β(IL-1β)测定试剂盒(南京联科生物公司,ARB132112)、丙二醛(MDA)测定试剂盒(南京建成生物公司,20151210)、总超氧化物歧化酶(T-SOD)测定试剂盒(南京建成生物公司,ARB12843);Arg-1抗体(北京博奥森公司,bs-23837R);CD163抗体(北京博奥森公司,bsm-54015R)、iNOS抗体(北京博奥森公司,bs-2072R);CD86抗体(北京博奥森公司,bs-2072R);β-actin抗体(Bioword公司,bs-10966R);二抗(Proteintech公司,10285-1-AP);β-雌二醇(Sigma公司,E2758)、ERα选择性阻断剂MPP(Sigma公司,WAY-200070)、ERβ选择性阻断剂PHTPP(Sigma公司,SML1355)。
1.2 方法
1.2.1巨噬细胞培养和经典活化模型的建立 将巨噬细胞培养于含有10%胎牛血清和1%青霉素-链霉素的DMEM培养液中,放置于37 ℃、5% CO2培养箱中培养,每2~3 d换液1次。根据文献选用100 μg·L-1LPS和20 μg·L-1IFN-γ联用刺激巨噬细胞,复制M1极化模型[10-11]。
1.2.2活化巨噬细胞实验分组 细胞贴壁生长于含10%胎牛血清的DMEM培养液中,取对数生长期细胞用于实验。将细胞分为6组:对照组(control)加入DMSO(0.02%,W/V);模型组(model)加入100 μg·L-1LPS和20 μg·L-1IFN-γ;其余4组药物干预组分别在模型组的基础上加入100 nmol·L-1雌激素(E2)、30 μmol·L-1丹皮酚(Paeonol)[12]、30 μmol·L-1丹皮酚+50 μmol·L-1PHTPP[13]、30 μmol·L-1丹皮酚+50 μmol·L-1MPP[13]。细胞加入相应浓度的药物后,放置于37 ℃、5% CO2培养箱中培养24 h,每组实验重复3次。
1.2.3ELISA法检测巨噬细胞上清液中细胞因子的含量 选取第3~5代对数生长期的巨噬细胞,调整细胞密度为1×108·L-1,以每孔2 mL接种入6孔板中培养,细胞同期化后分组处理,分组与药物干预方法同“1.2.2”,作用24 h后终止。收集培养上清液,3 000 r·min-1离心15 min,小心吸去上清液,按照试剂盒说明书ELISA法测定上清液中IL-10、TNF-α、IL-1β、SOD与MDA的含量。
1.2.4Western blot检测蛋白表达 细胞分组和药物干预同“1.2.2”。作用24 h后,提取细胞总蛋白并进行电泳,将蛋白转移至PVDF膜上,置于含脱脂奶粉的封闭液室温封闭2 h。TBST洗膜,加入一抗,4 ℃过夜,TBST洗膜后加入二抗室温孵育2 h,TBST洗膜,用显影液进行显色反应。以β-actin为内参,实验均重复3次。
1.2.5shRNA干扰巨噬细胞ERα的表达 将转染Control shRNA和ERα shRNA的细胞各分为3组,分别为:对照组加入DMSO(0.02%,W/V)、模型组加入100 μg·L-1LPS和20 μg·L-1IFN-γ、丹皮酚组在预先进行极化造模(同模型组)的细胞上加入30 μmol·L-1丹皮酚。再另设一组非转染的空白组,于37 ℃、5%CO2培养箱中培养24 h后检测巨噬细胞活化相关指标,以及提取蛋白进行Western blot实验。
2 结果
2.1 丹皮酚对巨噬细胞经典活化相关细胞因子表达的影响实验结果显示,当巨噬细胞受到100 μg·L-1LPS及20 μg·L-1INF-γ作用后,与对照组相比抗炎细胞因子IL-10含量和SOD含量明显降低,促炎细胞因子TNF-α和IL-1β含量增加以及MDA的含量明显升高。在细胞造模基础上给予E2和丹皮酚后,与模型组相比,IL-10和SOD含量明显升高,且TNF-α、IL-1β及MDA含量明显降低。与此同时,丹皮酚+MPP组与模型组相比所有细胞因子均无差异,而丹皮酚+PHTPP组与模型组相比所有细胞因子表达依然有差异,说明丹皮酚对巨噬细胞因子的效应可能被ERα选择性阻断剂MPP阻断,但ERβ选择性阻断剂PHTPP对丹皮酚的效应影响不明显(Fig 1)。以上结果提示,当巨噬细胞受到LPS和IFN-γ刺激后,巨噬细胞分泌促炎因子增多并加剧氧化应激过程中的活性氧等物质的产生,丹皮酚对其抑制作用与ERα有关。
2.2 丹皮酚对巨噬细胞表型转化相关蛋白表达的影响实验结果显示,当巨噬细胞受到LPS及INF-γ作用后,巨噬细胞M1表型标志物iNOS、CD86的表达升高,M2表型标志物Arg-1、CD163的表达降低,与空白对照组比较差异均具有显著性。给予E2和丹皮酚后,iNOS、CD86的表达降低,Arg-1、CD163的表达升高,与模型组比较差异均具有显著性。同样,丹皮酚+MPP组与模型组相比对目的蛋白的影响无差异,而丹皮酚+PHTPP组与模型组相比目的蛋白的表达存在差异,说明丹皮酚对巨噬细胞表型转换相关蛋白的影响可能被ERα选择性阻断剂MPP阻断,但ERβ选择性阻断剂PHTPP对丹皮酚的效应影响不明显(Fig 2)。以上结果提示,LPS和IFN-γ可诱导巨噬细胞表型向M1型转化,丹皮酚能够促进巨噬细胞表型从M1型向M2型的转化,此过程与ERα相关。
2.3 ERα对丹皮酚抗巨噬细胞经典活化相关细胞因子表达的影响利用慢病毒干扰ERα的表达,进一步验证ERα在丹皮酚对巨噬细胞经典活化中的作用。实验结果显示,空载慢病毒control shRNA不影响丹皮酚对IL-10、TNF-α和IL-1β的作用。而使用慢病毒干扰ERα后,丹皮酚对巨噬细胞经LPS+INF-γ诱导极化模型的干预作用消失,表现为与极化模型组相比,丹皮酚对极化模型下的IL-10、SOD、TNF-α、IL-1β和MDA的干预无明显差异(Fig 3)。上述结果表明,丹皮酚对M1型巨噬细胞活化的抑制作用主要是通过ERα来调控的。
2.4 ERα对丹皮酚抗巨噬细胞表型转化相关蛋白表达的影响首先验证空载慢病毒对丹皮酚的作用没有影响,然后在此基础上使用慢病毒干扰ERα观察丹皮酚对巨噬细胞表型转化相关蛋白的调控作用是否发生改变。实验结果显示,空载慢病毒control shRNA不影响丹皮酚对巨噬细胞表型转化蛋白表达的调控,具体表现为在control shRNA组中,丹皮酚可以明显降低由LPS+INF-γ引起的iNOS、CD86高表达,同时明显上调由LPS+INF-γ引起的Arg-1和CD163蛋白低表达。而在ERα shRNA组中,丹皮酚的这种调控作用明显减弱,丹皮酚给药组和模型组之间无差异(Fig 4)。以上结果提示,丹皮酚促进LPS和IFN-γ刺激的巨噬细胞从M1型向M2型转化,且通过ERα介导。

Fig 1 Effects of paeonol on the expression of cytokines induced by LPS and IFN-γ in macrophages

Fig 2 Effects of paeonol on LPS and IFN-γ-induced expression of macrophage phenotype-related proteins in

Fig 3 Effects of paeonol on the expression of cytokines induced by LPS and IFN-γ in macrophages

A: level of IL-10; B: level of TNF-α; C: level of IL-1β; D: level of MDA; E:level of SOD. **P<0.01 vs Control; ##P<0.01 vs Control shRNA Model;△△P<0.01 vs ERα shRNA Model
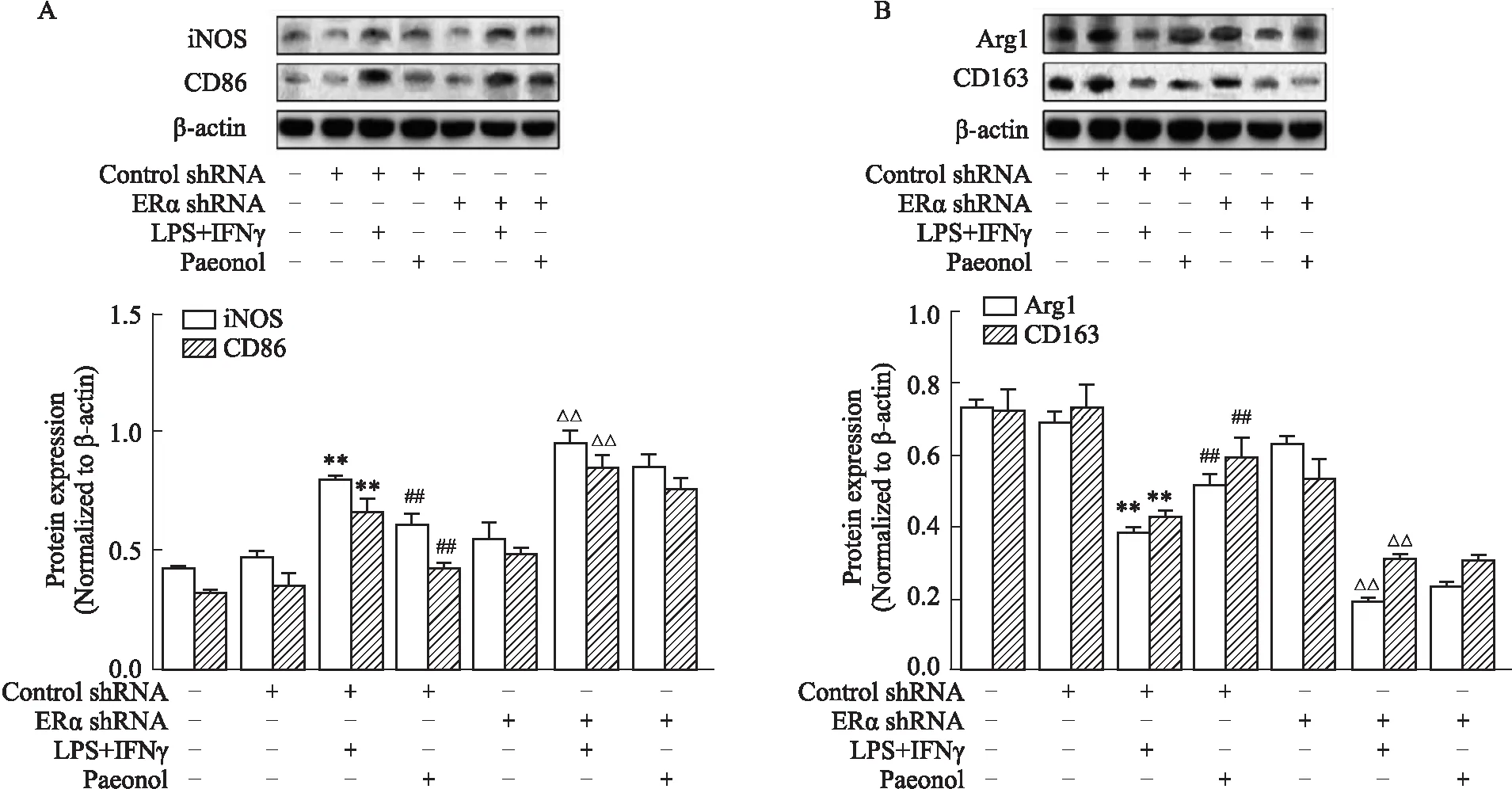
Fig 4 Effects of paeonol on the expression of LPS and IFN-γ-induced macrophage phenotype-related protein expression after ERα shRNA
3 讨论
AS所致多种心脑血管疾病是全球最大的公共卫生问题之一,2020年死亡人数已增加至2 500万,占全球死亡总数的1/3,严重威胁人类健康。研究表明,绝经前妇女心脑血管疾病的发病率明显低于同龄男性,而绝经后妇女心脑血管疾病发病率明显高于育龄妇女,更年期雌激素水平降低,雌激素受体表达异常,是更年期AS发生的病理基础[14]。AS是一种慢性炎症性病变,巨噬细胞参与了AS病理进程的多个环节,具有维持组织内环境稳态的作用,是一种可塑性较强的多功能免疫细胞,其表型和功能随机体组织微环境的变化而变化,继而激活不同亚型相关联的信号通路和转录因子,发挥促炎或抗炎作用。越来越多证据表明,阐明巨噬细胞表型转化机制有助于为治疗心血管慢性炎症性疾病提供新策略。
丹皮酚在临床上已用于防治AS,具有保护血管内皮、抑制血小板聚集、抗氧化、调血脂等作用。本实验研究表明,LPS及IFN-γ诱导巨噬细胞发生氧化应激反应并分泌炎性因子,产生大量iNOS、TNF-α、IL-1β等,丹皮酚能抑制M1型巨噬细胞表型标志物的表达,上调M2型巨噬细胞表型标志物的表达,抑制氧化应激反应,诱导巨噬细胞从M1型向M2型转化,此过程与ERα相关。当ERα被特异性阻断剂或慢病毒干扰沉默后,丹皮酚的抗炎作用降低,而特异性阻断ERβ对丹皮酚的抗炎作用没有明显影响。因此,丹皮酚的抗炎作用主要是通过ERα介导的。
综上所述,丹皮酚抑制巨噬细胞经典活化发挥抗炎抗氧化应激的作用是通过ERα介导的,有助于延缓AS的发生发展。
