基于网络药理学及分子对接技术探讨川芎治疗紧张型头痛潜在分子机制
2022-01-14冉春龙赵欣杰李文辉李梦君刘向哲
冉春龙 , 赵欣杰,李文辉,白 琛, 李梦君,刘向哲
(1. 河南中医药大学,河南 郑州 450046;2.河南省科学院生物研究所,河南 郑州 450008; 3.河南中医药大学第一附属医院脑病一区,河南 郑州 450000)
紧张型头痛 (tension-type headache,TTH) 是1988年国际头痛协会制定的诊断名称,TTH以往称紧张性头痛或肌收缩性头痛,临床也称为神经性头痛,指双侧枕部或全头部的紧缩性或压迫性头痛,多数为发作性,也可表现为持续性钝疼, 一般可伴有头昏、失眠、焦虑或(和)抑郁等症状,也可出现惧光怕声、恶心呕吐等植物神经症状。本病约占头痛患者的40%[1],是临床常见的原发性头痛。近年来其患病率有明显上升的趋势,且应激、紧张、抑郁等情绪波动也可加重其症状。目前应用的治疗药物虽然有效但有较大的依赖性,甚者还可能造成抑郁障碍、嗜睡等副作用[2]。中医药对于头痛有着完整的理论体系及丰富的治疗经验,总结出川芎茶调散、芎芷石膏汤等诸多经典方剂,并在临床上被广泛应用且疗效显著[3-5]。川芎在其中发挥着至关重要的作用。
川芎(LigusticumchuanxiongHort),别名芎藭、生川军、香果,为伞形科,阿米芹族,藁本属[6],性味辛温,有“血中之气药”之称,因其善于活血祛风而止头痛,亦称之为“诸经头痛要药”。临床上更有“头痛不离川芎”一说,目前已发现川芎具有镇痛、抗炎、抗氧化、抗肿瘤、 抗凝血、抗抑郁、抗衰老、抗动脉粥样硬化、细胞保护、改善心功能等作用[7]。然而,虽然川芎作为经验用药在临床上被广泛应用于治疗头痛,且效果明显,但大多数研究只停留在临床或动物实验等宏观效果,而对于其药效物质基础及分子水平作用机制等方面尚不明确。本文欲通过中药网络药理学及分子对接,对川芎治疗TTH可能的靶点进行数据挖掘,解析其对TTH具体的分子作用机制。
1 材料与方法
1.1 数据库中草药系统药理学平台(TCMSP)数据库(http://lsp.nwu.edu.cn/tcmsp.php);疾病数据库Genecard(https://www.genecards.org/);Uniprot 数据库(https://www.uniprot.org);反向药效团匹配数据库PharmMapper (http://59.78.98. 102 /pharmmapper/submit_file.php );蛋白互作网络数据库 String (https://string-db. org/cgi/network.pl);Cytoscape软件 3.8.0(https://cytoscape.org/);GO、KEGG 富集分析数据库(https://metascape.org/gp/index.html#/main/step1);Venny2.1;Rx64 3.6.0;ChemBio3D Ultra 17.0;RCSB Protein Data Bank (www.rcsb.org);AutodockTools 1.5.6;Free Maestro 11.9。
1.2 筛选川芎的有效活性成分及靶点在TCMSP数据库中以“川芎”为关键词,挖掘出与川芎有关的所有活性成分,根据药物代谢动力学(ADME-吸收、分布、代谢、排泄)原理,规定药物口服生物利用度≥30%,类药性≥0.18的化合物为川芎的有效活性成分,再通过PharmMapper平台,检索出每个活性成分的相关靶点,然后使用Uniprot 数据库中记录的Human的相关基因,将筛选出的川芎活性成分靶点转换为对应的Gene symbol,为接下来构建“药物-活性成分-靶点基因-疾病”网络做准备。
1.3 获取TTH相关基因,并与川芎活性成分的靶基因做交集处理,构建Venn图以“Tension type headache”为关键词,检索Genecard 疾病数据库,获取相关疾病基因。将得到的疾病基因与活性成分的靶基因录入,利用Venny2.1软件,取两者交集基因,得到川芎-TTH靶点,并绘制Venn图。
1.4 构建“药物-活性成分-靶点基因-疾病”网络将1.2获得的川芎靶点和1.3获得的川芎-TTH靶点运用 Cytoscape 软件进行拓扑计算,得到“药物-活性成分-靶点基因-疾病”网络,不同的节点分别代表“药物、活性成分、靶点基因、疾病”,并描述各节点之间的联系。
1.5 构建中药-疾病靶点蛋白相互作用网络利用STRING在线软件将中药-疾病靶点输入软件,以种属选择homo sapiens为筛选条件,构建川芎-TTH的蛋白-蛋白相互作用网络,又称PPI网络。最低互动评分设定为0.4。网络中各节点度值代表该蛋白在相互作用中的地位,并用柱状图直观表示前25名蛋白及节点连接数量,各个节点互相连接数量的大小可直接代表其在PPI网络中的重要程度。
1.6 关键靶点的GO功能和KEGG通路富集分析GO功能富集分析是为了进一步分析中药化合物的靶点蛋白在基因功能中的作用,并对其差异基因富集在哪些生物学功能、途径或者细胞定位上有一个粗略了解。KEGG通路富集分析是对基因进行pathway分析,可以了解实验条件下显著改变的代谢通路。将“药物-靶点-疾病”网络中的蛋白利用metascape数据库进行GO富集分析和KEGG通路富集分析。以P<0.01为标准,并绘制气泡图。
1.7 分子对接采用ChemBioDraw Ultra 17.0画出化合物的结构,然后用ChemBio3D Ultra 17.0转化为三维结构,并使用MMFF94力场进行优化。靶点蛋白的三维结构从RCSB Protein Data Bank 下载得到,选取各个蛋白三维结构的PDB ID。本研究采用Autodock vina 1.1.2进行分子对接研究。为了增加计算的准确度,将参数exhaustiveness设置为20。除了特别说明,其他参数均采用原始默认数值。最后,选取打分值最高的构象用Free Maestro 11.9进行结果分析。
2 结果
2.1 川芎中有效活性成分筛选通过对TCMSP数据库中川芎所有有效活性成分及其相关靶点筛选,共搜索到有效成分 189个。以OB≥30%和DL≥0.18为标准进行筛选,共获得有效成分7个。详见Tab 1。

Tab 1 Effective active ingredients of Ligusticum Chuanxiong
2.2 获取有效成分靶点及转换Gene symbol使用PharmMapper平台,以川芎有效成分的MOLID为关键词,逐一挖掘有效活性成分的相关靶点,排除没有相对应基因和重复存在的靶点,以拟合标准≥0.8为要求,最终获取川芎有效活性成分作用靶点105个。然后将筛选出来的靶点基因名利用Uniport数据库转换成Gene symbol。
2.3 绘制Venn图利用 GeneCard 疾病数据库,筛选出TTH相关的疾病靶点信息,共获取靶点2 139个,与川芎最终获得的105个有效活性成分所对应的靶点基因作取交集处理,获得57个共同基因靶点,为川芎治疗TTH的关键靶点。利用Venny2.1软件绘制Veen图,如Fig 1。

Fig 1 Veen diagram of key target points
2.4 构建“药物-活性成分-靶点基因-疾病”网络使用Cytoscape3.8.0软件构建川芎治疗TTH的“药物-活性成分-靶点基因-疾病”网络图,节点之间连线表明成分-靶点-通路之间的靶向关系,连线两端分别代表着药物的活性成分和疾病靶点,线条的数量代表着对应的靶点数量,连线越多越密集,节点在网络中越占据核心地位。通过网络图可知,谷甾醇与疾病靶点之间有1条连线,杨梅酮、洋川芎醌、川芎哚均有5条连线,川芎萘呋内酯有12条连线,FA有13条连线,而扁桃醇有16条连线。这表明川芎的7个有效成分均能对疾病靶点产生作用,其中以扁桃醇和川芎萘呋内酯与疾病关系最为密切,在网络图中居于核心位置。
2.5 关键靶点蛋白互相作用网络在String 数据库中以combined_score(关联评分)设定为0.4为标准,得到靶点相互作用网络图(Fig 2),其中“边”代表作用靶点之间的关联,节点代表作用靶点。由图可知,共有54个互相关联的节点、235条边,平均节点度为8.25,平均局部聚类系数为0.688。在网络中,邻接节点数目越多,成为核心基因的概率越大。根据degree大于中位数值6,制作前25名的柱状图(Fig 3)。对 PPI网络进行拓扑分析,以BC大于中位数0.001 666 625,CC大于中位数0.516 129 032,degree大于2倍中位数值12,筛选得到ALB、MAPK1、SRC、EGFR、CASP3、MAPK14、MAPK8、ESR1、PGR、AR、IGF1R、ANXA5、PLG、MMP3、BMP2等15个核心靶点(Tab 2)。其中ALB度值最高,处在核心地位。这些靶点可能在川芎治疗TTH中发挥重要作用。

Tab 2 Topological properties of 15 core targets

Fig 2 Interaction network of key target proteins

Fig 3 Bar chart of node degree value
2.6 GO富集分析基因组中的所有基因都被用作富集背景。收集P<0.01、最小计数为3、富集系数为1.5%。GO富集分析得到相关条目共215条,其中生物学过程(biological process,BP)143条,主要表现在蛋白质丝氨酸/苏氨酸激酶活性的调节、生殖结构发育、肽基丝氨酸磷酸化、对脂多糖的反应、细胞外结构组织、蛋白质定位建立的积极调控、氮化合物的细胞反应等方面;细胞定位(cellular compon,CC) 23条,主要表现在血液微粒、谷氨酸能突触、薄膜筏、质膜蛋白复合物、轴突等方面;分子功能(molecular function,MF) 49条,主要表现在蛋白激酶活性、丝氨酸型内肽酶活性、磷酸腺苷激酶活性、α-淀粉酶活性、激活素结合、胰岛素受体结合等方面。根据P<0.01,取3个分支各自数量排名前20位相关条目信息制作气泡图,见Fig 4。
2.7 KEGG通路富集分析KEGG通路富集分析,根据P<0.01,共获得68条通路,结果中主要涉及松弛素信号通路、前列腺癌、粘附结、孕酮介导的卵母细胞成熟、病毒致癌作用、淀粉和蔗糖代谢、foxo信号通路、白介素-17信号通路、MAPK信号通路、Th17细胞分化等。取前20位信号通路制作气泡图,见Fig 4。
2.8 分子对接验证对筛选得到的7个有效成分和15个核心靶点进行分子对接,配体及蛋白基本信息见Tab 3。为了从分子水平阐明蛋白和化合物的作用模式,将化合物对接至蛋白的活性口袋,其亲和力见热图(Fig 5),并取打分较高的结合较好的蛋白和小分子作图分析,CASP3-MOL000433、CASP3-MOL002151、MAPK1-MOL000359、MAPK14-MOL002 140,见Fig 6。
MOL000433结合到CASP3蛋白活性位点,并且和LYS 155、ASN 73、SER 85 3个氨基酸形成氢键相互作用,此外与LYS形成一个PI-cation相互作用。MOL002151结合到CASP3蛋白活性位点,并且和LYS 174和TYR 239两个氨基酸形成氢键相互作用。MOL000359结合到MAPK1蛋白活性位点,并和MET 108形成氢键相互作用。MOL002140结合到MAPK14蛋白活性位点,并和MET 108形成氢键相互作用,此外与TRP 197形成多个PI-PI相互作用和PI-cation相互作用。这些氢键相互作用是蛋白和化合物之间最主要的作用力。所有的这些相互作用使得蛋白3CL pro和化合物形成稳定的复合物。
总之,分子对接研究表明MOL000433(FA)、MOL002151(洋川芎醌)、MOL000359(谷甾醇)、MOL002140(川芎哚)与靶点蛋白结合较好,可能是川芎治疗TTH过程中发挥疗效的关键成分。

Tab 3 Molecular docking protein information table
3 讨论
本研究利用网络药理学及分子对接技术初步探讨了川芎治疗TTH的作用机制,通过活性成分筛选及PPI网络拓扑分析得出相关的7个有效成分与15

Fig 5 Molecular docking thermogram
个核心靶点。其中主要活性成分有川芎萘呋内酯、杨梅酮、扁桃醇、川芎哚、洋川芎醌、谷甾醇、FA等,涉及 ALB、MAPK1、SRC、EGFR、CASP3、MAPK14、MAPK8、ESR1、PGR、AR、IGF1R、ANXA5、PLG、MMP3、BMP2等15主要靶点。
多数学者认为紧张型头痛的发病与心理压力、焦虑或(和)抑郁等精神因素、血管痉挛、肌肉紧张等有关。相关研究指出,焦虑及抑郁是TTH的常见心理因素,氧化应激与抑郁及(或)焦虑的关系匪浅,而谷甾醇具有抗氧化作用[8],可通过氧化应激对抑郁及(或)焦虑的缓解从而达到减轻TTH疼痛的作用。另有实验证明[9],川芎在抗抑郁方面有显著效果。改善脑部循环,解除血管痉挛同样可以有效地缓解TTH[10],而洋川芎醌具有显著的扩张血管作用[11],可通过改善脑部灌注, 纠正脑血管痉挛,从而达到治疗TTH的作用。川芎哚除了具有通过增加血小板内cAMP和cGMP含量、解除血小板聚集等环节发挥抗凝作用,从而达到疏通血管的作用。马宁宁等[12]实验研究确定了川芎发挥抗炎功效的有效成分为其所含有的洋川芎内酯,可有效抑制炎性信号的转录,进而干预其下游因子的表达,并有效发挥抗炎的作用。孙存霞等[13]亦指出川芎中所含有的洋川芎内酯A和洋川芎内酯C具有较好的抗炎功效,可用于减轻各种疾病中的炎症反应,故推测通过减少炎症因子异常分泌可起到治疗TTH的疗效。
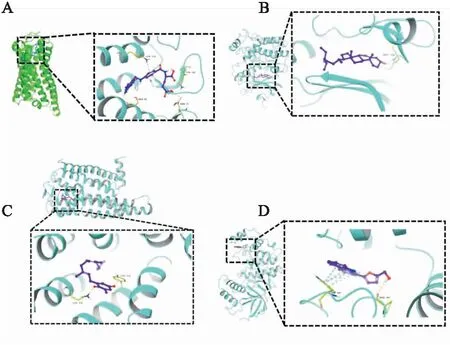
Fig 6 Molecular docking diagram
PPI网络结果显示,15个核心靶点中以CASP3、MAPK1、MAPK14与川芎有效成分结合活性最强烈。CASP3是细胞凋亡中关键的蛋白酶,在细胞凋亡蛋白酶级联反应中处于核心地位。MAPK1是MAPK信号通路中的关键激酶。MAPK1在突触可塑性、神经活动和连接中起着关键作用。此外, MAPK1能通过激活MAPK级联反应在缺血神经元和完整脑细胞的凋亡中发挥重要作用[14]。MAPK14表达异常与炎症反应密切相关,当机体受到刺激后,可通过活化MAPK14蛋白来启动炎症级联反应[15]。MAPK信号通路是细胞内信息传递的主要信号通路之一,可调节细胞多种病理生理过程,其过度激活或表达减少会导致各种疾病的发生发展[16]。松弛素可通过其相应的受体-G蛋白偶联受体7和8发挥舒血管效应[17],还可通过抑制前纤维化因子, 刺激金属蛋白酶诱导基质降解, 起到抗纤维化作用,从而实现对血管的保护,保证脑部循环的充盈,以缓解TTH的发作。白介素-17是一种致炎细胞因子,可通过活化的T细胞产生,并可促进炎性细胞因子的释放来放大炎症反应。
综上所述,本研究以临床常用药物-川芎为探讨对象,通过网络药理学及分子对接分析,初步论证了川芎主要通过谷甾醇以抗氧化;川芎哚及洋川芎醌以疏通血管;抑制CASP3以实验细胞保护;调节松弛素信号通路以抗纤维化;调控白介素-17信号通路及MAPK信号通路,作用于MAPK1和MAPK14等靶点以抗炎等可能。提示川芎可能通过抗炎、抗氧化及细胞保护作用对紧张型头痛发挥治疗作用,为进一步的研究奠定了基础。但该研究没有具体实验验证,有效成分的责任靶点及关键疗效通路尚不明确,且临床中川芎多配伍其他药物使用,其他药物的作用及相互之间的协同作用亦需要进一步分析,这也是作者及其团队接下来研究的一个出发点。
