基于培养组学的肠道菌群培养及鉴定方法研究
2022-01-14谭寅凤许潆月何抒阳周艳秋
刘 莹,谭寅凤,张 迎,孙 菲,许潆月,何抒阳,周艳秋,于 苗
(吉林市人民医院,吉林 吉林 132001)
随着人类微生物组计划的提出,肠道菌群逐渐成为微生物领域研究的热点.有研究[1-2]表明:肠道菌群与人类健康及相关疾病的发生、发展密切相关,因此,肠道菌群检测及鉴定日益受到专家学者们的关注.目前,肠道菌群常用的检测方法主要包括16S rRNA基因序列分析技术、组学(宏基因组、宏转录组、蛋白质组)、代谢组学及培养组学等不同检测技术.16S rRNA基因序列分析技术和宏基因组测序技术均为高通量测序技术,其能够准确地描述微生物群落,并且具有功能预测等特点,在科学研究中被广泛应用.但是高通量测序技术成本昂贵,花费时间长,技术要求高,不能辨别菌的死活,不能区分同一菌种的不同菌株[3-4],因此,临床上开展16S rRNA基因序列分析技术和宏基因组测序技术检测患者的肠道菌群受到限制.不同技术有不同的检测阈值,例如宏基因组学仅能分析每克粪便含有>106数量的细菌,PCR仅能分析每克粪便含有>104数量的细菌,而培养组学能分析到每克粪便含有>102数量的细菌.因此,培养组学的研究阈值低于宏基因组学和PCR法,更加灵敏.
肠道菌群培养组学技术具有简便、实用、成本低等优势,LAGIER J C等[5]率先利用培养组学技术获得肠道中优势菌群,使得肠道菌群培养及鉴定技术在临床上具有潜在的应用价值.但是目前关于人体肠道菌群培养条件的研究较少,并且尚未有利用光密度(optical density,OD)确定最佳细菌接种量的报道.本研究旨在探索一种适宜临床应用的肠道菌群培养及鉴定方法,并可获得评估肠道菌群的相关量化指标,为诊治肠道菌群失调、指导抗菌药物应用、制定微生态调节方案等提供参考依据.
1 实验材料
1.1 材料与试剂
甲酸、乙腈(默克公司,德国);三氟乙酸(Sigma-aldrich公司,美国);IVD Bacterial Test Standard、IVD Matrix HCCA(Bruker Daltonik GmbH,德国);Gifu Anaerobic Medium(GAM,日水制药株式会社,日本);哥伦比亚培养基、沙保罗培养基(郑州安图生物工程公司);Breathe-Easy®sealing membrane(Sigma-aldrich公司,美国).
1.2 主要仪器
Microflex LT/SH型基质辅助激光解吸电离飞行时间质谱仪(MADLI-TOF MS,布鲁克科技有限公司,德国);BACTRONI-2型厌氧培养箱(SHELLAB公司,美国);Heratherm IGS100型微生物培养箱、371型二氧化碳培养箱(Thermo Fisher Scientific公司,美国);Smartcountert-1型全自动菌落计数器(广东环凯微生物科技有限公司);SYNERGY H1型多功能微孔板检测仪(BioTek公司,美国);ULUP-IV-40L型超纯水机(四川优普超纯科技有限公司).
2 实验方法
2.1 培养基的选择及制备
厌氧菌培养选择GAM(用于厌氧菌培养和抗菌药物敏感性试验的培养基),准确称取9.25 g的GAM粉末于烧瓶中,并加入125 mL去离子水完全溶解,115 ℃高压灭菌15 min,当高压灭菌器温度降至90 ℃左右时,制作厌氧培养基平板,放入厌氧培养室中过夜,除氧备用[6-7].需氧菌培养选择哥伦比亚培养基[8-9],真菌培养选择沙保罗培养基[9-10],培养皿的直径均为90 mm.厌氧菌[11]、需氧菌[12]、真菌[13]的培养温度均为37 ℃,厌氧环境为混合气体(90%N2,5%CO2,5%H2).
2.2 标准菌株的培养
2.2.1 标准菌株的选择
选择49种厌氧菌和20种需氧菌,对其进行菌种生长能力的监测,制作生长曲线,确定厌氧菌培养时间和需氧菌培养时间.所选菌种覆盖人体肠道菌群的5大优势菌门,即拟杆菌门、厚壁菌门、变形菌门、放线菌门和梭杆菌门.所有菌种均在-80 ℃冰箱中保存.
2.2.2 厌氧菌和需氧菌培养时间
监测49种厌氧菌标准菌株和一个厌氧菌标准菌株混合菌、20种需氧菌标准菌株和一个需氧菌标准菌株混合菌的生长能力.挑取1~4个菌落置于4 mL GAM中,充分振荡混匀,10倍稀释,设为3个不同的浓度,每个浓度设置3个平行孔,每个浓度取500 μL接种到96孔培养板中,每块培养板上设置6个阴性对照孔,培养板使用呼吸膜密封(Breathe-Easy®sealing membrane),放入厌氧培养箱中培养.通过检测光密度(OD600)监测细菌生长趋势,总监测时长为48 h.
2.3 临床应用
2.3.1 临床资料及标本采集
选取吉林市人民医院2019年10月—2020年3月20例健康志愿者(对照组),肠道菌群检测前1周内应用抗菌药物治疗的162例患者(实验组)进行接种细菌数的研究,比较两组人群的肠道菌群.所选研究对象均需签署知情同意书,并经过医院伦理委员会审核通过.用无菌粪便标本采集盒中的小勺挑取自然排出的新鲜粪便的不同部位约1 g,放入无菌粪便标本采集盒中送检.
对照组筛选标准:经身体检查无相关临床疾病症状,无肠道相关疾病病史;采样前1个月内无腹泻和便秘史;采样前3个月内未服用过抗菌药物和微生态调节剂.
2.3.2 标本接种、菌落计数及菌种鉴定
接种细菌数:称取100~150 mg新鲜粪便标本,加入4 mL 0.9%的无菌生理盐水(原液),涡旋振荡充分混匀,用无菌生理盐水将原液分别稀释至OD600值为0.060、0.045和0.030进行厌氧菌培养,接种量为5 μL;将原液分别稀释至OD600值为0.070、0.050和0.030进行需氧菌培养,真菌培养接种原液接种量为50 μL.观察生长的菌落数,菌落计数采用全自动菌落计数器.
接种时间:称取100~150 mg新鲜粪便标本,加入4 mL 0.9%的无菌生理盐水(原液),涡旋振荡充分混匀,用无菌生理盐水将原液稀释至最佳OD600值,然后将5 μL稀释的原液接种到GAM上,分别于0、1、2、3 h时接种培养,每个时间点设3个平行样,放入厌氧培养箱中培养.菌落计数采用全自动菌落计数器,菌种鉴定采用MADLI-TOF MS.
菌落计数:培养后生长的菌落均采用全自动菌落计数器计数.
菌种鉴定:培养后生长的菌落种类均采用MADLI-TOF MS进行鉴定.用无菌牙签挑取单个菌落,均匀涂布在靶板孔上,自然晾干,每个靶板孔加1 μL甲酸,自然晾干,然后每个靶板孔加1 μL基质液,自然晾干后上机鉴定.
2.4 统计学分析

3 结 果
3.1 厌氧菌和需氧菌培养时间
49种厌氧菌和一个混合厌氧菌中90%以上的菌种在36 h内到达生长平台期(见图1 a~d);20种需氧菌和一个混合需氧菌中90%以上的菌种在18 h内到达生长平台期(见图1 e~f).


a~d.厌氧菌生长曲线;e~f.需氧菌生长曲线.图1 各菌种生长曲线Fig.1 Growth curve of each strain
3.2 接种细菌数
厌氧培养条件下,OD600值为0.060时,生长的菌落数无法进行精确计数,OD600值为0.045时,生长的菌落数为(462.65±25.86) cfu;OD600值为0.030时,生长的菌落数为(348.75±38.54)cfu;两组比较差异具有统计学意义(P<0.001);需氧培养条件下,OD600值为0.070时,生长的菌落数无法进行精确计数,OD600值为0.050时,生长的菌落数为(444.50±23.77)cfu;OD600值为0.030时,生长的菌落数为(339.35±21.76)cfu;两组比较差异具有统计学意义(P<0.001).见表1.
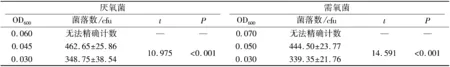
表1 厌氧菌和需氧菌在不同OD600值培养生长的菌落数Tab.1 Colony numbers of anaerobic bacteria and aerobic bacteria cultured in different OD600
3.3 标本采集后的不同接种时间
标本留取后分别于0、1、2、3 h时接种培养,0、1、2 h菌落数和种类多于3 h的菌落数和种类,差异具有统计学意义(P<0.05),0、1、2 h 3组间比较差异均无统计学意义(P>0.05).见图2.

*、#.P<0.05.图2 标本不同留置时间培养生长的菌落数和种类数Fig.2 Number of colonies and species in different indwelling time
3.4 两组患者的肠道菌群相关量化指标
对照组总菌数、厌氧菌数/需氧菌数、革兰阴性菌(G-菌)/革兰阳性菌(G+菌)、杆菌/球菌、益生菌占比高于抗菌药物组,而真菌数低于抗菌药物组,差异具有统计学意义(P<0.001).见表2.
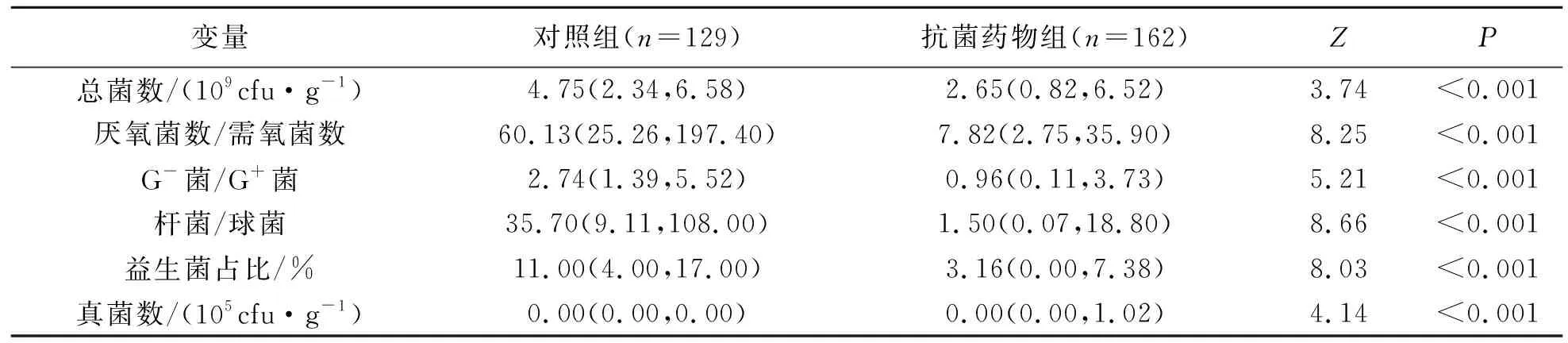
表2 两组患者的肠道菌群相关量化指标分析Tab.2 Quantitative indexes of gut microbiota in two groups
3.5 部分菌种的MADLI-TOF MS鉴定质谱图
部分菌种的核糖体蛋白特征性质谱峰构成该微生物的指纹图谱,用于该菌鉴定.见图3.

图3 部分菌种的MADLI-TOF MS鉴定质谱Fig.3 Mass spectra of MADLI-TOF MS for identification of some strains
4 讨 论
微生物培养法历史悠久,而建立一种更适合于临床应用的肠道菌群优化培养方法显得尤为重要.本研究通过改进培养组学方法,获得一种更适宜临床应用的肠道菌群培养及鉴定方法.
由于受生活习惯、营养状况、性别、疾病情况、治疗用药等因素影响,使得个体间肠道菌群含量差别较大,因此,探索一种适合不同个体间细菌的接种数量是十分必要的.基于培养组学的肠道菌群培养及鉴定方法首次提出采用检测样本以OD600值确定接种数量,可显著减少不同样本间的接种误差:培养人体肠道中的厌氧菌、需氧菌和真菌,并可获得评估肠道菌群的相关量化指标,如细菌总数、厌氧菌数/需氧菌数、G-菌/G+菌、杆菌/球菌、益生菌占比等,能够更全面地反映肠道菌群的特征,对于诊断肠道菌群失调、制定个性化微生态调节方案、指导临床抗菌药物的应用具有重要意义,可为临床诊疗提供一定的参考依据.基于培养组学的肠道菌群培养及鉴定方法具有操作简便、成本低、准确率高和鉴定迅速等特点,尤其在价格上仅为16S rRNA 基因测序技术的百分之一,更具有临床应用价值.基于培养组学的肠道菌群培养及鉴定方法有利于发现新菌种,并为种或亚种的代谢特征、菌株之间的竞争抑制与协同作用、菌株与宿主关系等方面的研究提供活的菌株,为研究特定菌株在疾病发生、发展中的作用机制等后续延展性研究奠定基础.
有研究[6]表明:GAM是一种主要用于厌氧菌培养和抗菌药物敏感性试验的培养基,可作为一种标准培养基培养人体肠道中的优势菌,对培养人肠道菌群具有较高的应用价值,此外,GAM无须补充马血或羊血,经高压灭菌后仍然为透明状态,有利于应用全自动菌落计数器计数,并且容易检测不同时间点的OD600值,能够很好地监测各菌种的生长特性等.哥伦比亚培养基在基础培养基上额外加入了动物血,营养丰富,可培养并分离多种代谢类型的微生物,各种样本均适用[8].临床上由真菌引起的感染逐年增多,沙保罗培养基是临床上培养真菌的常用培养基,可培养多种类型的真菌,如念珠菌、酵母菌、霉菌等[13].本研究已经通过预试验排除了由于营养物质缺乏对生长平台期的影响.在厌氧条件下,49种厌氧菌中90%以上的菌种在36 h内到达生长平台期,故厌氧菌的培养时间选择36~48 h;需氧条件下,20种需氧菌中90%以上的菌种在18 h内到达生长平台期,故需氧菌的培养时间选择18~24 h.常规临床真菌培养为18~24 h,故本研究选择上述时间作为培养真菌的最佳时间[14].考虑到菌种之间的生长抑制和协同作用,本研究通过监测菌种混合后其生长情况,观察到厌氧混合菌和需氧混合菌分别在36 h和18 h内也到达了生长平台期.
本研究结果显示:生长的菌落覆盖整个培养基且菌落之间不相连,为最佳的接种数量.厌氧菌在接种5 μL时,OD600为0.045的样本生长菌落数最多,并且可以精确计数;而需氧菌在接种50 μL时,OD600为0.050时可出现上述情况,因此,本研究将厌氧菌和需氧菌的最佳接种OD600值设置为0.045(5 μL)和0.050(50 μL).健康人粪便中的真菌数量远远低于细菌数量,数量约为细菌数量的一半,故本研究中真菌培养选择接种原液.粪便中的部分菌种对氧或温度等条件敏感,因此,粪便留置时间会对细菌总数及种类产生影响[15-16].本研究发现:在2 h内,随着标本留置时间的延长,培养出的细菌种类数和数量均呈下降趋势,但差异无统计学意义(P>0.05);而标本留置时间延长至3 h接种,其生长的数量和种类进一步减少,与2 h内比较差异具有统计学意义(P<0.05),故标本留取后需2 h内接种培养.
抗菌药物会引起肠道菌群失调,主要以数量、种类和功能多样性的减少、抵抗病原体入侵的能力降低为特征[17].JERNBERG C等[18]研究显示:应用克林霉素后厌氧菌减少、G+菌升高,可能导致总菌数、厌氧菌数/需氧菌数、G-菌/G+菌、益生菌占比降低,应用环丙沙星后肠杆菌科减少,可能导致杆菌/球菌降低,与本研究结果类似.本研究培养出的细菌总数为109~1010cfu/g,与RETTEDAL E A等[7]的研究结果一致.应用抗菌药物导致肠道菌群失调,真菌感染的机会增加,粪便中培养出真菌的数量增加,与王虑等[19]的研究一致.为获得较高的鉴定率,在操作过程中要挑取单个菌落,为防止涂布混菌,挑取菌落的量要适宜,涂布不宜过厚或过薄,涂布要均匀,靶板要清洗干净;同时,菌种的蛋白质图谱库要及时更新.未被鉴定出或未被准确鉴定时,可采用甲酸提取法处理.若仍未被准确鉴定,将菌种冻存以备后续测序用.本研究建立的人类肠道微生物培养组学法可培养鉴定出人体肠道中的优势菌,并可获得评估肠道菌群的相关量化指标,成本低,操作简便,对于诊治肠道菌群失调、指导抗菌药物应用具有临床价值.
本研究也存在一定的局限性,由于选取的人群样本量有限,市售的培养基和机器鉴定通量的限制,尚不能培养及鉴定人体所有的肠道微生物;操作中也会产生误差,如稀释误差、涂布丢失、未被准确鉴定等.此外,本研究中对真菌的研究也不够深入,在后续的研究中,将加大样本量,重点研究真菌的培养及鉴定,以探索人体肠道菌群的更真实、准确的特征,为临床诊断肠道菌群相关疾病提供参考依据.
