新型稀土镁合金螺钉体内促骨修复及体外生物相容性研究
2022-01-14张雁儒徐景超李洁洁余进伟
张雁儒, 杨 越, 徐景超, 李 昊, 李洁洁, 余进伟
新型稀土镁合金螺钉体内促骨修复及体外生物相容性研究
张雁儒1,2, 杨 越1, 徐景超1, 李 昊3, 李洁洁3, 余进伟4
(1.河南理工大学 骨科研究所, 河南 焦作 454001; 2.宁波大学 医学院, 浙江 宁波 315211; 3.河南理工大学 医学院, 河南 焦作 454001; 4.河南理工大学第一附属医院 骨科, 河南 焦作 454002)
为测试新型稀土镁合金的生物相容性及降解产物致敏性; 评价新型稀土镁合金螺钉对骨伤模型的治疗效果, 基于NZ30K镁合金添加Mn元素制成新型稀土镁合金, 并通过后期加工制成不同规格的螺钉. 将稀土镁合金螺钉浸入磷酸盐缓冲液中制作浸提液, 于大鼠后肢背部皮下注射, 观察浸提液皮下致敏性. 将螺钉打磨制成圆片植入到大鼠皮下, 观察皮下降解产气情况, 以可吸收骨蜡作为对照同位置皮下植入. 建立兔骨损伤模型, 将稀土镁合金植入, 定期拍摄X光检查螺钉降解情况, 按照时间顺序分别于8周、12周、16周处死实验兔制作肝肾切片、骨切片, 评价肝肾毒性及体内降解情况; 同期以ZA75镁合金为基础添加0.3% Mn元素制成新镁合金, 作为对照组对比稀土镁合金对大鼠骨髓间充质干细胞成骨分化效果. 将浸提液过滤稀释后添加至细胞培养板中, 加入成骨诱导液培养, Westernblot蛋白电泳实验测定骨保护蛋白(OPG)表达情况. 新型稀土镁合金浸提液未表现出致敏性, 皮下降解结果显示植入初中期有气腔产生, 中后期气腔消失, 镁合金完全降解; 组织切片显示, 兔股骨螺钉植入在前中期有一定肝肾毒性, 植入中期促骨生长效果相较于前期更为明显, 植入后期未见明显肝肾毒性, 螺钉降解完全, 植入部位骨质增强; 兔股骨植入降解结果显示植入前期未观察到明显的促进骨生长效果, 螺钉与骨质嵌合紧密, 植入中期促骨生长修复效果呈现, 局部骨组织出现膨隆包裹住螺钉降解产物, 植入后期螺钉完全降解, 植入位置有一小孔未闭合, 股骨近端明显膨隆; 蛋白电泳实验显示, 新型稀土镁合金浸提液可增加OPG表达, 具有良好的生物相容性. 基于NZ30K开发的新型稀土镁合金在动物实验及细胞实验阶段表现出良好的生物相容性, 可为临床应用提供一定参考.
稀土镁合金; 骨修复; 体外生物相容性; 骨保护蛋白
在过去的研究中, 镁及其合金具有相似的弹性模量、无毒性和可降解性, 被认为是最有前途的体内生物医学植入材料, 在临床治疗心血管堵塞及骨科、口腔领域应用广泛[1-3], 在实验阶段同时展现出更加多元的物理特性[4-6]. 而镁作为人体常量元素, 主要储存在骨组织中, 参与诸多代谢过程及其他生物功能. 而二价镁离子作为镁合金腐蚀产物可通过尿液代谢, 避免二次手术取出植入物. 镁基生物医学材料在人体内需要满足基本力学性能及适当的腐蚀行为[7]. 但镁合金的抗腐蚀性能较差, 力学性能不足, 制约了镁合金在医学领域的应用, 通过新的方法获得性能优良的合金以满足使用的需求尤为重要[4].
在现有研究成果的基础上, 加入合金元素是提高镁合金力学性能最有效的途径之一, 学者们研究并开发了一系列合金体系, 如Mg-Zn系、Mg- Ca系、Mg-Si系、Mg-Re (Re指稀土)系镁合金[8-10]. 将稀土元素添加到镁合金中可提高镁合金力学性能、耐腐蚀性能、摩擦磨损性能、疲劳性能, 此外对镁合金溶体可起到很好的净化作用[11-12].
本研究基于NZ30K镁合金, 添加0.2% Mn元素, Mg-Nd-Zn-Zr-Mn (平衡-3-0.2-0.4-0.2%)基, 制成新型稀土镁合金, 并加工成骨科内植入物, 包括不同规格的螺钉、接骨板. 通过动物体内实验及蛋白电泳实验评价新型镁合金生物相容性、实际植入降解情况, 为后续研究提供参考.
1 材料及方法
1.1 材料
新型稀土镁合金由焦作新港医疗设备有限公司提供, 合金成分配比为: 平衡-3-0.2-0.4-0.2%, Mg-3Nd-0.2Zn-0.4Zr-0.2Mn, 制成8.0mm×2.5mm (长度×螺体直径)的螺钉, 用于实验兔股骨植入. ZA75镁合金添加0.3% Mn, 配比为Mg-7Zn-5Al- 0.3Mn, 制得后加工成相同规格螺钉. 将螺钉剪去螺头, 打磨螺纹制成直径2mm、厚度1mm的圆片, 植入前同手术器械消毒灭菌. 将螺钉消毒灭菌后置于磷酸盐缓冲液(PBS)中静置48h, 超净台上过滤掉腐蚀残渣, 浸提液置于4℃冰箱留存备用. 同期, 将螺钉消毒灭菌后置于完全培养基中, 放置在培养箱中48h, 过滤后稀释6~10倍4℃冰箱留存备用. 准备常规病理切片耗材及病理切片机、漂烘仪及番红固绿染色液、苏木精-伊红染色液等耗材试剂. 提取大鼠骨髓间充质干细胞(BMSCs), 全骨髓培养后传代种板继续培养. Western blot蛋白电泳相关仪器试剂, 化学发光仪及显影液, 一抗及二抗等. 实验动物由河南理工大学骨科研究所提供.
1.2 方法
1.2.1 皮下致敏及植入实验
实验取SD大鼠麻醉后俯卧位放置于兔台上, 剔除背部及后肢毛发, 抽取0.5mL浸提液于皮下推注, 3个位置间隔约1cm; 另取一只大鼠以0.5mL生理盐水皮下推注作为对照, 观察水肿消除时间及局部反应; 空白组推注0.5mL空气. 大鼠麻醉后于后肢剃毛备皮, 消毒后于股骨部位皮下开口, 塞入灭菌的镁合金圆片, 作为实验组, 对照组植入相同大小的骨蜡, 空白组注射生理盐水, 定期观察记录.
1.2.2 骨植入实验
建立兔股骨缺损模型, 植入螺钉定期观察检测. 首先, 准备手术器械, 试验品及抗生素麻醉剂, 实验兔术前禁食水24h, 麻醉后固定于兔台. 在兔股骨大转子下划开表皮, 分离筋膜肌肉暴露股骨, 利用手持钻及克氏针制造2mm左右缺损, 植入样品螺钉后冲洗手术区域并逐层缝合, 肌内注射抗生素. 分别于8、12、16周拍摄X光, 对实验兔实行安乐死后取出股骨观察.
1.2.3 形态学观察
实验兔处死后取出肝肾组织, 制作肝肾病理切片并进行HE染色; 取出股骨制作脱钙骨切片并进行HE染色、番红固绿染色. 按照常规石蜡切片制作流程, 取材后迅速放置于10%甲醛溶液中固定, 根据取材大小决定固定时间; 取出后流水冲洗10min (骨切片放置在脱钙液中脱钙完全), 梯度乙醇脱水, 50%→60%→70%→80%→90%→无水乙醇Ⅰ→无水乙醇Ⅱ; 放置于二甲苯+无水乙醇混合液中透明30min, 二甲苯溶液中透明30min; 浸蜡, 放置于二甲苯石蜡混合溶液→液态石蜡Ⅰ→液态石蜡Ⅱ; 包埋, 快速将组织放置于包埋盒中, 将液态石蜡倒入浇灌成型, 同时保证无气泡侵入包埋块中; 切片, 将冷却凝固成型的包埋块固定在切片机上, 调整好切片厚度及角度进行切片; 选择完整的切片放置于温水中自然展开, 用载玻片捞起烘片, 放烘箱中烤片固定组织, 防止脱落; 脱蜡至水, 短暂放置于二甲苯溶液后转移到梯度乙醇中, 无水乙醇→90%→80%→70%→60%乙醇; 选择相应染色液进行染色; 奥林巴斯显微镜下观察.
1.2.4 蛋白实验
BMSCs以1×104mL-1接种于24孔板, 培养48h细胞状态良好, 实验组加入1mL浸提液及1mL成骨诱导液, 对照组加入1mL完全培养基及1mL成骨诱导液, 空白组加入2mL完全培养基, 而后每48h换液. 培养至细胞数目约为80%后收集细胞, 加入裂解液冰上裂解而后离心取上清留存备用. 加入30μL 5X上样缓冲液、120μL蛋白样品于200μL离心管中, 水浴锅煮沸5min后冰浴5min留存. 使用10% SDS-PAGE蛋白凝胶, 加入蛋白marker及样品. 观察到样品跑到分离胶底部约2cm时停止电泳, 将凝胶切成合适大小, 取PVDF膜进行转膜2h. 取出PVDF膜用丽春红染色5min, 观察蛋白印迹, 切割出合适条带, 5%脱脂牛奶封闭2h, 4℃一抗稀释液中孵育过夜. 清洗条带回收一抗后二抗孵育2h, 回收二抗并洗膜. 化学发光显影观察记录.
1.2.5 数据处理
数据处理可视化采用Graphpad Prism处理, 数据分析采用均值±标准差, 组间分析采用单因素方差,<0.05表示有统计学差异.
2 结果
2.1 皮下实验
图1所示为皮下致敏实验与合金降解实验.
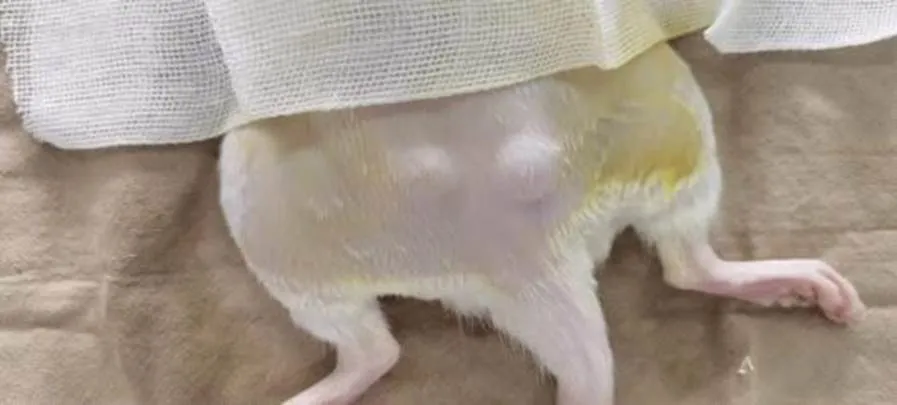
致敏实验中, 实验组未见红肿溃疡等不良反应, 未见组织液渗出, 约20min后皮下水肿消失, 大鼠苏醒后生命体征正常; 对照组未见红肿溃疡等不良反应, 未见组织液渗出, 约10min水肿消失, 大鼠苏醒后生命体征正常.
皮下合金圆片降解实验中, 初期未见植入部位有肿胀情况, 大鼠术后2d完全恢复活动能力, 精神状态良好, 进食水正常; 中期手术部位有不明显皮下气肿, 并且夹杂有少量灰黑色物质, 应为圆片降解产物, 大鼠生命活动均正常; 后期植入部位完全愈合, 缝线脱落并有毛发覆盖, 未见皮下肿胀, 大鼠生命体征平稳正常. 对照组为可吸收骨蜡于相同位置皮下植入, 前、中、后期均未观察到皮下气肿, 前期可触及植入骨蜡, 中期触感不明显, 到后期则完全吸收.
2.2 X光检查及股骨观察
兔股骨螺钉降解X光检测及观察如图2所示.
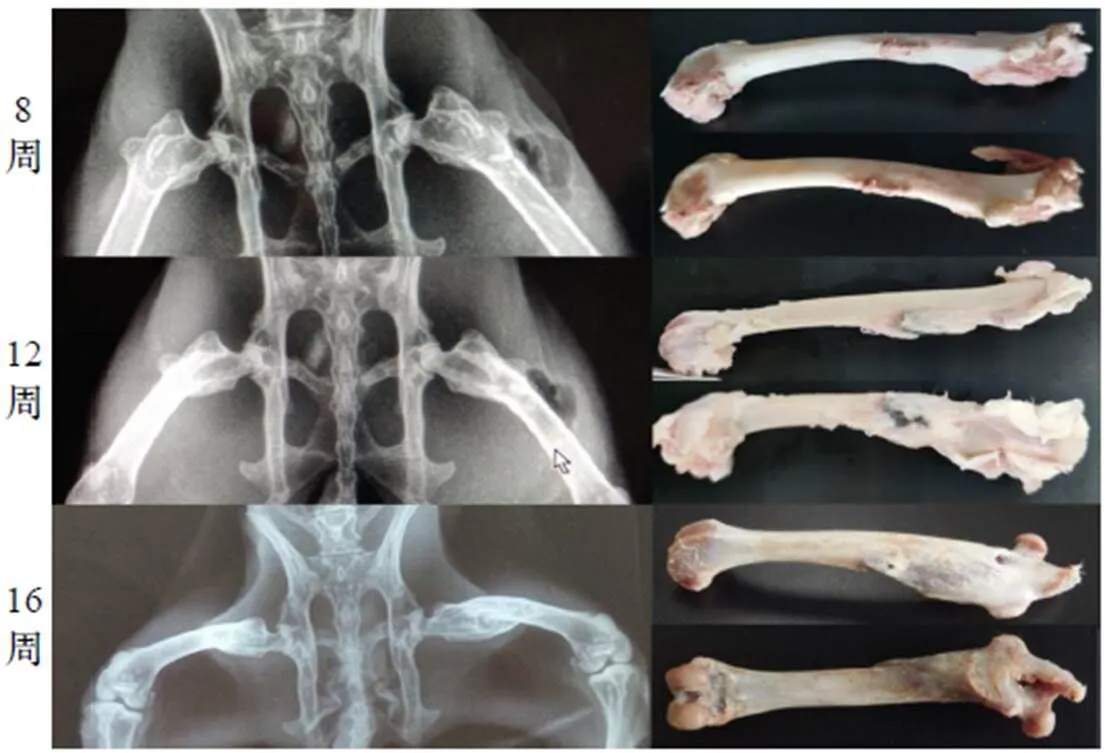
图2 兔股骨螺钉降解X光检测及观察(植入螺钉位于股骨近端)
8周时X光可观察到螺钉尾形状规则圆滑, 手术区有阴影, 应为降解产生的气体, 有较为明显的降解痕迹; 取骨观察到植入部位新生骨与螺纹呈嵌合生长, 同时表现出轻微膨隆, 周围骨质呈亮白色.
12周时X光可观察到缺损处有新生骨质并呈现粘连且趋于完整, 螺钉降解明显, 螺尾位置产生变化, 手术区域气体减少; 取骨观察发现植入部位出现较明显膨隆, 有肌肉粘连在新生骨质区域, 螺钉降解产物融合附着在植入部位, 呈灰黑色.
16周时X光可观察到螺钉降解完全, 无气腔, 植入部位出现明显粗大膨隆, 对比对侧股骨植入镁合金后从大转子至股骨头骨质呈现连接, 股骨腔内出现新生骨; 取骨观察可见植入部位余留有一小孔未完全闭合, 新生骨表面较粗糙, 同时呈现少许棕灰色, 股骨头下方有一孔洞直径约1mm.
此外, 在后期解剖取骨观察时直接植入股骨的螺钉在螺体中段与骨接触位置发生锈蚀, 断裂成两段.
2.3 病理切片观察
从切片分析(图3), 植入初期有一定肝肾毒性, 肝脏细胞有少量炎性浸润, 少量肝细胞脂肪变, 未见肝细胞坏死, 而植入部位骨细胞排列较为整齐, 胞质胞核较为清晰, 可观察到潮线; 植入中期有少量肝脏细胞出现空泡, 肾脏细胞少量炎症细胞浸润, 植入部位骨细胞排列较为凌乱, 新生软骨呈现红色, 成骨细胞呈绿色; 植入后期未见明显肝肾毒性, 骨细胞形态完整清晰, 骨痂区域新生骨质较丰富, 软骨细胞增多.
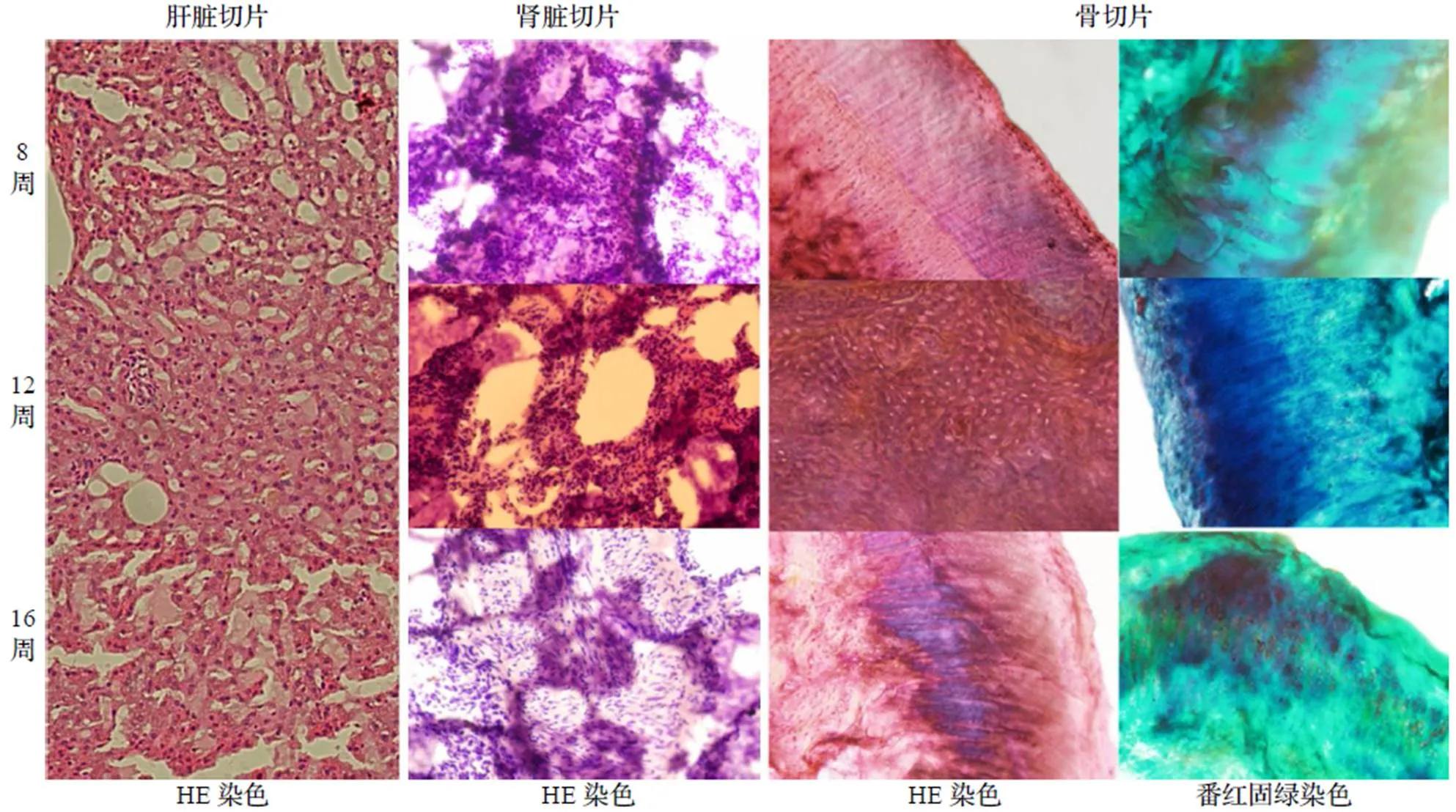
图3 8、12、16周肝肾组织及骨植入部位病理切片
骨保护蛋白(Osteoprotegerin, OPG)表达如图4所示. 结果显示: 实验组OPG表达量显著增加, 高于对照组及空白组, 具有统计学差异, 表明新型稀土镁合金相较于Mg-Zn-Al系合金更有利于BMSCs成骨化.
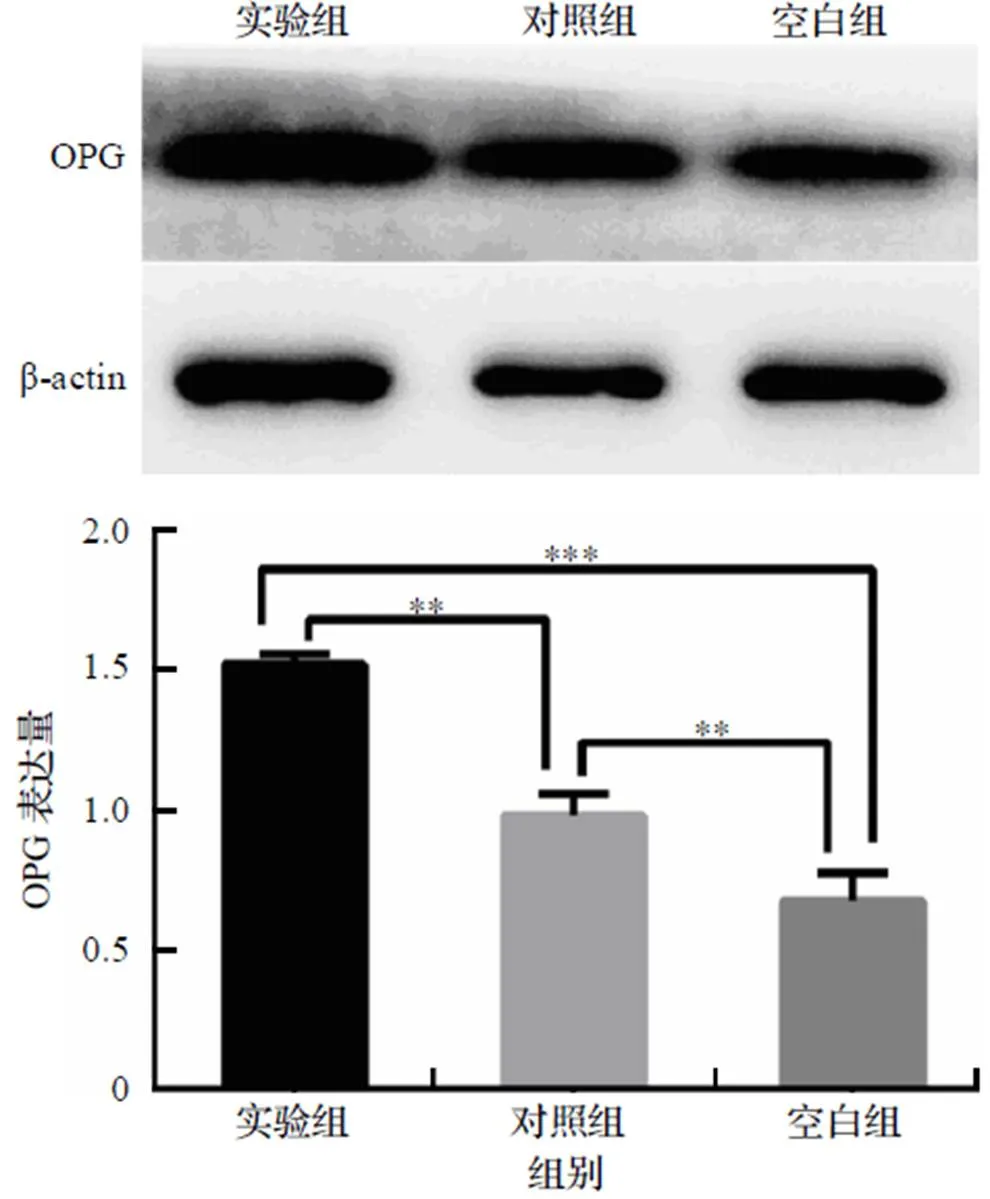
注: ***表示P<0.01, **表示P<0.05.
3 讨论
近年来, Mg-Re系列合金因其优异的耐蚀性和力学性能而备受关注, 同时, 提高镁合金耐蚀性的方法也受到了广泛探讨. 目前提高腐蚀性能最有效的方法是对镁合金进行合金化、热处理和挤压变形等综合处理. 然而, 热处理和挤压都会改变合金的微观组织和i相形貌, 从而导致腐蚀机制改变[4]. 表面保护技术、激光熔覆技术和电化学镀膜技术都是克服合金基体腐蚀问题的有效手段[13]. 保护涂层广泛应用于金属基板防腐, 是经济高效的方法, 在Zhang等[14]研究中, 涂层材料在镁基体表面分布不均匀, PEO层仅为金属基体提供被动腐蚀保护, 而添加Ce元素后PEO-Ce-LDH-P涂层和磷酸盐通过协同效应, 以致密的不溶性沉淀覆盖腐蚀坑, 具有自我修复能力. 制备镁基复合材料是镁合金的另一种防腐措施, 但成本高、加工技术复杂限制了其应用[15]. 与上述方法相比, 许多研究表明, 添加合金元素是提高镁合金耐蚀性能的一种更直接、更有效的方法, 特别是稀土元素, 添加后与杂质形成的金属化合物净化熔体被称为镁合金中的“净化元素”, 此外可形成致密的Res氧化膜提高合金耐腐蚀性[16-17].
目前研究表明软骨细胞在适宜的镁离子浓度中增值分化得到增强, 但较高剂量会抑制软骨生长[18]. 于晓明等[19]在钛合金表面附着一层纯镁薄膜, 发现制得样品浸提液稀释程度越大, 细胞增值率越大, 同时拥有良好的灭杀金黄色葡萄球菌效果. Witte等[20]研究发现, 由镁合金制成的金属植入物在体内降解情况取决于其合金元素的组成. 所有镁合金的腐蚀层在降解过程中都与周围骨直接接触, 并表现出生物磷酸钙的积累. 此外, 与聚合物对照组相比, 测试镁棒周围的骨量得到了提升. 这表明在动物股骨植入试验中, 成骨细胞对降解的镁合金有反应, 镁合金特别是稀土镁合金更适于作为骨科内植入材料. Li等[21]研究发现基于人体中存在的元素开发出新型镁合金成为研究热点. 锶(Sr)元素与Mg、Ca具有相似的化学、生物及冶金特性, 且Sr作为人体微量元素储存在骨骼中[22], 有研究表明Sr能改善骨组织生长, 抑制骨吸收[23], 通过细胞活性实验证实了稀土镁合金有更好的细胞相融性及更低的毒性. 有学者将MgNd2合金添加涂层作为前鼻窦导管支架植入到猪鼻中, 用来评估MgNd2在准鼻窦复杂条件下的降解、生物相容性和功能特性[24]. 结果表明, MgNd2合金与鼻黏膜接触表现出良好的生物相容性, 在整个植入周期中, MgNd2合金前期会引起局部黏膜水肿, 中后期降解层减缓了初始降解速度并提供一定程度的耐腐蚀性. Song等[25]选择Mg-2Znn-0.5Nd (ZN20)合金作为胃肠道吻合钉材料, 收集患者腹腔积液作为溶液介质模拟吻合钉腐蚀微环境. 研究结果证实, 在体外实验中, 吻合钉6d完全降解, 在体内腐蚀条件下则需要8周完全降解, 这种差异可能由体内外微环境差异引起. 同时, 通过血液生化检查及组织病理学实验证实ZN20合金是一种理想的新型胃肠道吻合钉材料, 在临床领域有着巨大的潜力.
OPG主要由骨髓基质细胞和成骨细胞表达, 是TNFR家族非典型成员缺乏跨膜结构域的可溶性诱饵受体[26]. 研究发现, OPG与RANKL结合的亲和力大约是RANK的500倍[27]. 因此, OPG能阻止RANKL与其受体RANK结合, 抑制破骨细胞生成, 保护骨免受破骨细胞过度介导的骨吸收[28-29]. 有研究表明, OPG基因缺陷会导致骨吸收过度, 不仅会增加小鼠骨折率, 还会导致听骨吸收变薄从而表现出进行性听力损失[30]. 此外, OPG也在正常牙齿发育中起到重要作用[31]. Wei等[32]通过胶原蛋白海绵搭载OPG/BMP-2 (骨形态遗传蛋白-2)植入到兔骨骺中, 结果显示愈合初期肌腱与骨界面充满肉芽组织, 而后演变成胶原纤维、纤维软骨以及钙化纤维软骨, 显示出OPG在BMP-2协同下促进成骨分化及新骨形成, 同时促进肌腱与骨之间的愈合.
4 结论
本研究中稀土镁合金在动物及细胞实验中表现出良好的生物相容性. 合金浸提液无明显致敏性, 皮下降解速率相对稳定平缓, 虽然在动物体内植入初期表现出一定的肝肾毒性, 但在中后期逐渐减少, 并且有助于成骨分化以及新骨形成. 从分子生物学角度可以了解到, 新型稀土镁合金可增强OPG表达, 从而起到促进骨质生长的作用. 在后续研究中, 将侧重于从分子生物学角度探究新型稀土镁合金促骨生长过程的具体机制以及参与修复重建的蛋白通路, 为构建合金载药平台提供参考方向.
[1] Liu W, Zhou B, Wu G, et al. High temperature mechanical behavior of low-pressure sand-cast Mg-Gd-Y-Zr magnesium alloy[J]. Journal of Magnesium and Alloys, 2019, 7(4): 597-604.
[2] 王洋洋, 吴红枚, 甄文强, 等. 生物可降解血管支架研究进展[J]. 中国医疗器械杂志, 2021, 45(4):410-415.
[3] 李少鹏, 陈豪杰, 杨帆, 等. 可降解镁金属在骨科中的应用[J]. 生物骨科材料与临床研究, 2021, 18(4):92-96.
[4] Cao X, Xu C, Zhang Z, et al. Effect of I-phase morphology and microstructure transformation in biomedical Mg-3Zn-1Mn-1Y alloysdegradation behavior in dynamic simulated body fluid[J]. Journal of Materials Science, 2021, 56:12394-12411.
[5] Fan X, Liu Y, Xu Z, et al. Preparation and characterization of 8YSZ thermal barrier coatings on rare earth-magnesium alloy[J]. Journal of Thermal Spray Technology, 2011, 20(4):948-957.
[6] Tong X, You G, Yao F, et al. Segregation behavior and its regulating process in as-cast magnesium alloy containing heavy rare earth[J/OL]. Journal of Rare Earths, 2021[2021-09-16]. https://doi.org/10.1016/j.jre.2021.08.009.
[7] Zheng X, Du W, Liu K, et al. Effect of trace addition of al on microstructure, texture and tensile ductility of Mg- 6Zn-0.5Er alloy[J]. Journal of Magnesium and Alloys, 2016, 4:135-139.
[8] Brar H S, Wong J, Manuel M V. Investigation of the mechanical and degradation properties of Mg-Sr and Mg-Zn-Sr alloys for use as potential biodegradable implant materials[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2012, 7(3):87-95.
[9] Shen Z, Zhao M, Bian D, et al. Predicting the degradation behavior of magnesium alloys with a diffusion-based theoretical model andcorrosion testing[J]. Journal of Materials Science & Technology, 2019, 35(7):1393- 1402.
[10] 董天宇. 医用镁合金材料研究进展[J]. 现代盐化工, 2020, 47(2):15-16.
[11] 张景怀, 唐定骧, 张洪杰, 等. 稀土元素在镁合金中的作用及其应用[J]. 稀有金属, 2008, 32(5):659-667.
[12] 杨素媛, 张丽娟, 张堡垒. 稀土镁合金的研究现状及应用[J]. 稀土, 2008, 29(4):81-86.
[13] 许东光, 黄鹏, 马春华, 等. 医用镁合金改性研究进展[J]. 热加工工艺, 2021, 50(18):32-36.
[14] Zhang G, Wu L, Tang A, et al. Active corrosion protection by a smart coating based on a MgAl-layered double hydroxide on a cerium-modified plasma electrolytic oxidation coating on Mg alloy AZ31[J]. Corrosion Science, 2018, 139:370-382.
[15] Donnadieu P, Benrhaiem S, Tassin C, et al. Preparation, microstructure and properties of magnesium-γMg17Al12complex metallic alloycomposites[J]. Journal of Alloys and Compounds, 2017, 702:626-635.
[16] Liu J, Song Y, Chen J, et al. The special role of anodic second phases in the micro-galvanic corrosion of EW75 Mg alloy[J]. Electrochimica Acta, 2016, 189:190-195.
[17] Zeng R C, Sun X X, Song Y W, et al. Influence of solution temperature on corrosion resistance of Zn-Ca phosphate conversion coating on biomedical Mg-Li-Ca alloys[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(11):3293-3299.
[18] Feyerabend F, Witte F, Kammal M, et al. Unphysiologically high magnesium concentrations support chondrocyte proliferation and redifferentiation[J]. Tissue Engineering, 2006, 12(12):3545-3556.
[19] 于晓明, 谭丽丽, 刘宗元, 等. Ti6Al4V表面生物功能纯Mg薄膜制备及性能研究[J]. 金属学报, 2018, 54(6): 943-949.
[20] Witte F, Kaese V, Haferkamp H, et al.corrosion of four magnesium alloys and the associated bone response [J]. Biomaterials, 2005, 26(17):3557-3563.
[21] Li Z, Gu X, Lou S, et al. The development of binary Mg-Ca alloys for use as biodegradable materials within bone[J]. Biomaterials, 2008, 29(10):1329-1344.
[22] Wang J L, Mukherjee S, Nisbet D R, et al.evaluation of biodegradable magnesium alloys containing micro-alloying additions of strontium, with and without zinc[J]. Journal of Materials Chemistry B, 2015, 3:8874- 8883.
[23] Ding Y, Wen C, Hodgson P, et al. Effects of alloying elements on the corrosion behavior and biocompatibility of biodegradable magnesium alloys: A review[J]. Journal of Materials Chemistry B, 2014, 2:1912-1933.
[24] Durisin M, Seitz J M, Reifenrath J, et al. A novel biodegradable frontal sinus stent (MgNd2): A long-term animal study[J]. European Archives of Oto-Rhino- Laryngology, 2016, 273:1455-1467.
[25] Song L, Gao M, Tan L, et al. Application potential of Mg-Zn-Nd alloy as a gastrointestinal anastomosis nail material[J/OL]. Acta Metallurgica Sinica (English Letters), 2021[2021-09-30]. https://doi.org/10.1007/s40195-021- 01296-0.
[26] Boyce B F, Xing L. Biology of RANK, RANKL, and osteoprotegerin[J]. Arthritis Research & Therapy, 2007, 9:S1.
[27] Nelson C A, Warren J T, Wang M W, et al. RANKL employs distinct binding modes to engage RANK and the osteoprotegerin decoy receptor[J]. Structure, 2012, 20(11): 1971-1982.
[28] Infante M, Fabi A, Cognetti F, et al. RANKL/RANK/ OPG system beyond bone remodeling: Involvement in breast cancer and clinical perspectives[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38:12.
[29] Klejna K, Naumnik B, Gasowska K, et al. OPG/RANK/ RANKL signaling system and its significance in nephrology[J]. Folia Histochemica et Cytobiologica, 2009, 47(2):199-206.
[30] Kanzaki S, Takada Y, Ogawa K, et al. Bisphosphonate therapy ameliorates hearing loss in mice lacking osteoprotegerin[J]. Journal of Bone and Mineral Research, 2009, 24:43-49.
[31] Martin T J, Sims N A. RANKL/OPG; Critical role in bone physiology[J]. Reviews in Endocrine & Metabolic Disorders, 2015, 16:131-139.
[32] Wei B, Wang C, Yan C, et al. Osteoprotegerin/bone morphogenetic protein 2 combining with collagen sponges on tendon-bone healing in rabbits[J]. Journal of Bone and Mineral Metabolism, 2020, 38:432-441.
Study on bone promoting repair and biocompatibility of new rare earth magnesium alloy screws
ZHANG Yanru1,2, YANG Yue1, XU Jingchao1, LI Hao3, LI Jiejie3, YU Jinwei4
( 1.Institute of Orthopedics, Henan Polytechnic University, Jiaozuo 454001, China; 2.School of Medicine, Ningbo University, Ningbo 315211, China; 3.School of Medicine, Henan Polytechnic University, Jiaozuo 454001, China; 4.Department of Orthopedics, First Affiliated Hospital ofHenan Polytechnic University, Jiaozuo 454002, China )
To test the biocompatibility and sensitization of degradation products of new rare earth magnesium alloys and evaluate the therapeutic effect of new rare earth magnesium alloy screw on bone injury model, new rare earth magnesium alloy was made based on NZ30K magnesium alloy by adding Mn element, and screws of different specifications were made through post-processing. The extract was prepared by immersing rare earth magnesium alloy screws into phosphate buffer and injected subcutaneously into the back of hind limbs of rats to observe the subcutaneous sensitization of the extract. The screws were polished into discs and implanted into the subcutaneous skin of rats, and the gas production was observed under the subcutaneous degradation. The absorbable bone wax was used as the control to implant the discs at the same position. The rabbit bone injury model was established, the rare earth magnesium alloy was implanted, and the screw degradation was examined by X-ray taking regularly. The experimental rabbits were sacrificed at 8 weeks, 12 weeks and 16 weeks for liver and kidney sections and bone sections, respectively, to evaluate the liver and kidney toxicity anddegradation. At the same time, ZA75 magnesium alloy was added 0.3% manganese to prepare new magnesium alloy, and the effect of rare earth magnesium alloy on osteogenic differentiation of rat bone marrow mesenchymal stem cells was compared as the control group. The extract was filtered and diluted, then added to the cell culture plate, cultured with osteogenic induction solution. The expression of osteoprotegerin (OPG) was determined by Western blot. The new rare earth magnesium alloy extract did not show sensitization, and the subcutaneous degradation results showed that there were air cavities in the early and middle stage of implantation, and the air cavities disappeared in the late stage, and the magnesium alloy was completely degraded. Tissue sections showed that femoral screw implantation had certain hepatorenal toxicity in the early and middle stages, and the effect of promoting bone growth in the middle stage was more obvious than that in the early stage. There was no obvious hepatorenal toxicity in the late stage, during which screw degradation was complete and the bone was enhanced at the implantation site. Rabbit femoral implant degradation observation results show that the implantation at early stage did not significantly promote bone growth effect, and screws and bone chimeric interlocked closely; while at medium-term stage, the repair effects on promoting bone growth were obvious, and local bone tissue wrapped in occurrence of screw degradation products. At late stage, the implanted screws were fully biodegraded, and there was a small hole in the implanation that is not closed, with proximal femur expanding obviously. Protein electrophoresis experiments showed that the new rare earth magnesium alloy extract could increase OPG expression and had good biocompatibility. It can be concluded that the new rare earth magnesium alloy developed based on NZ30K shows good biocompatibility in animal and cell experiments, which can provide some reference for clinical application.
rare earth magnesium alloy; bone repair;biocompatibility; OPG
R608
A
1001-5132(2022)01-0011-07
2021−10−28.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
河南省科技攻关重点项目(201402003).
张雁儒(1970-), 男, 河南西华人, 教授, 主要研究方向: 创伤骨科. E-mail: zyr@hpu.edu.cn
(责任编辑 韩 超)
