母亲乙型肝炎病毒e 抗原阳性对婴儿接种乙型肝炎疫苗的影响
2022-01-13冯静黄红玉陈洁戴毅敏胡娅莉周乙华张昭萍
冯静 黄红玉 陈洁 戴毅敏 胡娅莉 周乙华 张昭萍
1 南京大学医学院附属南京鼓楼医院妇产科 210008;2 南京大学医学院附属南京鼓楼医院科研部210008;3 南京大学医学院附属南京鼓楼医院感染科 210008
HBV 感染严重危害人类健康,母婴传播是HBV感染的主要传播途径。 在乙型肝炎疫苗和乙型肝炎免疫球蛋白 (HBIG) 使用前,HBsAg 阳性孕妇中,HBeAg 阳性者母婴传播率高达70%~90%,而HBeAg 阴性者传播率仅 10%~30%[1]。对 HBsAg 阳性孕妇分娩的婴儿出生后12 h 内注射HBIG,并按0、1、6 月方案接种 3 针乙型肝炎疫苗,HBeAg 阳性者的母婴传播率降至5%~10%,而HBeAg 阴性者的子女几乎无HBV 感染[2-3]。 既往研究认为,胎儿暴露于HBeAg 后可对HBV 产生免疫耐受, 从而在暴露HBV 后无法清除病毒而导致慢性感染[4-5],但亦有学者认为母源性HBeAg 不导致新生儿免疫耐受[6-8]。由于HBeAg 能通过胎盘进入胎儿,检测脐血能反映母婴HBeAg 情况。 本研究比较脐血HBeAg 阳性和阴性婴儿接种乙型肝炎疫苗后抗体的应答水平,探讨母源性HBeAg 是否抑制婴儿对HBV 的免疫应答。
对象与方法
一、研究对象
将 2012 年 4 月至 2015 年 3 月在南京大学医学院附属南京鼓楼医院分娩的265 例HBsAg 阳性母亲及其单胎婴儿纳入作为研究对象。 根据母亲HBeAg 是否阳性分为2 组,HBeAg 阳性母亲及其婴儿组(HBeAg 阳性组,124 例)[9]和 HBeAg 阴性母亲及其婴儿组(HBeAg 阴性组,141 例)[10]。 纳入标准:(1)母亲 HBsAg 阳性;(2)孕期未服用抗病毒药物;(3) 单胎婴儿;(4)HBeAg 阳性组脐血检测 HBeAg阳性,HBeAg 阴性组脐血检测HBeAg 阴性。 排除标准:(1)母亲同时合并其他肝炎病毒感染、HIV 感染;(2)婴儿出生体重<2 500g;(3)婴儿出生孕周<37周;(4)婴儿未按 0、1、6 接种乙型肝炎疫苗者;(5)7~12月龄随访时HBsAg 阳性或抗-HBc 阳性。
收集母亲及其婴儿的临床资料, 包括婴儿性别、出生孕周、出生体重、分娩方式、喂养方式、母亲孕期HBV DNA 水平等。 所有婴儿均在出生后12 h内接种 100 U HBIG,并按 0、1、6 月接种 3 针乙型肝炎疫苗(10 μg 重组酵母疫苗)。两组婴儿在 7~12 月龄时随访乙型肝炎血清学标志。 本研究通过南京大学医学院附属鼓楼医院伦理委员会批准 (审批号:2012019),所有参与母亲均签署知情同意书,婴儿知情同意书由其母亲或其他监护人代签。
二、乙型肝炎血清学标志检测
采用微粒酶免疫测定试剂 (美国雅培公司)定量检测孕妇外周血、分娩时脐血、婴儿7~12 月龄外周血的乙型肝炎标志物,包括HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc。根据婴儿 7~12 月龄时抗-HBs 高低,对乙型肝炎疫苗的免疫应答分为无应答(<10.0 mIU/mL)、弱应答 (10.0~99.9 mIU/mL)、 正常应答 (100.0~999.9 mIU/mL)、高度应答(≥1 000.0 mIU/mL)[11]。
三、统计学方法
采用 SPSS18.0 软件包分析处理数据。 采用Kolmogorov-Smirnov 检验对数据进行正态性检验,符合正态分布的计量资料采用表示, 组间比较采用独立样本t 检验。 非正态分布的计量资料以M(QR)表示,组间比较采用Mann-Whitney U 检验。计数资料采用例数和率表示,组间比较采用χ2检验或Fisher 确切概率法。HBeAg 水平用 lg S/CO 表示,抗-HBs 水平用几何平均浓度表示。 P<0.05 认为差异有统计学意义。
结 果
一、一般情况
表 1 显示,124 例脐血 HBeAg 阳性与 141 例脐血HBeAg 阴性婴儿的性别、出生孕周、出生体重、分娩方式、Apgar 评分、喂养方式、随访月龄比较差异无统计学意义 (P 均>0.05)。 脐血 HBeAg 阳性婴儿母亲孕期HBV DNA 水平显著高于脐血HBeAg 阴性组,见表1。124 例脐血HBeAg 阳性婴儿出生时脐血 HBeAg 中位水平为 1.39 (0.78, 2.04) lg S/CO,低于其母亲外周血中的HBeAg 水平2.80 (1.93, 2.95)lg S/CO,差异有统计学意义(Z=-8.569,P<0.01)。

表1 脐血HBeAg 阳性和阴性母婴一般情况比较
二、 宫内HBeAg 暴露和未暴露婴儿抗-HBs 应答水平
265 例婴儿中,259 例随访时抗-HBs≥10 mIU/mL,总抗-HBs 阳性率为97.7%。 脐血HBeAg 阳性婴儿抗-HBs 阳性率为 97.6%(121/124), 脐血 HBeAg 阴性婴儿抗-HBs 阳性率为97.9%(138/141),差异无统计学意义(χ2=0.025,P>0.05)。 脐血 HBeAg 阳性组婴儿的抗-HBs 几何平均浓度为351.70 mIU/mL, 高于HBeAg 阴性组婴儿的 293.12 mIU/mL (Z=1.294,P<0.05)。HBeAg 阳性组和阴性组婴儿对乙型肝炎疫苗无应答、弱应答、正常应答和高应答的构成比差异无统计学意义(χ2=0.356,P>0.05);抗-HBs 水平的差异也无统计学意义(Z=0.655、1.613 和 1.700,高应答抗-HBs 均≥1 000 mIU/mL,P 均>0.05)。见表2。

表2 脐血HBeAg 阳性和阴性婴儿不同抗-HBs 水平分布情况
三、 不同脐血HBeAg 暴露水平婴儿的抗-HBs应答水平
为观察脐血不同HBeAg 水平对乙型肝炎疫苗的抗体应答是否有影响,我们进一步对124 例脐血HBeAg 阳性婴儿的抗-HBs 水平进行分析。 根据脐血中HBeAg 滴度中位数值(1.39 lg S/CO),比较了脐血HBeAg 滴度≥1.39 lg S/CO 的婴儿与脐血HBeAg滴度<1.39 lg S/CO 的婴儿抗-HBs 水平, 在不同HBeAg 水平的婴儿中,抗-HBs 水平差异无统计学意义(χ2=0.932,P>0.05)。 见表 3。
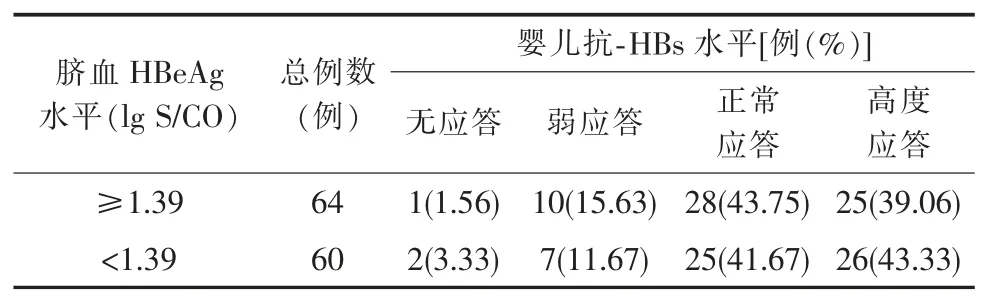
表3 不同HBeAg 水平婴儿的抗-HBs 水平分布比较
讨 论
有学者在孕中期羊水及脐血中检测到HBeAg[12-13],提示HBeAg 自孕中期起即可通过胎盘进入胎儿体内。 既往研究发现,HBeAg 阳性母亲脐血中HBeAg阳性率在90%左右[9,13-14],表明HBeAg 胎盘通过率高。 尽管既往认为母源性HBeAg 能引起胎儿对HBV的免疫耐受[4-5],但本研究结果显示,脐血HBeAg 阳性和阴性婴儿接种乙型肝炎疫苗后,抗-HBs 应答水平差异无统计学意义,证明脐血HBeAg 阳性婴儿对乙型肝炎疫苗的应答没有受到抑制。 这说明宫内暴露HBeAg 胎儿不引起对HBsAg 免疫耐受, 进而提示对HBV 不产生免疫耐受。
正规联合使用乙型肝炎疫苗和HBIG 可阻断绝大多数的HBV 母婴传播[2-3],且大多数婴儿接种乙型肝炎疫苗后均可产生保护性抗体[2-3,15]。本研究中,97.7%的婴儿例随访时抗-HBs 阳性, 与既往研究一致[15]。 124 例脐血 HBeAg 阳性的婴儿抗-HBs 阳性率为97.6%, 与脐血 HBeAg 阴性婴儿抗体阳性率(97.9%)相似,且前者抗体水平略高,表明胎儿暴露HBeAg 未影响对乙型肝炎疫苗的免疫应答。 进一步研究发现,脐血HBeAg 阳性婴儿中,不同HBeAg 水平的婴儿抗-HBs 水平无差异,提示婴儿对乙型肝炎疫苗的免疫应答与脐血中HBeAg 水平无关,再次说明宫内暴露HBeAg 不影响对乙型肝炎疫苗的免疫应答。
本研究不足之处是未纳入HBsAg 阴性即未感染HBV 母亲的子女,但有研究表明,HBsAg 阳性母亲婴儿抗-HBs 阳性率与HBsAg 阴性者无差异[16],可以认为与HBsAg 阴性母亲的子女相比,HBeAg 不影响婴儿乙型肝炎疫苗免疫应答;其次,未对抗-HBs≥1 000 mIU/mL 者进行稀释定量精确检测, 但既往研究认为抗-HBs≥1 000 mIU/mL 属于对乙型肝炎疫苗高度应答[11],通常无需再稀释定量检测抗-HBs。综上所述,胎儿暴露于HBeAg 不影响对乙型肝炎疫苗免疫应答,不导致对HBV 产生免疫耐受,胎儿时期暴露于母源性HBeAg 可能与新生儿慢性HBV 感染的发病机制无关。
利益冲突所有作者均声明不存在利益冲突
