MicroRNA-30a、microRNA-181a在原发免疫性血小板减少症中的表达及其临床意义*
2022-01-13谭琳谢瑜杨坚黄颖
谭琳,谢瑜,杨坚,黄颖
(昆明医科大学第一附属医院 血液科,云南 昆明650032)
原发免疫性血小板减少症(immune thrombocytopenic purpura, ITP)病理机制为血小板计数(platelet count, PLT)下降,伴或不伴皮肤黏膜出血,其发病机制尚存在争议,认为免疫作用在其中起主导地位[1]。ITP 发生后,B 淋巴细胞功能亢进,产生针对血小板抗原的自身反应性抗体,导致血小板的破坏增加和生成减少[2]。近年来有研究报道,ITP 发生、发展的分子机制可能与microRNA(miRNA)有关,认为其可通过与靶基因的3′-非编码区(UTR)结合而对靶基因的表达发挥负向调节作用,调节多种蛋白的合成而参与多个细胞生物活动过程[3]。多种miRNA 表达与自身免疫性疾病的发生、发展有关,目前报道的有miR-142、 miR-143、 miR-181、 miR-30a-3p、 miR-223[4-7]。有报道显示,在EB 病毒阳性皮肌炎患者中发现miR-30a-3p 靶向调控ANXA1,从而促进外周血单个核细胞(peripheral blood mononuclear cells,PBMC)相关炎症因子的表达及皮肌炎炎症反应的发生[6]。系统性红斑狼疮患者PBMC 中miR-223 异常表达,介导机体炎症反应,参与疾病的发生、发展[7]。本研究前期通过靶基因生物信息学分析发现,在ITP 患者PBMC 中存在异常表达的miR-30a、miR-181a,考虑其可能作为ITP 发病的靶基因,但目前国内外尚无该类报道。因此本研究旨在明确miR-30a、miR-181a 在ITP 中的表达及其临床意义,初步明确其是否可作为ITP 的潜在治疗靶点,现报道如下。
1 资料与方法
1.1 一般资料
选取2020年1月—2020年12月昆明医科大学第一附属医院收治的ITP 患者48 例作为ITP 组,另取同期本院40 例化疗后骨髓抑制血小板减少患者作为对照组,体检健康者45 例作为健康组。本研究获得医院伦理会批准,所有患者家属知情并签署同意书。ITP 组男性23 例,女性25 例;中位年龄35 岁,平均(35.62±5.25)岁;PLT 0~55×109/L;平均血小板体积(mean platelet volume, MPV)3.5~7.9 fl,平均(5.62±1.33)fl;出血分级:0 级8 例,1 级10 例,2 级11 例,3 级13 例,4 级6 例。对照组男性19 例,女性21 例;中位年龄36 岁,平均(36.08±5.31)岁;PLT 70×109/L~120×109/L,平均(85.73±10.19)×109/L;MPV 5~10 fl,平 均(6.52±1.37)fl。健康组男性22 例,女性23 例;中位年龄37 岁,平均(36.15±5.37)岁;PLT 82×109/L~290×109/L,平均(178.96±22.33)×109/L;MPV 7~11 fl,平均(7.88±1.48)fl。3 组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入与排除标准
1.2.1 纳入标准 ①由专科医师根据诊疗共识确诊为ITP[8];②年龄≥18 岁;③肝肾功能正常,无其他自身免疫性疾病;④依从性较好;⑤无沟通障碍和神经系统疾病,能接受各项检查;⑥无溃疡病史或未长期使用免疫调节剂。
1.2.2 排除标准 ①胃肠手术史;②难治性或无法控制的高血压、糖尿病等原发性疾病;③合并恶性肿瘤;④合并大出血或内出血性疾病;⑤合并代谢性疾病;⑥各系统组织溃疡。
1.3 方法
采集受试者空腹静脉血检测MPV 和PLT。采集受试者空腹静脉血5 ml 置于枸橼酸抗凝管中,采用密度梯度离心法分离PBMC,总RNA 提取试剂盒(北京厚生博泰科技有限公司)提取细胞总RNA,消除RNA 中基因组DNA 并除去DNase1 后,采用逆转录试剂盒(德国Qiagen 公司)逆转录成cDNA,以此cDNA 为模板参照引物序列(上海生工生物工程股份有限公司)进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction, qRTPCR)扩增。qRT-PCR 扩增体系:SYBR Green Mix 10 μl,正向引物0.5 μl(10 μmol/L),反向引物0.5 μl(10 μmol/L),cDNA 模板1 μl,ddH2O 8 μl。qRTPCR 反应条件:95℃预变性3 min,95℃变性5 s,56℃退火10 s,72 ℃延伸25 s,共计39 次循环。qRTPCR 引物序列见表1。扩增产物经1.5%琼脂糖凝胶电泳,采用凝胶数字成像系统(美国Alpha Inotech 公司)扫描分析,测定各扩增带吸光度值,以目的基因与β-actin 吸光度比值计算miR-30a、miR-181a 相对表达量。

表1 qRT-PCR引物序列
1.4 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差(x±s)表示,比较用方差分析,两两比较用SNK-q检验;计数资料以构成比(%)表示,比较用χ2检验;相关性分析用Spearman 法;影响因素的分析用多因素一般Logistic 回归模型,将独立危险因素拟合多变量的临床模型;绘制ROC 曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 3 组患者miR-30a、miR-181a 相对表达量及PLT、MPV比较
3 组患者miR-30a、miR-181a 相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:ITP 组高于对照组和健康组(P<0.05)。3 组患者PLT、MPV 比较,经方差分析,差异有统计学意义(P<0.05)。进一步两两比较结果:ITP 组低于对照组和健康组(P<0.05)。见表2。
表2 3组患者miR-30a、miR-181a相对表达量及PLT、MPV比较 (±s)

表2 3组患者miR-30a、miR-181a相对表达量及PLT、MPV比较 (±s)
组别ITP组对照组健康组F 值P 值n 48 40 45 miR-30a 3.05±0.86 1.78±0.52 1.28±0.34 100.030 0.000 miR-181a 16.25±3.05 9.85±2.26 7.66±2.01 148.060 0.000 PLT/(×109/L)6.22±1.05 85.73±10.19 178.96±22.33 1731.018 0.000 MPV/fl 5.62±1.33 6.52±1.37 7.88±1.48 30.780 0.000
2.2 miR-30a、miR-181a与各临床指标的相关性
Spearman 相关性分析结果显示,miR-30a与年龄和性别无关(P>0.05),与PLT、MPV 呈负相关(P<0.05),与出血分级呈正相关(P<0.05)。miR-181a 与年龄和性别无关(P>0.05),与PLT、MPV 呈负相关(P<0.05),与出血分级呈正相关(P<0.05)。见表3。

表3 miR-30a、miR-181a与各临床指标的相关性
2.3 发生ITP的多因素Logistic回归分析
以是否发生ITP 为因变量(是=1,否=0),以年龄、性别、PLT、MPV、出血分级及miR-30a、miR-181a 相对表达量为自变量,进行Logistic 回归分析,结果显示:MPV [=0.685(95% CI:0.332,0.968)]、miR-30a [=1.876(95% CI:1.230,6.336)]和miR-181a [=2.665(95% CI:1.365,8.558)]是发生ITP 的影响因素(P<0.05)。见表4。
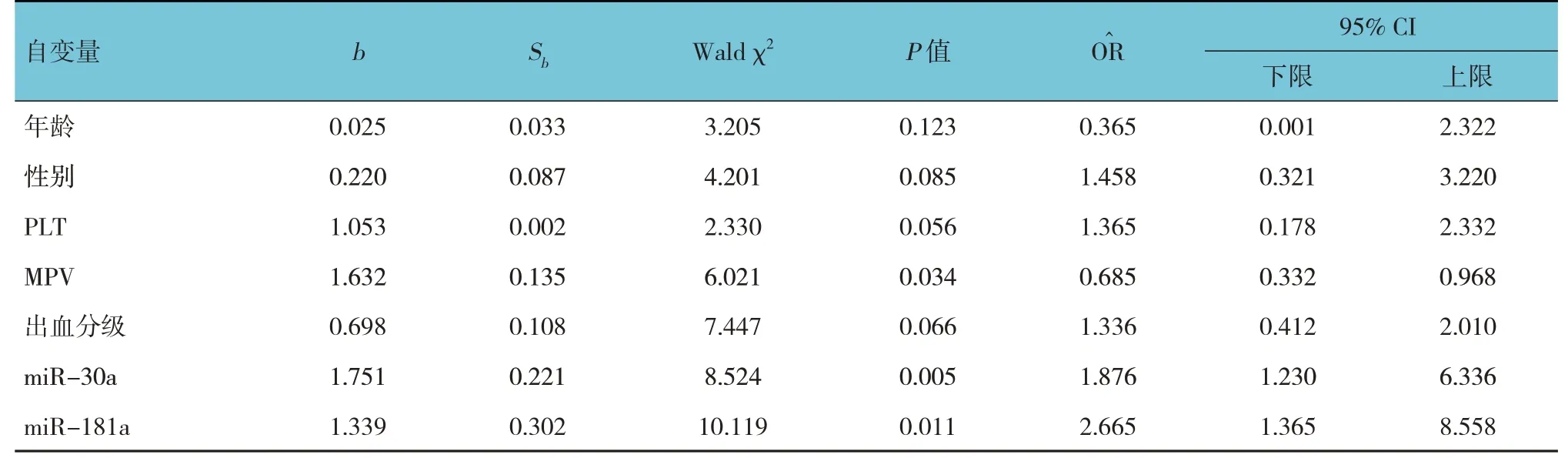
表4 发生ITP的多因素Logistic回归分析参数
2.4 临床模型建立与评估
选择多因素分析差异有统计学意义的指标(MPV、miR-30a相对表达量、miR-181a相对表达量)及其回归系数建立临床模型的多元回归方程:Logistic(P)=-4.115+1.305×MPV-1.258×miR-30a-1.664×miR-181a。在临床模型中,MPV 6.2~11.0 fl定义为0,MPV <6.2 fl 定义为1;miR-30a 相对表达量<2.85 定义为0,≥2.85 定义为1;miR-181a 相对表达量<8.44 定义为0,≥8.44 定义为1。临床模型诊断ITP 的标准误为0.055,AUC 为0.889(95%CI:0.662,0.956),敏感性为75.25%(95% CI:1.123,2.084)、特异性为88.24%(95% CI:1.672,2.583)(见图1)。选择48 例ITP 组患者中的11 例,基于临床模型下的散点图经过9 次迭代后达精度要求,利用制定好的临床模型对所有样本进行诊断测试;散点均围绕参考线波动,未显著偏离,诊断ITP的敏感性为90.00%(9/10),特异性为100.00%(1/1),总准确率为90.91%(10/11)。

图1 临床模型诊断ITP的ROC曲线
2.5 临床模型的临床效能评估
极端情况下,预测未发生ITP 临床净获益为0(红色斜线),预测发生ITP 临床净获益为0~3(蓝色斜线);正常情况下,DCA 决策曲线斜率高于2 条极端线。见图2。

图2 临床模型预测ITP的DCA决策曲线
3 讨论
近年来关于免疫功能、微炎症状态与ITP 密切相关的报道较多,已证实ITP 患者机体内内源性或外源性抗原可导致毛细血管及微静动脉变态反应而激发氧化应激反应[9]。既往研究发现,在自身免疫性疾病中存在500 多个miRNA,而健康者与ITP患儿及不同出血分级、类型的ITP 患儿间存在60 多个miRNA 差异性表达,提示miRNA 可能参与ITP 的发生、发展[10]。本研究中ITP 组PMBC 中miR-30a、miR-181a 相对表达量显著高于健康组,与吴晓芳等[11]报道miR-30a 通过介导Th17 细胞分化影响ITP发病的研究结果一致。本研究中miRNA 差异与既往报道有所区别,与不同物种、样本来源和疾病阶段、病情等有关[12-13]。王毅力等[12]报道,ITP 患者PMBC 中可检测到异常表达的miR-146a,其可鉴别诊断ITP 和急性髓系白血病。miRNA 由体内大多数细胞产生后分泌到外泌体中,进入循环细胞后被其他细胞摄取,在血液和各细胞组织间转运异常和/或机体表达抗炎miRNA 的能力受损时促进自身免疫性疾病的发病。有研究发现,MEK-ERK 通路激活后可诱导miR-30a、miR-181a 的表达,而其又可负向调节信号通路[14]。miR-30a 通过靶向位点结合SOCS3,影响Th17细胞分化,参与ITP发病[11]。
临床骨髓巨噬细胞增生活跃时,外周MPV 增大,由于ITP 患者血小板破坏过多,骨髓巨核细胞代偿性增生活跃,且血小板代谢旺盛,导致MPV迅速升高。有研究显示,MPV 在PLT 明显升高之前,已发生显著变化,提示MPV 在判断ITP 的发生、发展更敏感[15]。MPV 升高被认为是ITP 发生的危险因素,血小板功能直接决定骨髓巨核细胞功能特点,骨髓代偿功能异常可诱发ITP[16]。本研究中MPV 预测ITP 具有较高的准确性,与既往报道结果基本一致[13]。既往研究认为,miRNA 可调控血小板诱导的炎症因子合成及PBMC 增殖;同时,miRNA 通过促进/抑制转录因子的活性来影响T 细胞增殖,直接影响T 细胞活化诱导的细胞死亡过程[13]。本研究未分析相关炎症因子,但通过检测miR-30a、miR-181a 相对表达量发现,其在ITP 患者中变化较为敏感,与MPV、PLT 呈负相关,与出血分级呈正相关,提示其参与ITP 的发生机制。miR-30a 介导炎症反应和免疫机制[17],由相对表达量在一定程度反映了机体免疫功能,miR-30a 表达升高,提示机体免疫功能差,血小板代谢旺盛引起自身免疫性疾病。ITP 发生后,大量炎症因子释放,加剧了氧化应激和免疫功能受损,导致受体相关激酶变化,引起miR-181a 改变,加剧血小板损伤。本研究结合多项临床资料,进行单因素和多因素分析,建立的MPV、miR-30a、miR-181a 临床模型区分度评估中,AUC 为0.889,提示准确度高,略高于MAXIMILIAN 等[18]的报道结果,与选择的预测因子不同有关。校准度评估中,散点图示散点均围绕参考线波动,未显著偏离参考线;说明该临床模型具有较好的区分度和校准度,对预测ITP 的发生概率具有较高的敏感性和准确性。DCA 决策曲线分析说明本预测模型具有较好的临床应用价值,使用该模型的患者能从中获益。
综上所述,miR-30a、miR-181a 与ITP 发生相关,通过miR-30a、miR-181a 建立个体化预测模型可准确判断ITP 的发生,且具有较高的临床实用价值。
