基于Nrf2/D1R-ERK信号通路探讨甘松对左旋多巴诱导的异动症大鼠的作用机制
2022-01-13李佳园魏晓嘉万国慧于佳禾刘金凤金重先王雨青石晋丽
李佳园,魏晓嘉,万国慧,杨 雪,于佳禾,刘金凤,金重先,王雨青,吕 研,石晋丽
基于Nrf2/D1R-ERK信号通路探讨甘松对左旋多巴诱导的异动症大鼠的作用机制
李佳园,魏晓嘉,万国慧,杨 雪,于佳禾,刘金凤,金重先,王雨青,吕 研,石晋丽*
北京中医药大学中药学院,北京 102488
基于Nrf2/D1R-ERK信号通路探讨甘松对左旋多巴(levodopa,-DOPA)诱导的异动症(levodopa-induced dyskinesia,LID)模型大鼠的作用机制。将SD大鼠随机分为假手术组、帕金森(Parkinson’s disease,PD)组、-DOPA组和甘松+-DOPA组。PD组、-DOPA组和甘松+-DOPA组颈背部sc鱼藤酮葵花籽油(1.5 mg/kg)14 d制备PD模型,假手术组sc等体积葵花籽油,之后进行14 d的药物干预:DOPA组ig-DOPA(100 mg/kg)和苄丝肼(25 mg/kg),甘松+-DOPA组ig甘松(1240 mg/kg)、-DOPA(100 mg/kg)和苄丝肼(25 mg/kg),假手术组和PD组ig等体积0.9%氯化钠溶液。通过前肢功能检测实验评估-DOPA对PD大鼠运动能力的影响;通过异常不自主运动(abnormal involuntary movement,AIM)评分评估-DOPA导致LID大鼠的AIM程度;采用免疫组化法考察大鼠黑质中酪氨酸羟化酶(tyrosine hydroxylase,TH)的表达;Western blotting法检测大鼠纹状体内转录因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)、多巴胺D1受体(dopamine D1 receptor,D1R)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、磷酸化ERK((phosphorylated ERK,p-ERK)和∆FosB蛋白的表达;ELISA法检测大鼠脑纹状体中活性氧自由基(reactive oxygen species,ROS)、血红素加氧酶-1(heme oxygenase-1,HO-1)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、多巴胺和cAMP调节的磷蛋白-32(dopamine and adenosine 3′,5′-monophosphate-regulated phospho-protein,DARPP-32)和p-DARPP-32的含量。前肢功能检测结果显示,-DOPA单用和甘松与-DOPA联用均能显著增加PD大鼠的前肢跨步次数(<0.001)。AIM评分结果显示,与-DOPA单用相比,甘松与L-DOPA联用可显著降低LID大鼠的AIM症状(<0.01)。免疫组化结果显示,PD组和-DOPA组的TH表达没有显著性差异,而甘松与-DOPA联用可明显增强PD大鼠的TH表达(<0.05),同时显著增强-DOPA单用导致的LID大鼠的TH表达(<0.01)。Nrf2信号通路结果显示,PD组和-DOPA组没有显著性差异,而甘松与-DOPA联用可明显降低PD大鼠的ROS含量(<0.05),显著促进Nrf2表达(<0.01),并显著提高HO-1、SOD、GSH-Px的含量(<0.001);同时还能显著降低LID大鼠的ROS含量(<0.001),明显提高Nrf2、HO-1、SOD的含量(<0.05),并显著提高GSH-Px含量(<0.01)。D1R-ERK信号通路结果显示,甘松与-DOPA联用能显著降低LID大鼠的D1R表达(<0.001),同时明显减低∆FosB、p-DARPP-32/DARPP-32、p-ERK/ERK的表达(<0.05)。-DOPA可以改善PD大鼠的运动障碍,但不能降低TH的损伤,而且还会引起氧化应激反应和D1R-ERK通路的过表达。甘松联合-DOPA给药可明显改善PD大鼠的运动损伤,抑制-DOPA引起的AIM现象,同时提高TH的表达。其机制可能是甘松通过激活Nrf2通路相关蛋白的表达,并抑制D1R-ERK通路相关蛋白的过表达发挥抗LID作用。
甘松;帕金森;左旋多巴诱导的异动症;Nrf2信号通路;D1R-ERK信号通路
帕金森病(Parkinson’s disease,PD)是继阿尔茨海默症之后的第二大中枢神经系统退行性疾病[1]。临床表现为静止性震颤、姿势步态异常、肌肉僵直等[2],病理特征主要为中脑黑质致密部多巴胺能神经元的变性缺失[3]。目前PD的治疗主要通过补充外源性多巴胺来缓解症状[4]。左旋多巴(levodopa,-DOPA)作为多巴胺的前体,是目前治疗PD的首选药物,能有效缓解PD的运动障碍,临床常与苄丝肼联用增加中枢神经系统对其利用程度[5]。但-DOPA长期应用会出现一些局限性,如加速PD进展过程中多巴胺能神经元的死亡[6]、引起并发症等。
异动症(levodopa-induced dyskinesia,LID)是长期服用-DOPA后最常见的一种不良反应[7],临床表现主要为肢体、躯干和面部的非自主、无目的、不规则运动,是PD患者晚期致残的主要原因[8]。研究表明,在接受-DOPA治疗15年以上的PD患者中,LID的累积发生率可高达95%[8],严重影响了患者的生命质量。目前,LID的发病机制尚未明确,但研究发现主要与-DOPA在体内代谢过程中引起的氧化应激反应和-DOPA长期反复摄取导致基底神经环路中多巴胺D1受体(dopamine D1 receptor,D1R)的过度激活有关[9]。研究表明,-DOPA进入机体后,在代谢期间会产生大量的活性氧自由基(reactive oxygen species,ROS)形成氧化应激反应,破坏多巴胺能神经元。此时,转录因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)作为机体自身的抗氧化通路[10-11],可通过抑制氧化应激反应,减少多巴胺能神经元的损伤,缓解PD[12]和LID[13]。此外,当D1R激活后,会促进细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号的磷酸化,而ERK信号通路持续过度活化被认为是诱导和维持LID发生的主要原因[14]。因此,基于Nrf2和D1R-ERK通路探讨药物对LID的作用具有重要意义。
甘松为败酱科植物甘松DC.的干燥根及根茎,有理气止痛、开郁醒脾之功[15],具有神经保护[16]、抗神经退行性疾病[17]、镇静[18]等药理作用。本课题组前期研究发现,甘松提取物不同萃取部位均可增强6-羟基多巴胺损伤细胞的存活率,对人神经母细胞瘤SH-SY5Y细胞损伤有明显的保护作用[19]。甘松80%乙醇提取物对PD模型大鼠具有良好的治疗效果,优于甘松95%乙醇提取物和甘松水提取物,且甘松(生药1240 mg/kg)联合少量的-DOPA对PD的治疗具有增效作用。此外,甘松还可提高多巴胺能神经元含量,抑制炎性反应,缓解PD伴发焦虑[20]。以上研究表明,甘松在治疗PD方面具有潜在的开发价值,但甘松对PD后期出现的LID是否也具有保护作用却鲜有研究。本研究在PD模型的基础上给予-DOPA的慢性刺激制备LID模型大鼠,考察甘松对LID模型大鼠Nrf2和D1R-ERK信号通路的调控作用,以期为甘松治疗LID的临床应用提供依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,体质量200~220 g,8周龄,购自北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0006。大鼠饲养于北京中医药大学SPF级动物实验中心,湿度40%~60%,温度20~22 ℃,12 h光暗周期(7: 00~19: 00光照),自由进食饮水。动物实验方案符合国家实验动物福利伦理的相关要求,均符合3R原则。
1.2 药材
甘松购自四川阿坝若尔盖县,经北京中医药大学石晋丽教授鉴定为败酱科植物甘松DC.的干燥根及根茎。将药材用高速万能粉碎机粉碎成粗粉,称取100 g置于1 L烧杯中,封口膜封口,依次用10、8、8倍量80%乙醇超声提取3次,温度控制在35 ℃以下,时间分别为60、45、45 min,静置,滤过,合并滤液,减压回收溶剂,得棕色浸膏,将浸膏真空冷冻干燥,得到干燥的甘松80%乙醇提取物。HPLC测得含甘松新酮为0.56%,符合《中国药典》2020年版规定。
1.3 药品与试剂
鱼藤酮(批号R105076)购自上海阿拉丁生化科技有限公司;葵花籽油(批号W24A11L122237)购自上海源叶生物科技有限公司;乌拉坦(批号C10821103)购自上海麦克林生化科技有限公司;-DOPA购自北京曙光药业有限责任公司;多巴胺和cAMP调节的磷蛋白-32(dopamine and adenosine 3′,5′-monophosphate-regulated phospho-protein,DARPP-32)ELISA试剂盒、磷酸化DARPP-32(phosphorylated DARPP-32,p-DARPP-32)ELISA试剂盒、血红素加氧酶-1(heme oxygenase-1,HO-1)ELISA试剂盒(批号20210706CM2)、ROS ELISA试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)ELISA试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)ELISA试剂盒(批号20210617K)购自江苏酶免生物科技有限公司;D1R抗体(批号A2893)购自武汉爱博泰克生物科技有限公司;ERK抗体(批号GB11560)、p-ERK抗体(批号GB11004)购自武汉赛维尔生物科技有限公司;Nrf2抗体(批号12721S)购自美国CST公司;∆FosB抗体(批号ab227387)、β-actin抗体(批号AB227387)购自英国Abcam公司;HRP标记的山羊抗小鼠二抗(批号074-1506)、HRP标记的山羊抗兔二抗(批号074-1806)购自KPL公司。
1.4 仪器
FW200型高速万能粉碎机(北京科伟永兴仪器有限公司);RE3000A型旋转蒸发仪(上海亚荣生化仪器厂);冷冻干燥机(北京博医康实验仪器有限公司);KW-1000DC型数显恒温水浴锅(金坛市杰瑞电器有限公司);KH5200DE数控超声波清洗器型(昆山合创超声仪器有限公司);RT-6100型多功能酶标仪(深圳雷杜生命科学股份有限公司)。
2 方法
2.1 PD和LID模型的制备、分组及给药
SD大鼠适应性喂养7 d后,随机分为假手术组、PD组、-DOPA组和甘松+-DOPA组。PD组、-DOPA组、甘松+-DOPA组大鼠颈背部sc鱼藤酮葵花籽油(1.5 mg/kg)14 d制备PD模型,假手术组sc等体积葵花籽油。当大鼠出现毛色发黄、精神萎靡不振、弓背和四肢力量减弱等症状时,表明造模成功[21],共得到36只PD模型大鼠,造模成功率为90%。之后在PD模型大鼠的基础上给予-DOPA和苄丝肼的慢性刺激制备LID模型[22],同时进行14 d的药物干预:-DOPA组ig-DOPA(100 mg/kg)和苄丝肼(25 mg/kg);甘松+-DOPA组ig甘松(1240 mg/kg),30 min后ig-DOPA(100 mg/kg)和苄丝肼(25 mg/kg);假手术组和PD组ig等体积0.9%氯化钠溶液(5 mL/kg)。
2.2 前肢功能检测实验
前肢功能检测实验能较好地模拟PD患者的运动障碍[23],可以用来确定-DOPA对PD大鼠的运动障碍是否具有改善作用,以及甘松与-DOPA联用是否影响-DOPA的疗效。实验时一只手固定大鼠后半部躯体和双后肢,另一只手托起一条前肢,使大鼠将其重心放置在着地的前肢上。在桌子上沿着大鼠负重肢体方向以18 cm/s的速度匀速移动,记录移动时大鼠负重前肢的跨步数。重复3次,每次间隔30 min,取平均值作为大鼠前肢跨步数。
2.3 各组大鼠异常不自主运动(abnormal involuntary movement,AIM)评分
为了评价-DOPA导致的LID大鼠的运动障碍程度,在文献报道[24]的基础上进行了AIM评分。在给予-DOPA后,每20分钟评价1次,观察周期为1 min,共观察3次,取平均值。总AIM得分对应3种AIM亚型(轴向、肢体和口舌)的得分之和。每种亚型的严重程度为0~4级(0级:没有出现异动;1级:偶然出现异动;2级:频繁出现异动;3级:连续出现异动;4级:连续出现异动,且无法被抑制)。
2.4 免疫组化检测各组大鼠黑质中酪氨酸羟化酶(tyrosine hydroxylase,TH)的表达
大鼠ip 20%乌拉坦麻醉,充分暴露大鼠胸腔,将灌注针插入心脏左心室,同时剪开右心耳。每只大鼠先灌注300 mL PBS缓冲溶液,待大鼠心脏中流出的液体为无色澄清时,灌注100 mL多聚甲醛进行固定。固定完成后在冰上迅速剥离出完整的大脑,浸泡于10倍量的多聚甲醛溶液中,静置24 h。然后进行石蜡包埋,冠状面切片,梯度酒精脱水,染色,拍照,并将图片导入至Image J软件中,对阳性细胞的吸光度()值及区域总面积的比值进行分析,得到TH的平均值,以确定其表达情况。
2.5 Western blotting法检测各组大鼠纹状体中Nrf2、D1R、p-ERK/ERK、∆FosB的蛋白表达
大鼠ip 20%乌拉坦麻醉,迅速在冰上取出纹状体,组织块用预冷的PBS缓冲液漂洗2~3次,加入10倍量的组织蛋白提取试剂,剪成小块置于匀浆器中匀浆。将匀浆液转移至离心管中,振荡。冰浴30 min,期间用移液器反复吹打,确保匀浆液完全裂解,4 ℃、13 000×离心5 min,收集上清液。使用BCA蛋白定量试剂盒测定蛋白质量浓度,加入5×蛋白上样缓冲液,95~100 ℃沸水浴5 min。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入封闭液室温封闭1 h;分别加入Nrf2、D1R、p-ERK/ERK、∆FosB、β-actin抗体(1∶1000),4 ℃孵育过夜;用TBST洗3次,每次5 min,加入HRP标记的兔抗山羊IgG抗体(1∶5000),室温孵育2 h,TBST洗4次,每次5 min。采用ECL化学发光法显影,使用Image J分析蛋白条带灰度值。
2.6 ELISA法检测各组大鼠纹状体中HO-1、SOD、GSH-Px活性及ROS、p-DARPP-32/DARPP-32含量
取低温保存的纹状体匀浆上清液,按ELISA试剂盒说明书检测HO-1、SOD、GSH-Px活性及ROS、p-DARPP-32/DARPP-32含量。
罗译:The real fact is that one might have learned the doctrine earlier than the other,or might be a master in his own special field.[6]65
2.7 统计学分析
采用GraphPad Prism 6.0软件对实验数据进行分析,利用单因素方差进行多组间比较,Tukey检验进行两组间比较。符合正态分布的各组数据采用表示。
3 结果
3.1 前肢功能检测实验
采用前肢功能检测实验评价-DOPA对PD大鼠运动障碍的影响及甘松与-DOPA联用是否影响-DOPA的疗效,如表1所示,与假手术组相比,PD组大鼠前肢运动次数显著减少(<0.001);与PD组相比,-DOPA组和甘松+-DOPA组大鼠的前肢运动次数显著增多(<0.001),且-DOPA组与甘松+-DOPA组之间没有显著性差异。表明-DOPA能明显改善PD大鼠的运动障碍,且甘松与-DOPA联用对-DOPA治疗PD的药效未产生影响。
表1 各组大鼠前肢跨步次数(, n = 12)
Table 1 Forelimb stride times of rats in each group(, n = 12)
组别前肢跨步次数 假手术11.83±0.49 PD6.25±0.33*** L-DOPA10.25±0.33△△△ 甘松+L-DOPA11.33±0.51△△△
与假手术组比较:***<0.001;与PD组比较:△<0.05△△<0.01△△△<0.001;与-DOPA组比较:#<0.05##<0.01###<0.001,下表同
***<0.001sham group;△<0.05△△<0.01△△△<0.001PD group;#<0.05##<0.01###<0.001-DOPA group, same as below tables
3.2 各组大鼠AIM评分
采用AIM评分评价-DOPA导致的LID大鼠的运动障碍程度。如表2所示,假手术组和PD组大鼠均未表现出明显的AIM现象。-DOPA组和甘松+-DOPA组具有不同程度的AIM现象。与-DOPA组相比,甘松+-DOPA组的AIM评分显著降低(<0.01)。表明与-DOPA单用相比,甘松与- DOPA联用能显著降低LID大鼠的AIM现象。
表2 各组大鼠AIM评分(, n = 12)
Table 2 AIM score of rats in each group(, n = 12)
组别AIM评分 L-DOPA28.75±2.25 甘松+L-DOPA19.50±2.31##
3.3 甘松对各组大鼠黑质TH表达的影响
如图1所示,与假手术组相比,PD组TH表达显著降低(<0.01);与PD组相比,-DOPA组没有显著性差异,但甘松+-DOPA组TH表达明显升高(<0.05);与-DOPA组相比,甘松+-DOPA组TH表达显著升高(<0.01)。表明在PD模型大鼠形成过程中,TH表达下降且胞体显著缩小,多巴胺能神经元被损坏;给予-DOPA后,TH表达没有明显提高,多巴胺能神经元的损伤程度没有被逆转;而甘松+-DOPA联用可有效扭转这一趋势,提高TH表达,达到保护多巴胺能神经元的作用。
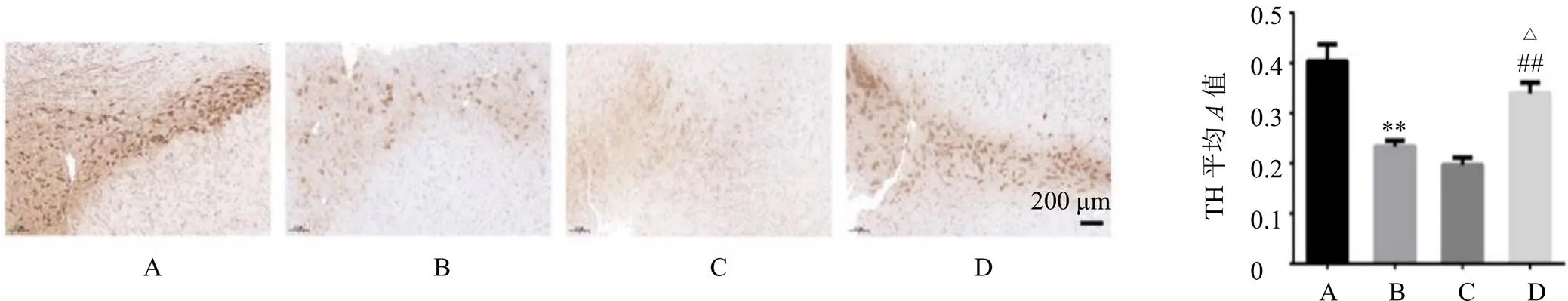
A-假手术组 B-PD组 C-L-DOPA组 D-甘松+L-DOPA组 与假手术组比较:**P<0.01;与PD组比较:△P<0.05 △△P<0.01 △△△P<0.001;与L-DOPA组比较:#P<0.05 ##P<0.01 ###P<0.001,下图同
3.4 甘松对大鼠纹状体Nrf2通路的影响
3.4.1 甘松对大鼠纹状体ROS含量的影响 如表3所示,与假手术组相比,PD组大鼠纹状体中ROS水平显著升高(<0.001);与PD组相比,-DOPA组有升高的趋势,但甘松+-DOPA组大鼠纹状体ROS含量明显降低(<0.05);与-DOPA组相比,甘松+-DOPA组大鼠纹状体ROS含量显著降低(<0.001)。表明在PD模型大鼠中,ROS因无法及时清除发生了氧化应激反应,而服用-DOPA后,没有减轻ROS含量,又因-DOPA在体内代谢产生ROS,加重了氧化应激反应。甘松与-DOPA联用可有效抑制ROS的产生,减轻氧化应激反应。
3.4.2 甘松对大鼠纹状体Nrf2蛋白表达的影响 如图2所示,与对照组相比,PD组大鼠纹状体中Nrf2蛋白表达有升高的趋势;与PD组相比,-DOPA组没有显著差异,但甘松+-DOPA组大鼠纹状体的Nrf2蛋白表达水平显著升高(<0.01);与-DOPA组相比,甘松+-DOPA组大鼠纹状体的Nrf2蛋白表达水平明显升高(<0.05)。表明在正常机体中,抗氧化因子Nrf2处于静息状态,表达不明显;在PD模型大鼠中,机体会自发启动保护机制使抗氧化因子Nrf2由静息状态变为活跃,并促进Nrf2的表达来抑制过量的ROS;药物干预后,与-DOPA单用比较,甘松与-DOPA联用后,Nrf2表达显著提高,表明甘松可通过提高Nrf2表达,降低体内ROS的含量,从而抑制氧化应激反应。
表3 各组大鼠纹状体ROS含量(, n = 8)
Table 3 ROS content in striatum of rats in each group (, n = 8)
组别ROS/(ng·mg−1) 假手术45.42±7.88 PD125.60±14.34*** L-DOPA146.00±9.73 甘松+L-DOPA79.60±4.11△###
3.4.3 甘松对大鼠纹状体HO-1、SOD、GSH-Px活性的影响 如表4所示,与假手术组相比,PD组大鼠纹状体HO-1、SOD和GSH-Px活性均有升高的趋势;与PD组相比,-DOPA组没有显著性差异,但甘松+-DOPA组大鼠纹状体中HO-1、SOD、GSH-Px活性显著升高(<0.001);与-DOPA组相比,甘松+-DOPA组大鼠纹状体HO-1、SOD活性明显升高(<0.05),GSH-Px活性显著升高(<0.01)。表明在正常机体中,氧化还原稳态平衡,HO-1、SOD、GSH-Px均处于静息状态,表达不明显;在PD大鼠中,机体ROS异常增多导致HO-1、SOD、GSH-Px抗氧化因子被自发激活;药物干预后,与-DOPA单用比较,甘松与-DOPA联用可显著提高HO-1、SOD、GSH-Px的表达,对抑制过量ROS的产生具有积极作用。
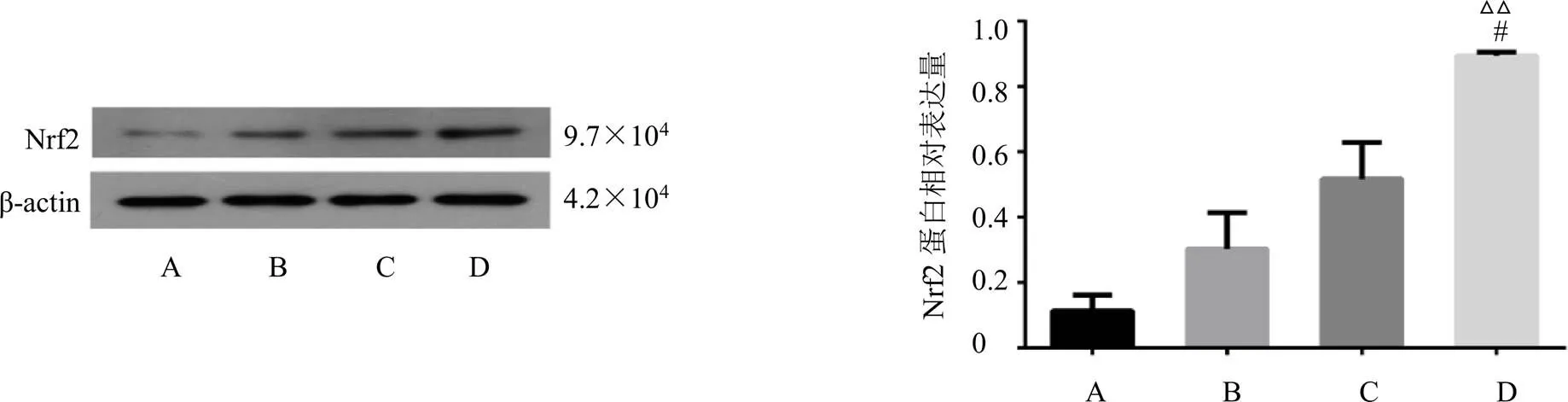
图2 各组大鼠纹状体Nrf2蛋白表达情况(, n = 3)
表4 各组大鼠纹状体HO-1、SOD和GSH-Px活性()
Table 4 HO-1, SOD and GSH-Px activities in striatum of rats in each group ()
组别HO-1/(ng·mg−1)(n = 6)SOD/(ng·mg−1)(n = 8)GSH-Px/(ng·mg−1)(n = 8) 假手术1.54±0.071.52±0.182.81±0.24 PD1.97±0.141.84±0.103.78±0.35 L-DOPA2.36±0.082.27±0.214.26±0.32 甘松+L-DOPA2.98±0.21△△△#3.12±0.20△△△#5.94±0.34△△△##
3.5 甘松对大鼠D1R-ERK通路的影响
3.5.1 甘松对大鼠纹状体D1R、p-ERK/ERK、∆FosB蛋白表达的影响 如图3所示,与PD组相比,-DOPA组大鼠纹状体D1R、p-ERK/ERK、∆FosB蛋白表达水平显著升高(<0.001、0.01);与-DOPA组相比,甘松+-DOPA组大鼠纹状体D1R、p-ERK/ERK、∆FosB蛋白表达水平明显降低(<0.05、0.001)。表明PD模型大鼠大量服用-DOPA会激活D1R-ERK通路上的相关蛋白,而甘松与-DOPA联用对D1R-ERK通路的过度激活具有抑制作用。
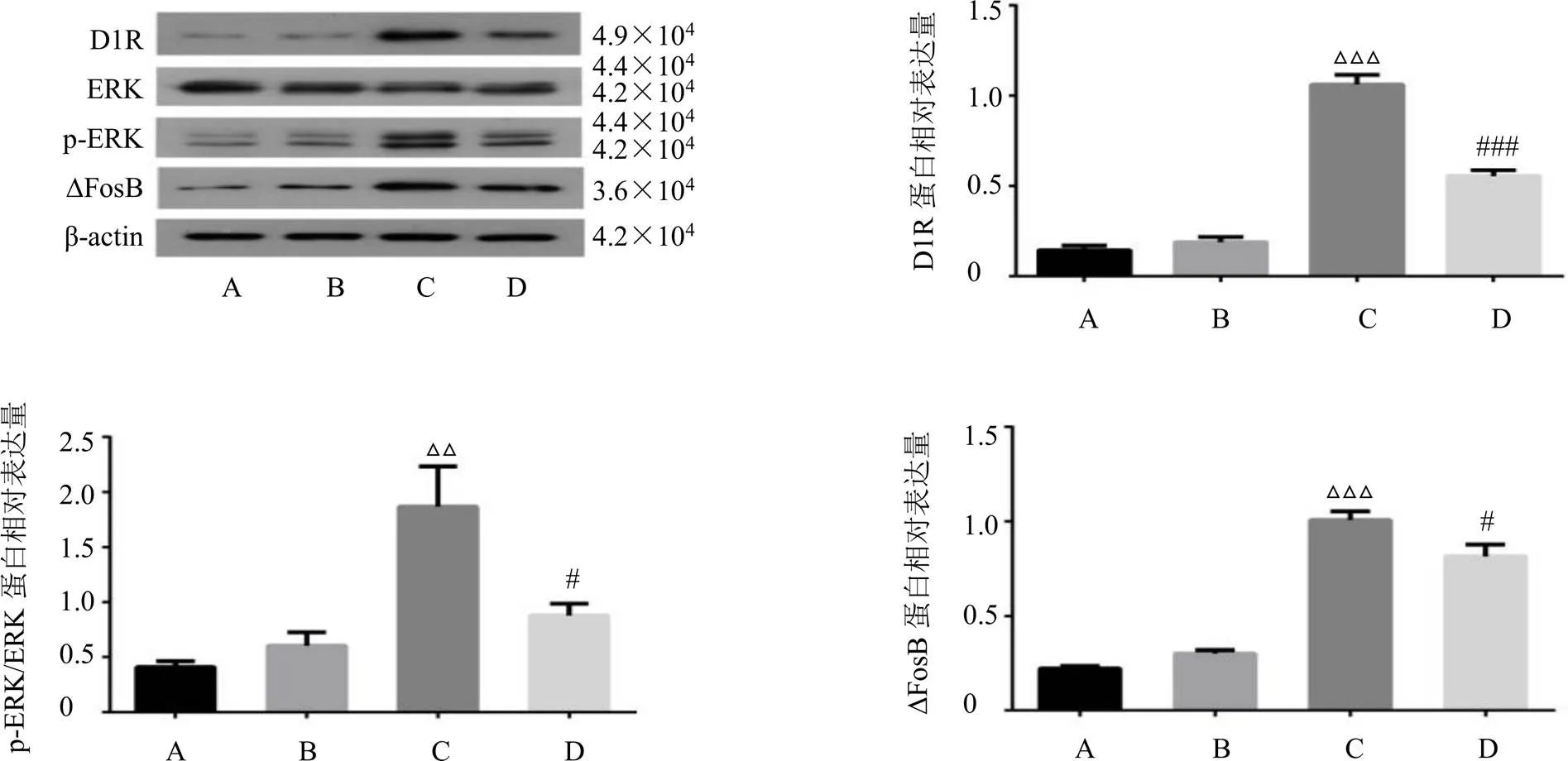
图3 各组大鼠纹状体D1R、p-ERK/ERK和∆FosB蛋白表达(, n = 3)
3.5.2 甘松对大鼠纹状体p-DARPP-32/DARPP-32蛋白表达的影响 如表5所示,与PD组相比,-DOPA组大鼠纹状体p-DARPP-32/DARPP-32蛋白表达水平显著升高(<0.01)。与-DOPA组相比,甘松+-DOPA组大鼠纹状体D1R蛋白表达水平明显降低(<0.05)。表明PD模型大鼠大量服用-DOPA会导致p-DARPP-32/DARPP-32蛋白激活,甘松与-DOPA联用可以抑制该蛋白的过度激活。
表5 各组大鼠纹状体p-DARPP-32/DARPP-32蛋白表达(, n = 8)
Table 5 p-DARPP-32/DARPP-32 protein expression in striatum of rats in each group (, n = 8)
组别p-DARPP-32/DARPP-32/(ng·mg−1) 假手术0.27±0.02 PD0.34±0.03 L-DOPA0.61±0.09△△ 甘松+L-DOPA0.39±0.05#
4 讨论
目前PD模型制备常用的神经毒素有鱼藤酮[25]、6-OHDA[26]和MPTP[27],其中鱼藤酮所致的PD模型在行为学改变和病理学特征上与临床PD患者更为接近,且容易穿透血脑屏障、造模成功率高、价廉易得[28],此外,鱼藤酮可以直接作用于多巴胺能神经元,诱导线粒体功能障碍和增加ROS产生,导致多巴胺能神经元的变性[29]。因此本研究采用sc鱼藤酮制备PD模型,并在此基础上给予大量的-DOPA制备LID模型大鼠[30-31]。
本研究发现,PD模型大鼠的前肢跨步次数显著降低,ROS含量增多,TH表达下降,多巴胺能神经元被严重破坏。给予-DOPA治疗后,前肢跨步次数有所增加,但没有缓解ROS增多的现象,且因-DOPA在体内代谢时也会产生ROS,使得氧化应激反应进一步加重;此外,-DOPA还激活了D1R-ERK通路,此时机体表现为运动增加,出现AIM[32-33]。与-DOPA单用相比,甘松与-DOPA联用可以激活Nrf2通路抑制氧化应激反应,同时甘松与-DOPA联用还能抑制D1R-ERK通路相关蛋白,最终起到治疗LID的作用。具体机制分析见图4。
首先,外源性-DOPA进入机体后,在氨基酸脱羧酶(aromatic amino acid decarboxylase,AADC)的代谢下成为多巴胺,多巴胺进一步代谢为3,4-二羟基苯乙酸(3,4-dihydroxyphenylacetic acid,DOPAC)和高香草酸(homovanillicacid,HVA),反应的副产物包括ROS、H2O2等,此时机体由于氧化还原稳态失衡,ROS不能被及时清除,机体会发生氧化应激反应加剧疾病进程[34]。Nrf2是机体抗氧化防御机制中关键的内源性调节因子,可调节多种抗氧化酶的活性,对于降低PD患者体内ROS的含量、减轻多巴胺能神经元变性至关重要[13]。当机体受到ROS的刺激时,Nrf2和Keap1解离,迁移进入细胞核内,结合细胞内抗氧化反应元件(antioxidant response element,ARE),启动下游多种抗氧化酶(如HO-1、SOD、GSH-Px等)的表达[35-36],它们能保护机体免受氧化物质造成的损害,减少外源性刺激引起的多种疾病。
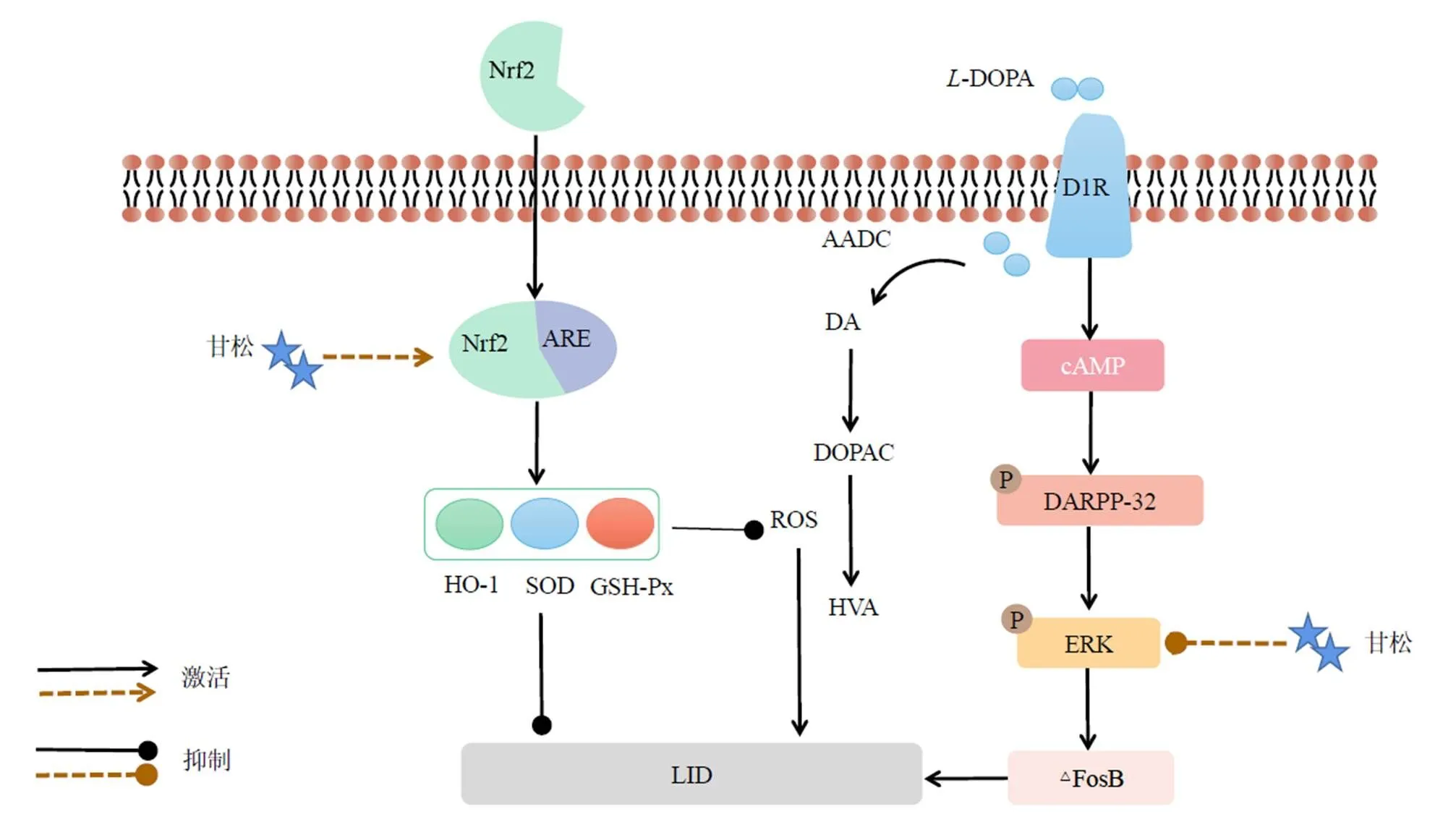
图4 甘松治疗LID的具体机制
其次,长期服用外源性-DOPA,会导致D1R激活,当D1R被激活后,会引起其下游cAMP信号级联的持续和间歇性高表达,进而导致cAMP依赖的蛋白激酶A(protein kinases A,PKA)和DARPP-32的活性增加,使DARPP-32磷酸化[37]。DARPP-32作为D1R下游信号通路上重要的整合分子,当其磷酸化后会通过抑制蛋白磷酸酶-1(protein phosphatase-1,PP-1)从而促进ERK的磷酸化[15]。研究表明,D1R下游ERK信号通路持续过度活化是诱导和维持LID发生的主要机制,在许多动物模型中干扰介导ERK激活的细胞内因子可以改善LID症状[38-39]。此外,ERK过度激活,会促使其下游∆FosB蛋白的生成,在棘状神经元中∆FosB的蓄积被认为是LID发生的标志分子,且蓄积的程度与LID行为学评分呈正相关,选择性阻止∆FosB的蓄积则会显著减轻LID[40]。如Ukgansan可通过降低纹状体中D1R相关信号蛋白(如p-ERK、∆FosB、c-fos等)的过表达改善大鼠运动功能障碍,恢复多巴胺能神经元,减缓LID的进程[41]。
本课题组前期研究发现,甘松乙醇提取物对体内、体外PD模型均有良好的抑制作用。本研究通过Nrf2和D1R-ERK 2条信号通路证明了甘松对LID具有良好的治疗作用。此外,有学者分别利用体内、体外模型研究甘松对阿尔茨海默症的作用,结果表明甘松能够减轻Aβ诱导的脑内细胞死亡,同时能够降低小胶质细胞数量、ROS水平及ERK的磷酸化,证明甘松的神经保护作用可能与抗氧化、抗炎及抑制ERK信号通路的激活作用有关[42],与本研究结果可以互为佐证。
综上所述,甘松通过增强PD大鼠的TH表达和激活Nrf2信号通路,对-DOPA缓解PD大鼠的运动障碍起到了促进作用。同时,甘松通过抑制D1R-ERK信号通路,改善了慢性-DOPA引起的AIM症状。本研究为甘松联合-DOPA治疗LID的临床应用提供了依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Xu W, Zheng D Y, Liu Y Y,. Glaucocalyxin B alleviates lipopolysaccharide-induced Parkinson’s disease by inhibiting TLR/NF-κB and activating Nrf2/HO-1 pathway [J]., 2017, 44(6): 2091-2104.
[2] 许薇. 蓝萼乙素对脂多糖诱导的帕金森病模型的神经保护作用及机制研究 [D]. 沈阳: 中国医科大学, 2018.
[3] Kline E M, Houser M C, Herrick M K,. Genetic and environmental factors in Parkinson’s disease converge on immune function and inflammation [J]., 2021, 36(1): 25-36.
[4] Schapira A H, Olanow C W, Greenamyre J T,. Slowing of neurodegeneration in Parkinson’s disease and Huntington’s disease: Future therapeutic perspectives [J]., 2014, 384(9942): 545-555.
[5] Zibetti M, Merola A, Artusi C A,. Levodopa/carbidopa intestinal gel infusion in advanced Parkinson’s disease: A 7-year experience [J]., 2014, 21(2): 312-318.
[6] Fahn S, Oakes D, Shoulson I,. Levodopa and the progression of Parkinson’s disease [J]., 2004, 351(24): 2498-2508.
[7] Ahlskog J E, Muenter M D. Frequency of levodopa-related dyskinesias and motor fluctuations as estimated from the cumulative literature [J]., 2001, 16(3): 448-458.
[8] 吕思源. 依托拉嗪改善左旋多巴诱导帕金森病小鼠模型异动症的突触可塑性机制 [D]. 广州: 南方医科大学, 2019.
[9] 吴娜. D1R/Shp-2复合物在异动症大鼠D1R/Shp-2/ERK1/2通路中的作用 [D]. 上海: 上海交通大学, 2019.
[10] Tonelli C, Chio I I C, Tuveson D A. Transcriptional regulation by Nrf2 [J]., 2018, 29(17): 1727-1745.
[11] Hu R, Saw C L, Yu R,. Regulation of NF-E2-related factor 2 signaling for cancer chemoprevention: Antioxidant coupled with antiinflammatory [J]., 2010, 13(11): 1679-1698.
[12] 宋威彻. 黄芪甲苷治疗帕金森病的药效学评价及作用机制研究 [D]. 广州: 广州中医药大学, 2018.
[13] Wei P C, Lee-Chen G J, Chen C M,. Neuroprotection of indole-derivative compound NC001-8 by the regulation of the NRF2pathway in Parkinson’s disease cell models [J]., 2019, 2019: 5074367.
[14] Pahwa R, Lyons K E, Hauser R A,. Randomized trial of IPX066, carbidopa/levodopa extended release, in early Parkinson’s disease [J]., 2014, 20(2): 142-148.
[15] 中国药典 [S]. 一部. 2020: 87-88.
[16] Yoon C S, Kim K W, Lee S C,. Anti-neuroinflammatory effects of sesquiterpenoids isolated from[J]., 2018, 28(2): 140-144.
[17] Ahmad M, Yousuf S, Khan M B,. Attenuation byof 6-hydroxydopamine-induced Parkinsonism in rats: Behavioral, neurochemical, and immunohistochemical studies [J]., 2006, 83(1): 150-160.
[18] 张盼, 程光宇, 程为平. 浅谈甘松的临床应用 [J]. 中医药学报, 2015, 43(2): 99-100.
[19] 王胜男. 甘松对6-OHDA诱导的SH-SY5Y细胞损伤的保护作用及机制研究 [D]. 北京: 北京中医药大学, 2018.
[20] 李佳园, 徐文, 万国慧, 等. 基于网络药理学及实验验证探究甘松治疗帕金森病伴发焦虑的作用机制[J]. 中草药, 2021, 52(23): 7192-7203.
[21] 李亚楠, 马骏, 余沛豪, 等. 鱼藤酮帕金森病模型的建立与评价 [J]. 中华中医药学刊, 2020, 38(3): 175-179.
[22] 梁建庆, 何建成. 复方地黄颗粒对阴虚动风证帕金森病异动症模型大鼠神经行为学的影响 [J]. 解放军医学杂志, 2018, 43(8): 652-656.
[23] Olsen I, Singhrao S K. Inflammasome involvement in Alzheimer’ s disease [J]., 2016, 54(1): 45-53.
[24] Dos-Santos-Pereira M, da-Silva C A, Guimarães F S,. Co-administration of cannabidiol and capsazepine reduces-DOPA-induced dyskinesia in mice: Possible mechanism of action [J]., 2016, 94: 179-195.
[25] 黄玉菊. 柯诺辛在鱼藤酮诱导的帕金森病小鼠模型保护多巴胺能神经元的作用研究 [D]. 青岛: 青岛大学, 2020.
[26] 崔晓萍, 陈建梅, 穆军山, 等. PI3K-AKT通路对脑缺血损伤神经干细胞的增殖作用 [J]. 中国康复医学杂志, 2016, 31(2): 154-159.
[27] Euteneuer S, Yang K H, Chavez E,. Glial cell line-derived neurotrophic factor (GDNF) induces neuritogenesis in the cochlear spiral ganglion via neural cell adhesion molecule (NCAM) [J]., 2013, 54: 30-43.
[28] Klein A, Gidyk D C, Shriner A M,. Dose-dependent loss of motor function after unilateral medial forebrain bundle rotenone lesion in rats: A cautionary note [J]., 2011, 222(1): 33-42.
[29] Maturana M G, Pinheiro A S, de Souza T L,. Unveiling the role of the pesticides paraquat and rotenone on α-synuclein fibrillation[J]., 2015, 46: 35-43.
[30] 王雪婷. 淫羊藿苷通过激活SIRT3上调线粒体复合体II活性减轻鱼藤酮诱导的多巴胺能神经元损伤 [D]. 遵义: 遵义医科大学, 2020.
[31] 滕龙, 洪芳, 何建成. 中药复方地黄方对帕金森病异动症模型大鼠mRNA及蛋白表达的影响 [J]. 中华中医药杂志, 2018, 33(10): 4403-4406.
[32] Brugnoli A, Napolitano F, Usiello A,. Genetic deletion of Rhes or pharmacological blockade of mTORC1 prevent striato-nigral neurons activation in levodopa-induced dyskinesia [J]., 2016, 85: 155-163.
[33] Singh A, Liang L, Kaneoke Y,. Dopamine regulates distinctively the activity patterns of striatal output neurons in advanced parkinsonian primates [J]., 2015, 113(5): 1533-1544.
[34] Asanuma M, Miyazaki I, Ogawa N. Dopamine-or-DOPA-induced neurotoxicity: The role of dopamine quinone formation and tyrosinase in a model of Parkinson’s disease [J]., 2003, 5(3): 165-176.
[35] Lu M C, Ji J N, Jiang Z Y,. The Keap1-Nrf2-ARE pathway as a potential preventive and therapeutic target: An update [J]., 2016, 36(5): 924-963.
[36] Magesh S, Chen Y, Hu L Q. Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents [J]., 2012, 32(4): 687-726.
[37] Feyder M, Bonito-Oliva A, Fisone G. L-DOPA-induced dyskinesia and abnormal signaling in striatal medium spiny neurons: Focus on dopamine D1 receptor-mediated transmission [J]., 2011, 5: 71.
[38] Lebel M, Chagniel L, Bureau G,. Striatal inhibition of PKA prevents levodopa-induced behavioural and molecular changes in the hemiparkinsonian rat [J]., 2010, 38(1): 59-67.
[39] Schuster S, Nadjar A, Guo J T,. The 3-hydroxy-3-methylglutaryl-CoA reductase inhibitor lovastatin reduces severity of-DOPA-induced abnormal involuntary movements in experimental Parkinson’s disease [J]., 2008, 28(17): 4311-4316.
[40] Grandas F. Subcutaneous infusions of apomorphine: A reappraisal of its therapeutic efficacy in advanced Parkinson’s disease [J]., 2013, 13(12): 1343-1353.
[41] Huh E, Choi J G, Sim Y,. An integrative approach to treat Parkinson’s disease: Ukgansan complements-dopa by ameliorating dopaminergic neuronal damage and-dopa-induced dyskinesia in mice [J]., 2018, 10: 431.
[42] Liu Q F, Jeon Y, Sung Y W,.ethanol extract ameliorates Aβ42cytotoxicity [J]., 2018, 41(4): 470-477.
Mechanism ofon levodopa-induced dyskinesia in rats based on Nrf2/D1R-ERK signaling pathway
LI Jia-yuan, WEI Xiao-jia, WAN Guo-hui, YANG Xue, YU Jia-he, LIU Jin-feng, JIN Zhong-xian, WANG Yu-qing, LYU Yan, SHI Jin-li
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To explore the mechanism of(Nar) on levodopa (-DOPA)-induced dyskinesia (LID) model rat based on Nrf2/D1R-ERK signaling pathway.SD rats were randomly divided into sham group, Parkinson’s disease (PD) group,-DOPA group and Nar +-DOPA group. Rats in PD group,-DOPA group, and Nar +-DOPA group were sc rotenone sunflower oil (1.5 mg/kg) on the back of neck for 14 d to prepare PD model. Rats in sham group was sc same amount of sunflower oil. Then 14 d of drug intervention was carried out: rats in-DOPA group were ig-DOPA (100 mg/kg) and benserazide (25 mg/kg), rats in Nar +-DOPA group were ig Nar (1240 mg/kg),-DOPA (100mg/kg) and benserazide (25 mg/kg), rats in sham group and PD group were ig same amount of normal saline. Effect of-DOPA on motor ability of PD rats was evaluated by forelimb function test. Abnormal involuntary movement (AIM) score was used to assess the AIM degree of LID induced by-DOPA in rats. Expression of tyrosine hydroxylase (TH) in substantia nigra of rats was investigated by immunohistochemical staining. Expressions of nuclear factor E2-related factor 2 (Nrf2), dopamine D1 receptor (D1R), extracellular regulated protein kinases (ERK), p-ERK and ∆FosB protein in rats striatum was detected by Western blotting. ELISA method was used to detected the contents of reactive oxygen species (ROS), heme oxygenase-1 (HO-1), superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), dopamine and adenosine 3′,5′-monophosphate-regulated phosphoprotein (DARPP-32), p-DARPP-32 in the striatum of rats.The results of the forelimb function test showed that-DOPA alone and Nar +-DOPA combined significantly increased the number of forelimb strides in PD rats (< 0.001). The AIM score results showed that compared with-DOPA alone, the combination of Nar +-DOPA significantly reduced the AIM symptoms of LID rats (< 0.01). Immunohistochemical results showed that there was no significant difference in TH expression between PD group and-DOPA group. The combination of Nar +-DOPA significantly enhanced TH expression in PD rats (< 0.05), and significantly enhanced TH expression in LID rats induced by-DOPA alone (< 0.01). Nrf2 signaling pathway showed no significant difference between PD group and-DOPA group. The combination of Nar +-DOPA significantly decreased ROS content (< 0.05), significantly promoted Nrf2 expression (<0.01), significantly increased the contents of HO-1, SOD and GSH-Px of PD rats (< 0.001). The combination of Nar +-DOPA significantly decreased ROS content (< 0.001), significantly increased Nrf2, HO-1, SOD content (< 0.05), and increased GSH-Px content in LID rats (< 0.01). D1R-ERK signaling pathway results showed that the combination of Nar +-DOPA significantly decreased the expression of D1R in LID rats (< 0.001), significantly reduced the expressions of ∆FosB, p-DARPP-32/DARPP-32 and p-ERK/ERK (< 0.05).-DOPA can alleviate dyskinesia in PD rats, but it can not reduce the damage of TH, and can induce an oxidative stress response and overexpression of D1R-ERK pathway. Nar combined with-DOPA significantly alleviated the motor injury of PD rats, inhibited AIM phenomenon caused by-DOPA and increased TH expression. The mechanism may be that Nar plays an anti-LID role by activating the expression of related proteins in Nrf2 pathway and inhibiting the overexpression of related proteins in D1R-ERK pathway.
DC.; Parkinson’s disease; levodopa-induced dyskinesia; Nrf2 signaling pathway; D1R-ERK signaling pathway
R285.5
A
0253 - 2670(2022)01 - 0134 - 09
10.7501/j.issn.0253-2670.2022.01.017
2021-09-30
国家自然科学基金面上项目(82073971)
李佳园(1997—),女,硕士研究生。E-mail: 20190935157@bucm.edu.cn
石晋丽,博士生导师,教授,主要从事中药药效物质基础与作用机制研究。E-mail: shijl@vip.sina.com
[责任编辑 李亚楠]