青藤碱免疫抑制作用机制的研究进展
2022-01-13胡明月易欧阳苏昭丽黄宇明
黄 红,胡明月,徐 丽,易欧阳,苏昭丽,林 也,张 逢,邱 峰,黄宇明,周 华,刘 良*,蔡 雄*
青藤碱免疫抑制作用机制的研究进展
黄 红1,胡明月1,徐 丽1,易欧阳1,苏昭丽1,林 也1,张 逢1,邱 峰1,黄宇明2,周 华3,刘 良3*,蔡 雄1*
1. 湖南中医药大学 中药粉体与创新药物省部共建国家重点实验室(培育基地),湖南 长沙 410208 2. 湖南正清制药集团股份有限公司,湖南 怀化 418000 3. 澳门科技大学 中药质量研究国家重点实验室,中国 澳门 999078
青藤碱是青藤藤茎中的主要活性生物碱,具有显著的镇痛、抗炎、免疫抑制等药效作用,是一种应用前景良好的天然免疫抑制剂。大量研究表明青藤碱对众多免疫细胞(T细胞、单核/巨噬细胞、树突状细胞、肥大细胞)和免疫应答相关因子(细胞因子、活性氧、核因子-κB、细胞黏附分子)均具有免疫调节作用。通过综述近年来青藤碱免疫抑制作用的研究进展,以期为明确青藤碱作为自身免疫性疾病治疗药物的免疫抑制作用靶点,并揭示其作用信号通路途径提供研究思路。
青风藤;青藤碱;免疫抑制;自身免疫性疾病;免疫细胞;免疫应答相关因子
防己科植物青藤(Thunb) Rehd. et Wils.早在1000多年前就被用于治疗风湿类疾病[1]。在20世纪初日本学者从植物青藤中分离得到其主要活性成分青藤碱[2],其是一种吗啡烷类生物碱,分子式为C19H23NO4,化学结构见图1。国内外学者通过大量的基础和临床研究证明,青藤碱具有多种药理活性如抗炎、降压、镇痛、抗心律失常等,在治疗慢性肾炎、抗氧化、抗肿瘤、戒毒等方面也发挥着重要作用[3]。
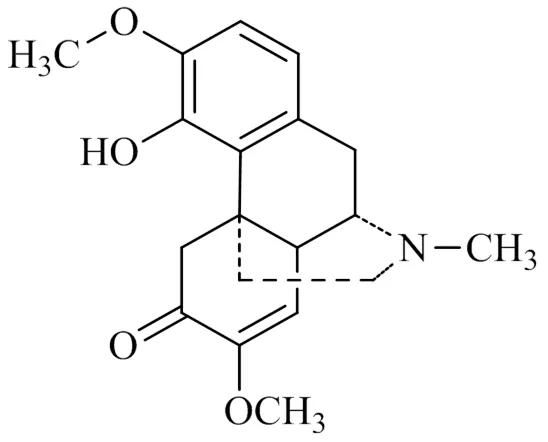
图1 青藤碱的化学结构
近年来,自身免疫性疾病患病率逐年增加,使得寻找高效、低毒的免疫抑制剂成为当前研究的热点之一[4]。目前已有大量研究表明[5],青藤碱在动物实验模型和一些临床应用中对免疫相关疾病具有潜在治疗作用,然而其免疫抑制作用多样,作用调节机制尚不明确。为促进药物的有效应用,青藤碱的免疫抑制作用机制依然是本领域研究的重点。因此,本文对青藤碱对免疫细胞与免疫分子的调节作用进行综述,为其进一步的免疫抑制作用机制研究提供参考。
1 对免疫细胞的作用
1.1 对淋巴细胞的作用
淋巴细胞是机体免疫应答反应的核心,在适应性免疫系统中发挥着关键作用。一项关于青藤碱和乌头原碱对小鼠CD4+T细胞核因子-κB(nuclear factor-κB,NF-κB)受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)表达影响的研究表明,青藤碱能呈浓度相关性地降低CD4+T细胞RANKL的表达,从而抑制RANKL诱导小鼠单核巨噬细胞RAW264.7分化成为破骨细胞并调节骨代谢,达到改善类风湿性关节炎所致骨损伤的作用[6]。此外,青藤碱还被报道能阻断细胞周期从G0/G1期到S期以及G2/M期的进展,其对CD4+原代淋巴细胞的免疫抑制活性主要是由半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)-3介导的细胞凋亡引起的,而在活化的T细胞中B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达水平并无明显变化,推测Bcl-2可能不参与青藤碱诱导的T细胞凋亡[7]。在复发性自然流产小鼠模型中,研究者发现青藤碱可降低复发性自然流产小鼠蜕膜和血清中T盒子转录因子(T-box transcription factor bet,T-bet)、γ干扰素(interferon-γ,IFN-γ)水平以及IFN-γ/白细胞介素(interleukin,IL)-4、T-bet/ GATA结合蛋白-3(GATA-binding protein-3,GATA-3)的值,但不影响GATA-3和IL-4的表达水平,由于T-bet是辅助性T细胞1(helper T cell 1,Th1)转录因子,GATA-3是Th2转录因子,提示青藤碱显著抑制Th1表达,T-bet/GATA-3值的变化反映了青藤碱调节Th1/Th2平衡的作用[8]。
Th17和CD4+CD25+调节性T细胞(regulatory cells,Treg)细胞是2种不同的CD4+T细胞亚群,均具有拮抗作用,在维持免疫平衡中发挥重要作用。Th17细胞被认为是炎症性Th细胞,可分泌IL-17来介导炎症和自身免疫,而Treg细胞分泌产生转化生长因子-β(transforming growth factor-β,TGF-β)、IL-10和IL-35,主要介导免疫耐受或发挥免疫抑制作用[9-10]。Tong等[11]研究青藤碱抗胶原诱导型关节炎的作用机制,发现青藤碱治疗组的IL-17A显著下调,而IL-10明显上调,在肠道淋巴组织中,Treg细胞比例及其关键转录因子叉头框蛋白P3(forkhead box P3,Foxp3)表达增加而Th17细胞比例及其关键转录因子维甲酸相关核孤独受体γt(retinoic acid-related orphan receptor gamma transcription factor,RORγt)表达降低,说明青藤碱对肠道组织中Treg、Th17细胞具有调节作用,因此可以推测青藤碱通过调节Th17/Treg平衡以减轻关节炎。然而,青藤碱参与Treg细胞诱导的方式尚不清楚。综上所述,青藤碱主要通过抑制T淋巴细胞的增殖和促炎因子分泌、诱导T细胞凋亡以及调节Th1/Th2、Th17/Treg的平衡来抑制淋巴细胞的活性(图2)。但对B淋巴细胞作用的相关文献报道较少,亟待进一步探讨。
1.2 对单核/巨噬细胞的作用
巨噬细胞源自单核细胞,参与包括吞噬、处理和提呈抗原,调节机体免疫和修复组织等免疫反应的各个环节。巨噬细胞可以分化为不同的表型,最常见的是M1和M2巨噬细胞。罗进芳等[12]分别以脂多糖(lipopolysaccharide,LPS)、IL-4处理RAW264.7细胞来诱导其M1、M2型极化,青藤碱作用于不同诱导状态下RAW264.7细胞后用酶联免疫法检测,结果发现青藤碱能抑制LPS处理后小鼠RAW264.7细胞肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的产生,抑制一氧化氮合成酶和细胞因子信号抑制因子3(suppressor of cytokinesignaling 3,)mRNA表达水平,抑制M1型极化;同时,青藤碱能抑制IL-4处理后小鼠RAW264.7细胞IL-10的分泌和精氨酸酶-1(arginase-1,)mRNA水平的升高,抑制其分化为M2型。此外,研究者还发现青藤碱可显著提高配对免疫球蛋白样受体B的表达水平,减少M1型巨噬细胞的比例,提示青藤碱可能通过上调免疫球蛋白样受体B的机制抑制巨噬细胞M1型极化[13]。可见,青藤碱通过调节巨噬细胞M1和M2型的平衡干预病情进展,维持M1和M2型的动态平衡对于自身免疫性疾病的治疗有重要意义。
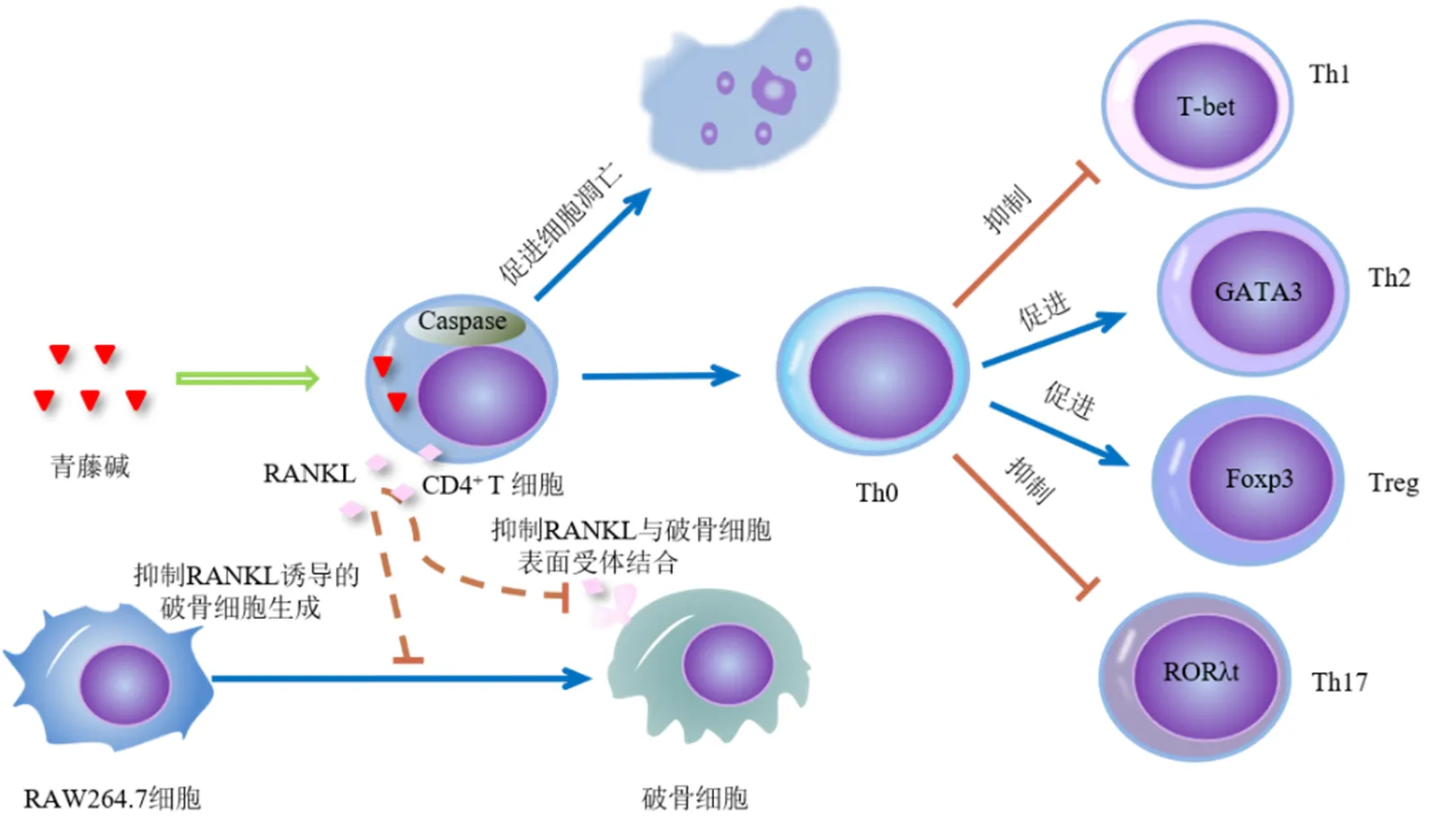
图2 青藤碱调节淋巴细胞的作用机制
在RAW264.7细胞中,青藤碱可以通过激活细胞外信号调节激酶介导巨噬细胞凋亡,青藤碱诱导的Bcl-2相关X蛋白水平上调和Bcl-2减少可能协同诱导巨噬细胞的凋亡[14]。彭玥等[15]研究发现,青藤碱干预后的RAW264.7细胞TNF-α和IL-6的表达和释放下调,同时明显促进了自噬相关蛋白LC3和血红素氧合酶-1(heme oxygenase-1,HO-1)水平的升高;而在HO-1抑制剂锌原卟啉IX预处理后,青藤碱抑制TNF-α和IL-6表达和释放的作用减弱,LC3绿色荧光聚集减少,推测青藤碱可能通过调节HO-1介导的自噬激活,产生抑制LPS诱导的RAW264.7细胞炎症的作用。在LPS诱导的RAW264.7细胞中进一步研究表明[16],青藤碱能够下调微小RNA-155(microRNA-155,miR-155)和上调细胞因子信号抑制物1,抑制细胞NF-κB的转录,并下调Toll样受体4(Toll like receptor 4,TLR4)通路中炎症细胞因子TNF-α、IL-1β、IL-6和关键因子TLR4、髓样分化因子88(myeloid differentiation factor 88,MyD88)、NF-κB抑制蛋白(inhibitor of NF-κB,IκB)的蛋白和RNA水平。此外,Qin等[17]研究证实,青藤碱是一种核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)激活因子,它通过降解Kelch样环氧氯丙烷相关蛋白1(kelch like-ECH-associated protein 1,Keap1)激活Nrf2信号通路,除了抑制M1型细胞因子TNF-α、IL-1β和IL-6的表达外,还显著增强了巨噬细胞和肾脏中Arg-1、IL-10和HO-1的表达。同时,青藤碱还能激活α7烟碱型胆碱能受体(α7 nicotinic acetylcholine receptor,α7nAChR)通路,下调CD14和TLR4的表达,抑制LPS诱导的细胞内钙库Ca2+的产生和NF-κB的激活,促进激活Janus激酶2(Janus kinase 2,JAK2)/信号转导及转录激活因子3(signal transducers and activators of transcription 3,STAT3)通路并触发一些α7nAChR下游信号通路,以抑制TNF-α、IL-6、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)、巨噬细胞迁移抑制因子和基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)的产生[18]。以上研究表明,青藤碱作用于多种信号通路(图3),通过维持M1和M2型巨噬细胞的动态平衡、诱导巨噬细胞凋亡、抑制巨噬细胞的趋化和分泌功能来发挥免疫抑制作用。
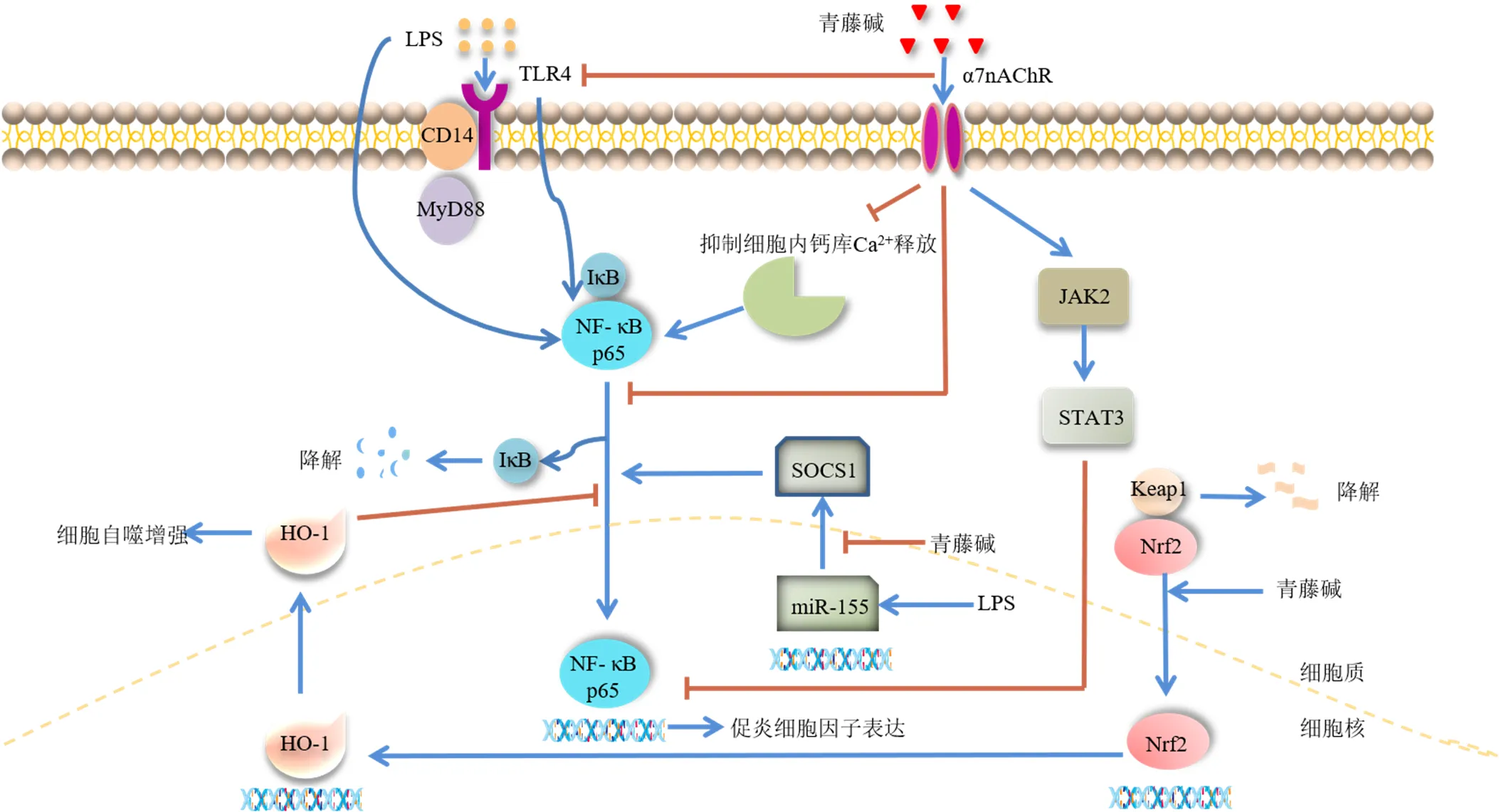
图3 青藤碱调节单核/巨噬细胞的作用机制
1.3 对树突状细胞的作用
树突状细胞在调节免疫应答中起核心作用,具有调控多种效应细胞的作用,是机体功能最强的抗原呈递细胞。根据树突状细胞成熟程度可分为成熟树突状细胞(mature dendritic cells,mDC)和未成熟树突状细胞(immature dendritic cell,imDC)。mDC可促进主要组织相容性复合体(major histocompatibility complex,MHC)I、MHC II、共刺激分子CD80、CD86、CD40和IL-12的分泌,来激活T细胞和参与免疫反应。imDC表达黏附因子和共刺激分子的能力较弱,促进混合淋巴细胞增殖的能力较差,因此imDC可以介导免疫抑制。青藤碱对树突状细胞的免疫机制已有很多研究,Zhao等[19]研究青藤碱对人单核细胞源性树突状细胞的影响发现,青藤碱可以有效下调mDC的表面分子(CD40、CD80、CD86、CD83、人类白细胞抗原-DR)以及IL-12在蛋白质和mRNA水平上的表达,青藤碱处理的树突状细胞中NF-κB的活性及易位降低,推测青藤碱以NF-κB和IκB依赖方式抑制树突状细胞的成熟。此外,研究者还发现[20],青藤碱可显著促进单核细胞分化为树突状细胞,抑制LPS处理的树突状细胞对抗原的摄取,同时上调CD1a而降低CD14,LPS诱导的mDC上的表面标志分子CD83和共刺激分子(CD86、B7-H1、CD40)的表达受到抑制,CD4+T细胞分泌IL-2和IFN-γ减少,表明青藤碱可抑制树突状细胞成熟和共刺激分子的表达。一项关于小鼠树突状细胞系DC2.4细胞的体外研究表明[21],青藤碱可下调TNF-α、CD80、IFN-γ、IL-6、IL-12的含量,促进IL-10的表达,从而抑制DC2.4细胞活性及减少致炎因子的产生。Li等[22]研究供体来源的树突状细胞移植前注射青藤碱对受体大鼠Treg影响的结果表明,青藤碱抑制供体来源的树突状细胞的成熟,导致移植后Treg数量增加,特别是Foxp3+Treg在受体脾脏中的形成,这可能是青藤碱在肾移植中发挥免疫抑制功能的机制之一。这些研究证实了青藤碱对树突状细胞分化、成熟、功能的调节与其在特殊免疫应答中的作用具有潜在的关联性(图4)。
1.4 对肥大细胞的作用
肥大细胞作为免疫细胞能参与免疫应答,产生多种细胞因子,表达MHC分子,激活淋巴细胞,具有抗原呈递功能。王文君等[23]研究发现,高浓度(>500 μmol/L)青藤碱可直接诱导大鼠嗜碱粒细胞系RBL-2H3细胞脱颗粒,而较低浓度(100 μmol/L)青藤碱可抑制RBL-2H3细胞的活化和脱颗粒作用,诱导肥大细胞凋亡并阻止其增殖。Oh等[24]研究表明,青藤碱抑制佛波酯和钙离子载体A23187刺激骨髓源性肥大细胞BMMCs产生IL-6、前列腺素D2、白三烯C4、β-氨基己糖苷酶和环氧化酶-2(cyclooxygenase-2,COX-2)蛋白,提示青藤碱有可能用于治疗过敏。然而这个结果与Wang等[25]的结论相反,Wang等[25]利用小鼠肥大细胞瘤细胞P815来确定青藤碱对非免疫球蛋白E高亲和力受体介导激活的肥大细胞影响的研究发现,青藤碱直接结合在肥大细胞膜上,激活酪氨酸激酶和脾脏酪氨酸激酶,从而触发磷酸脂酶C-γ介导的游离三磷酸肌醇的产生。此外,三磷酸肌醇与内质网肌醇1,4,5-三磷酸受体结合,触发Ca2+释放,导致肥大细胞脱颗粒和过敏介质β-氨基己糖苷酶及组胺的释放。因此,青藤碱对肥大细胞的影响及其作用机制还需进一步研究。
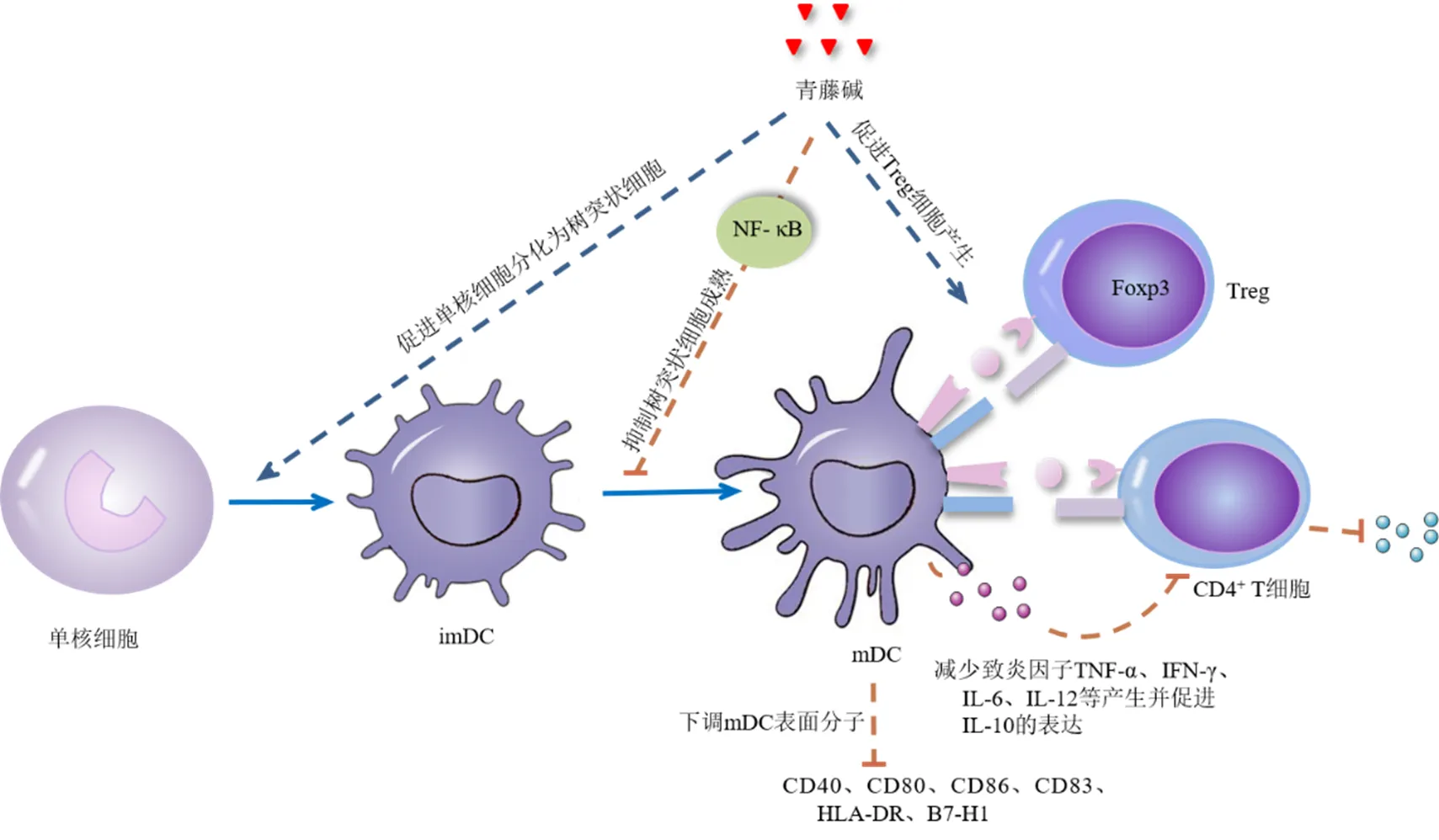
图4 青藤碱调节树突状细胞的作用机制
2 对免疫应答相关因子的作用
2.1 对细胞因子的作用
青藤碱广泛应用于治疗自身免疫性疾病,特别是类风湿性关节炎,这些作用部分是由于细胞因子和促炎因子的调节所致。细胞识别抗原后,产生细胞因子。Sun等[26]研究表明,青藤碱和甲氨蝶呤联合使用可调节破骨细胞相关细胞因子,协同降低RANKL、IL-6、IL-17和MMPs的表达,显著增加骨保护素(osteoprotegerin,OPG)的水平并抑制RANKL的表达,增加OPG/RANKL的值,进而阻碍破骨细胞的形成和活化,延缓骨破坏。张家薇等[27]研究表明,青藤碱能通过减少阿奇霉素诱导的急性肝损伤大鼠IL-6、IL-18及IL-1β的产生而发挥抑炎作用,减轻大鼠急性肝损伤。此外,在四氯化碳诱导的急性肝损伤小鼠中研究也发现,青藤碱可下调IL-6、IL-1β及TNF-α水平,从而减轻炎症反应[28]。使用流式细胞术测定胶原诱导型关节炎小鼠模型与类风湿性关节炎患者的相关单核/巨噬细胞亚群,结果表明,青藤碱在体内和体外调节IL-6、粒细胞-巨噬细胞集落刺激因子、IL-12 p40、IL-1α、TNF-α、IL-1β、中性粒细胞趋化因子、嗜酸性粒细胞趋化因子2、IL-10、巨噬细胞集落刺激因子、趋化因子调节蛋白和MCP-1 12种细胞因子的分泌,提示青藤碱能够调节多种炎症性细胞因子的分泌减缓类风湿性关节炎的进展[29]。
2.2 对活性氧的作用
活性氧是正常氧气代谢的天然副产物,是含有氧的化学反应分子,对细胞信号转导具有重要影响。然而,在环境压力下,活性氧水平会迅速增加,氧化应激是指活性氧产生过多后引起组织和细胞的损伤[30]。青藤碱能促进谷胱甘肽、超氧化物歧化酶(superoxide dismutase,SOD)水平上升并下调丙二醛表达水平,以减轻四氯化碳诱导的急性肝损伤小鼠氧化应激[28]。在异丙肾上腺素诱导的心肌肥厚模型小鼠中,青藤碱显著降低了乳酸脱氢酶和丙二醛含量,上调心肌T-SOD活性,表明青藤碱能抑制氧化应激,保护心肌[31]。Ramazi等[32]研究也表明,50mg/kg青藤碱可以显著恢复颞叶癫痫模型大鼠活性氧、丙二醛、HO-1和SOD水平,部分抑制NF-κB、TLR4、TNF-α、胶质纤维酸性蛋白和Caspase-1的增加,但对谷胱甘肽水平影响不显著。
青藤碱主要作用于Nrf2相关信号通路来调控活性氧的产生,在类风湿性关节炎等慢性炎症性疾病的发病机制中起着重要作用(图5)。在静息状态下,Nrf2与其抑制剂Keap1相连,在活性氧或亲电物诱导下,Nrf2从Keap1中释放出来,并在细胞核中作为转录因子转录,促进其下游抗氧化和解毒酶的表达,如HO-1、还原型辅酶I(II)[nicotinamide adenine dinucleotide,NAD(P)H]、醌氧化还原酶-1[NAD(P)H quinone dehydrogenase-1,NQO-1]、SOD和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)[33-34]。Liu等[35]研究青藤碱对大肠杆菌诱导的ALI小鼠模型的影响发现,青藤碱显著增加了HO-1、Nrf2和NQO-1的蛋白表达,促进了Nrf2的核进入,证明青藤碱通过激活Nrf2信号通路抑制大肠杆菌诱导的氧化应激。Qin等[36]研究表明,青藤碱能够通过调控Nrf2信号通路,减少单侧输尿管梗阻引起的氧化应激,抑制TGF-β相关的促纤维化活性从而减轻肾间质纤维化,提示青藤碱可以抑制TGF-β或H2O2诱导肾脏细胞中的氧化剂来发挥提高SOD及GSH-Px在肾细胞和纤维化肾脏中解毒酶活性的效应。经证实,青藤碱可在小鼠Ser351位点(对应人类Ser349)磷酸化p62,降解Keap1并上调Nrf2表达水平,上调Thr269/Ser272位点p62的磷酸化,从而激活p62-Keap1-Nrf2信号通路,发挥抗关节炎作用[37]。

图5 青藤碱调节活性氧的作用机制
2.3 对转录因子NF-κB的作用
NF-κB是真核生物中的一种核转录因子,在大多数静息细胞中,NF-κB通过与IκB相互作用而被隔离在细胞质中,当细胞受到高糖、氧化应激或促炎细胞因子的产生等刺激时,IκB激酶快速磷酸化IκB,促进其泛素化和蛋白酶体降解,最终使NF-κB进入细胞核并诱导其转录活性[38]。越来越多的研究揭示了NF-κB在炎症性疾病中的重要性,通过阻断NF-κB可以达到干预治疗作用[39]。Wang等[40]和Xu等[41]在细胞实验和动物实验中皆证实,青藤碱可通过抑制NF-κB和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号,下调致炎因子IL-6、TNF-α等,从而缓解炎症。Yi等[42]研究了体内和体外青藤碱对佐剂诱导关节炎大鼠成纤维样滑膜细胞的影响,结果显示,青藤碱通过α7nAChR信号通路增加了佐剂诱导关节炎大鼠和成纤维样滑膜细胞的腺苷A2A受体的表达,抑制NF-κB通路的激活,以减轻关节炎;敲除α7nAChR后,青藤碱对NF-κB激活的抑制作用减弱,表明青藤碱对NF-κB的影响依赖于α7nAChR。结果表明,青藤碱能够使NF-κB信号失效。
2.4 对细胞黏附分子的作用
细胞黏附分子作为一种炎症递质,可促进炎症细胞、白细胞、肿瘤细胞等与内皮细胞间的黏附,活化内皮细胞,其表达水平变化可反映机体免疫应答状态,在调节机体免疫反应中发挥重要作用。杨帆等[43]建立大鼠心脏移植排斥反应模型研究青藤碱对移植排斥反应的影响及其作用机制,发现青藤碱能通过下调IL-2及细胞黏附分子的水平并抑制免疫细胞活性,延长移植物存活时间,减轻排斥反应。方敬等[44]观察青藤碱对改良的慢性血清病性系膜增生性肾小球肾炎大鼠模型的肾组织中细胞黏附分子表达的影响时也发现,青藤碱能显著抑制细胞黏附分子的表达,有效减缓肾脏炎症反应,延缓病变进展。另有研究表明[45],青藤碱对体外TNF-α诱导的人脐静脉内皮细胞的血管内皮细胞黏附分子-1 mRNA和蛋白水平的表达均有抑制作用。由此可知,青藤碱能够通过抑制细胞黏附分子的表达来发挥免疫抑制作用。
3 结语
青藤碱是一种在中药青风藤中分离鉴定的吗啡烷类生物碱,其化学结构新颖,具有显著的镇痛、抗炎、免疫抑制作用[46],其盐酸盐制剂正清风痛宁临床用于风湿免疫病如类风湿关节炎、IgA肾炎等治疗疗效确切,不良反应小[47]。研究表明,青藤碱对各种免疫细胞具有免疫抑制作用,如抑制淋巴细胞的活化增殖、调节巨噬细胞、干扰树突状细胞的分化成熟、诱导肥大细胞凋亡,与多种免疫应答相关因子(细胞因子、活性氧、NF-κB、细胞黏附分子)有关,并涉及α7nAChR、Nrf2/NQO-1、MAPK、JAK2/STAT3等信号通路。可见,青藤碱作用靶点众多,信号通路十分复杂,难以确定其发挥免疫抑制作用的相对突出途径,确切作用机制还有待进一步证实。目前,青藤碱主要用于治疗各种类风湿疾病,对于其他自身免疫性疾病大多仍处于基础研究阶段,随着对青藤碱免疫作用机制的深入了解,将为青藤碱治疗更多疾病提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Wang Q, Li X K. Immunosuppressive and anti-inflammatory activities of sinomenine [J]., 2011, 11(3): 373-376.
[2] Yamasaki H. Pharmacology of sinomenine, an anti-rheumatic alkaloid from[J]., 1976, 30(1): 1-20.
[3] 王玺, 张智勇, 仇萍, 等. 青风藤、青藤碱及其相关制剂的研究进展 [J]. 中国药学杂志, 2021, 56(2): 85-93.
[4] 潘海峰, 冷瑞雪, 吴国翠, 等. 重大自身免疫性疾病的流行病学研究进展 [J]. 中华疾病控制杂志, 2018, 22(11): 1093-1095.
[5] 孙越华, 朱清, 李俊旭. 青藤碱抗炎免疫与抗肿瘤作用研究新进展 [J]. 中国药理学通报, 2015, 31(8): 1040-1043.
[6] 王铿, 曾祥周, 陶磊, 等. 青藤碱合用乌头原碱对CD4+T细胞RANKL表达和破骨细胞生成的影响 [J]. 中药药理与临床, 2016, 32(3): 61-65.
[7] Shu L, Yin W, Zhang J,. Sinomenine inhibits primary CD4+T-cell proliferation via apoptosis [J]., 2007, 31(8): 784-789.
[8] Luo J, Wang Y, Qi Q,. Sinomenine improves embryo survival by regulating Th1/Th2 balance in a mouse model of recurrent spontaneous abortion [J]., 2021, 27: e927709.
[9] Yasuda K, Takeuchi Y, Hirota K. The pathogenicity of Th17 cells in autoimmune diseases [J]., 2019, 41(3): 283-297.
[10] Diller M L, Kudchadkar R R, Delman K A,. Balancing inflammation: The link between Th17 and regulatory T cells [J]., 2016, 2016: 6309219.
[11] Tong B, Yu J, Wang T,. Sinomenine suppresses collagen-induced arthritis by reciprocal modulation of regulatory T cells and Th17 cells in gut-associated lymphoid tissues [J]., 2015, 65(1): 94-103.
[12] 罗进芳, 朱瑞丽, 易浪, 等. 青藤碱对LPS、IL-4诱导的小鼠RAW264.7巨噬细胞极化的影响 [J]. 中国免疫学杂志, 2015, 31(1): 56-60.
[13] 卫智权, 包传红, 陈仪新, 等. 青藤碱增加配对免疫球蛋白受体B表达抑制巨噬细胞经典活化 [J]. 药学学报, 2021, 56(6): 1644-1652.
[14] He X, Wang J, Guo Z,. Requirement for ERK activation in sinomenine-induced apoptosis of macrophages [J]., 2005, 98(1): 91-96.
[15] 彭玥, 欧好, 杨明施, 等. 青藤碱通过调节血红素氧合酶-1表达和自噬抑制脂多糖诱导的RAW264.7巨噬细胞炎症 [J]. 中南大学学报: 医学版, 2018, 43(9): 964-970.
[16] Yin N, Xiong Y, Tao W,. Sinomenine alleviates lipopolysaccharide-induced inflammatory responses in RAW264.7 macrophages [J]., 2020, 42(2): 147-155.
[17] Qin T, Du R, Huang F,. Sinomenine activation of Nrf2 signaling prevents hyperactive inflammation and kidney injury in a mouse model of obstructive nephropathy [J]., 2016, 92: 90-99.
[18] Zhu R L, Zhi Y K, Yi L,. Sinomenine regulates CD14/TLR4, JAK2/STAT3 pathway and calcium signal via α7nAChR to inhibit inflammation in LPS-stimulated macrophages [J]., 2019, 41(1): 172-177.
[19] Zhao Y, Li J, Yu K,. Sinomenine inhibits maturation of monocyte-derived dendritic cells through blocking activation of NF-κB [J]., 2007, 7(5): 637-645.
[20] Chen Y, Yang C, Jin N,. Sinomenine promotes differentiation but impedes maturation and co-stimulatory molecule expression of human monocyte-derived dendritic cells [J]., 2007, 7(8): 1102-1110.
[21] 王竹, 王冰冰, 官菊梅, 等. 青藤碱抑制体外培养DC2.4树突状细胞的生物学活性并减少炎症因子分泌 [J]. 细胞与分子免疫学杂志, 2015, 31(5): 660-663.
[22] Li L, Luo Z, Song Z,. Pre-transplant infusion of donor-derived dendritic cells maintained at the immature stage by sinomenine increases splenic Foxp3+Tregs in recipient rats after renal allotransplantation [J]., 2017, 45: 22-28.
[23] 王文君, 李红, 杜群, 等. 青藤碱对RBL-2H3肥大细胞增殖凋亡以及活化脱颗粒的影响 [J]. 免疫学杂志, 2009, 25(3): 261-263.
[24] Oh Y C, Kang O H, Choi J G,. Anti-allergic effects of sinomenine by inhibition of prostaglandin D₂ and leukotriene C4in mouse bone marrow-derived mast cells [J]., 2011, 33(2): 266-270.
[25] Wang N, Liu R, Liu Y,. Sinomenine potentiates P815 cell degranulation via upregulation of Ca2+mobilization through the Lyn/PLCγ/IP3R pathway [J]., 2016, 29(4): 676-683.
[26] Sun Y, Yao Y, Ding C Z. A combination of sinomenine and methotrexate reduces joint damage of collagen induced arthritis in rats by modulating osteoclast-related cytokines [J]., 2014, 18(1): 135-141.
[27] 张家薇, 薛冰, 崔正军, 等. 青藤碱对阿奇霉素诱导的急性肝损伤大鼠的保护作用及机制研究 [J]. 中国免疫学杂志, 2018, 34(12): 1814-1818.
[28] 郭华, 裴高油, 李龙腾, 等. 青藤碱缓解氧化应激和炎症反应对四氯化碳诱导的急性肝损伤小鼠的保护作用 [J]. 中国免疫学杂志, 2019, 35(8): 939-943.
[29] Liu W W, Zhang Y J, Zhu W N,. Sinomenine inhibits the progression of rheumatoid arthritis by regulating the secretion of inflammatory cytokines and monocyte/ macrophage subsets [J]., 2018, 9: 2228.
[30] Jiang W, Fan W, Gao T,. Analgesic mechanism of sinomenine against chronic pain [J]., 2020, 2020: 1876862.
[31] 李依琪, 李乐. 青藤碱对异丙肾上腺素诱导小鼠心肌肥厚的影响 [J]. 中国应用生理学杂志, 2018, 34(6): 547-549.
[32] Ramazi S, Fahanik-Babaei J, Mohamadi-Zarch S M,. Neuroprotective and anticonvulsant effects of sinomenine in kainate rat model of temporal lobe epilepsy: Involvement of oxidative stress, inflammation and pyroptosis [J]., 2020, 108: 101800.
[33] Aminzadeh M A, Nicholas S B, Norris K C,. Role of impaired Nrf2 activation in the pathogenesis of oxidative stress and inflammation in chronic tubulo-interstitial nephropathy [J]., 2013, 28(8): 2038-2045.
[34] Kovac S, Angelova P R, Holmström K M,. Nrf2 regulates ROS production by mitochondria and NADPH oxidase [J]., 2015, 1850(4): 794-801.
[35] Liu S Z, Chen Q H, Liu J J,. Sinomenine protects against-induced acute lung injury in mice through Nrf2-NF-κB pathway [J]., 2018, 107: 696-702.
[36] Qin T, Yin S, Yang J,. Sinomenine attenuates renal fibrosis through Nrf2-mediated inhibition of oxidative stress and TGFβ signaling [J]., 2016, 304: 1-8.
[37] Liao K, Su X, Lei K,. Sinomenine protects bone from destruction to ameliorate arthritis via activating p62 Thr269/Ser272-Keap1-Nrf2 feedback loop [J]., 2021, 135: 111195.
[38] Zhang Q, Lenardo M J, Baltimore D. 30 Years of NF-κB: A blossoming of relevance to human pathobiology [J]., 2017, 168(1/2): 37-57.
[39] Sehnert B, Burkhardt H, Dübel S,. Cell-type targeted NF-kappa B inhibition for the treatment of inflammatory diseases [J]., 2020, 9(7): 1627.
[40] Wang Y, Yu C, Zhang H. Lipopolysaccharides-mediated injury to chondrogenic ATDC5 cells can be relieved by sinomenine via downregulating microRNA-192 [J]., 2019, 33(7): 1827-1836.
[41] Xu M, Liu S, Wan R,. Combined treatment with sinomenine and acupuncture on collagen-induced arthritis through the NF-κB and MAPK signaling pathway [J]., 2018, 15(6): 8770-8776.
[42] Yi L, Ke J Y, Liu J Y,. Sinomenine increases adenosine A2A receptor and inhibits NF-κB to inhibit arthritis in adjuvant-induced-arthritis rats and fibroblast-like synoviocytes through α7nAChR [J]., 2021, 110(6): 1113-1120.
[43] 杨帆, 季刚, 陈彦彬, 等. 青藤碱对大鼠心脏移植排斥反应期间ICAM-1和IL-2的影响 [J]. 细胞与分子免疫学杂志, 2007, 23(3): 240-241.
[44] 方敬, 仇新军, 闫翠环, 等. 青藤碱对MsPGN大鼠肾脏病理及ICAM-1表达的影响 [J]. 天然产物研究与开发, 2011, 23(3): 436-439.
[45] Huang J L, Lin Z F, Luo M Q,. Sinomenine suppresses TNF-α-induced VCAM-1 expression in human umbilical vein endothelial cells [J]., 2007, 114(2): 180-185.
[46] 魏燕, 张永生, 郑杭生, 等. 盐酸青藤碱传递体的制备及其对大鼠类风湿性关节炎的药效评价 [J]. 中草药, 2017, 48(23): 4872-4879.
[47] 唐琳, 陆晓珊, 林也, 等. 正清风痛宁联合应用治疗IgA肾病有效性和安全性的Meta分析 [J]. 时珍国医国药, 2020, 31(12): 3050-3054.
Research progress on immunosuppressive mechanism of sinomenine
HUANG Hong1, HU Ming-yue1, XU Li1, YI Ou-yang1, SU Zhao-li1, LIN Ye1, ZHANG Feng1, QIU Feng1, HUANG Yu-ming2, ZHOU Hua3, LIU Liang3, CAI Xiong1
1. Institute of Innovation and Applied Research in Chinese Medicine, Hunan University of Chinese, Changsha 410208, China 2. Hunan Zhengqing Pharmaceutical Group Co., Ltd., Huaihua 418000, China 3. State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 999078, China
Sinomenine is a main bioactive alkaloid isolated from the stem of. Sinomenine demonstrates significant analgesic, anti-inflammatory, and immunosuppressive effects, and has presented great potential as a naturally-derived immunosuppressive agent for autoimmune diseases. Many researches have shown that sinomenine exerts its immunosuppressive effects on various immune cells (T cells, monocytes/macrophages, dendritic cells and mast cells) and a number of immune response related factors (cytokines, reactive oxygen, nuclear factor-κB and cell adhesion molecules). Research progress on immunosuppressive mechanism of sinomenine are reviewed in this paper, so as to provide research ideas for identification of immunosuppressive target and signaling pathway of sinomenine as a treatment for autoimmune diseases.
(Thunb.) Rehd. et Wils.; sinomenine; immunosuppression; autoimmune disease; immune cell; immune response related factor
R282.710.5
A
0253 - 2670(2022)01 - 0261 - 09
10.7501/j.issn.0253-2670.2022.01.030
2021-10-29
湖南省科技创新重大项目(2020SK1020);湖南省“芙蓉学者奖励计划”资助项目(湘教通[2020]58号);湖南省121创新人才培养工程资助项目(湘人社函[2019]192号);湖南省“刘良院士专家工作站”资助项目(湘科协通[2020]34号);湖南中医药大学中医学国内一流建设学科项目(校行科字[2018]3号);湖南省中药粉体与创新药物省部共建国家重点实验室培育基地开放基金项目(科函[2018]4号)
黄 红(1998—),女,硕士研究生,研究方向为中药抗炎免疫药理研究。Tel: 18890750578 E-mail: aquakcc@qq.com
蔡 雄(1976—),男,博士生导师,湖南省“芙蓉学者”特聘教授,研究方向为中药抗炎免疫药理研究。E-mail: caixiong@hnucm.edu.cn
刘 良(1957—),男,中国工程院院士,博士生导师,研究方向为中医药诊疗风湿病与中药抗炎免疫药理作用机制研究。E-mail: lliu@must.edu.mo
[责任编辑 崔艳丽]