余甘子及其活性成分肝保护作用及机制的研究进展
2022-01-13尹可欢罗晓敏阙涵韵李大鹏龚普阳
尹可欢,罗晓敏,丁 翼,阙涵韵,谭 睿,李大鹏,龚普阳*,顾 健
余甘子及其活性成分肝保护作用及机制的研究进展
尹可欢1,罗晓敏1,丁 翼1,阙涵韵1,谭 睿2,李大鹏3,龚普阳1*,顾 健1
1. 西南民族大学药学院,四川 成都 610041 2. 西南交通大学生命科学与工程学院,四川 成都 610031 3. 四川大学华西药学院,四川 成都 610041
余甘子来源于余甘子的干燥成熟果实,是我国重要的药食同源品种,具有抗炎、抗氧化、抗肿瘤和免疫调节等广泛的生物活性。通过对余甘子提取物及其所含没食子酸、鞣花酸及柯里拉京等活性成分的药理作用进行总结,发现其对肝损伤、病毒性肝炎、非酒精性脂肪肝、肝纤维化及肝癌等具有治疗作用,主要通过抑制脂质过氧化、降低炎症反应、抗肝细胞凋亡、调节脂质代谢、维持肝星状细胞稳态及促肝癌细胞凋亡等发挥肝保护作用。对余甘子及其单体活性成分治疗肝脏疾病的药理作用及其机制进行归纳分析,以期为其在防治肝脏疾病中的深入研究以及开发应用提供参考依据。
余甘子;没食子酸;鞣花酸;柯里拉京;肝损伤;病毒性肝炎;非酒精性脂肪肝;肝纤维化;肝癌
余甘子是广泛分布于热带和亚热带的大戟科叶下珠属落叶小乔木余甘子L.的干燥成熟果实[1]。余甘子又名滇橄榄、庵摩勒、油甘子等,在我国拥有近两千年的食用或药用历史,既是我国西南地区重要的经济作物,也是重要的中药及多民族药物资源[2]。现代植物化学与药理学研究表明,余甘子含有酚酸类、维生素、氨基酸、黄酮类、多糖类、甾醇类等生物活性物质[3],具有较好的抗炎、抗氧化、抗肿瘤、抗衰老、保肝和免疫调节等作用[4],是联合国卫生组织指定在全世界推广种植的3种保健植物之一[5],同时也被原卫生部列入“药食同源”名单[6]。自1977年始,余甘子以藏族习用药材先后收载于各版《中国药典》,其味甘、酸、涩,性凉,具有清热凉血、消食健胃及生津止咳等功效[7]。藏医常以余甘子治疗“血病”“赤巴病”及“培根病”,这与中医中的血热血瘀及现代医学中的高血压、肝胆疾病及消化系统疾病的临床表现有很多相似之处[8]。近年来,余甘子及相关复方制剂对多种肝脏疾病具有良好的改善作用,且鲜见毒性相关报道,使之成为肝病领域的大健康产品及药品开发的重要“药食同源”品种之一[9]。本文通过总结国内外学者关于余甘子的研究报道,对其提取物及单体成分的抗肝病药理作用及相关机制进行系统归纳分析,以期为余甘子中保肝新机制及新物质的发现提供一定的理论基础,并为其临床合理应用及相关功能产品的开发提供参考依据。
1 主要活性成分
研究表明,现已从余甘子中提取分离获得百余种化合物,其中鞣质类48个,酚酸类34个,黄烷醇及其衍生物8个,黄酮类20个,萜类8个,α-糠醛等挥发性成分43个以及多糖、甾醇、蛋白质、氨基酸、微量元素等多种活性物质[10]。其中,酚酸、鞣质等多酚类物质被认为是余甘子的主要活性成分。余甘子中没食子酸、鞣花酸、柯里拉京及诃子酸等多种单体化合物已被证实具有显著的体内外肝保护活性,其化学结构见图1。
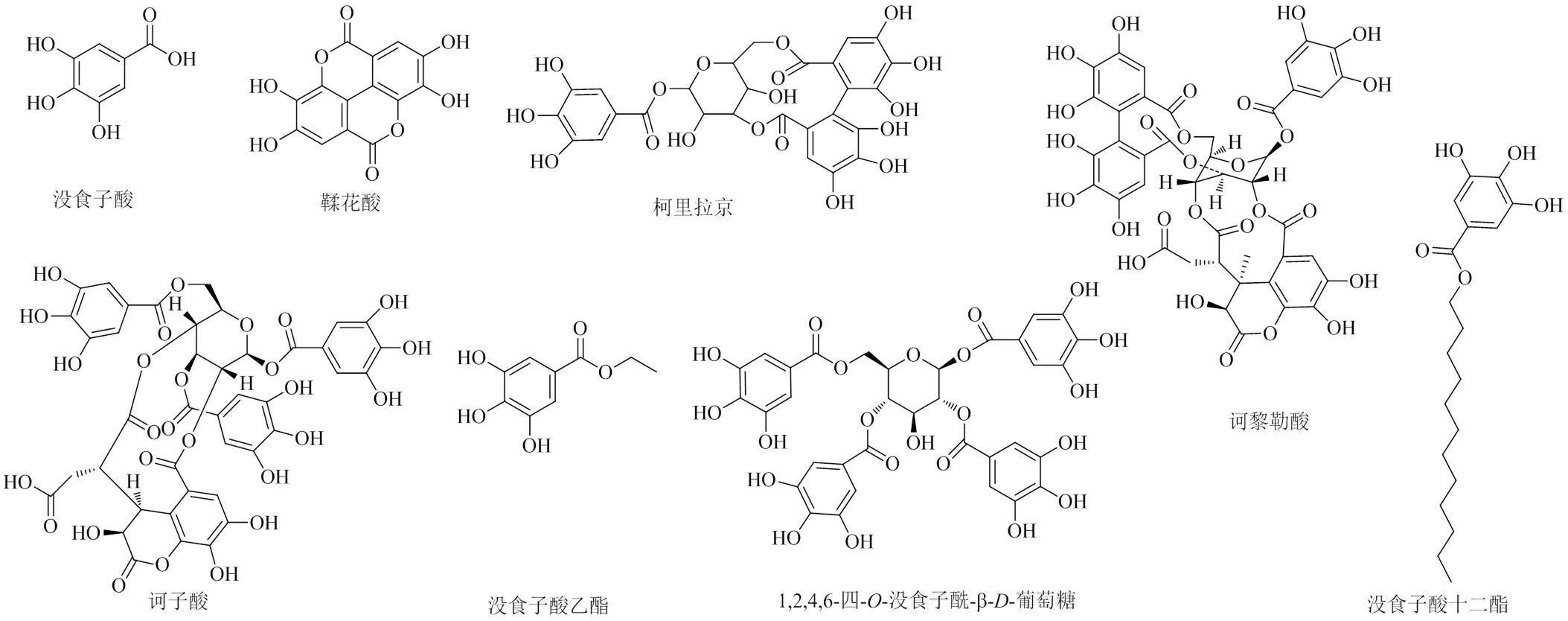
图1 余甘子中保肝单体成分的化学结构
2 对肝损伤的改善作用及机制
已有大量研究基于多种诱因导致的肝损伤体内外生物学模型探讨余甘子提取物及所含单体成分的保肝作用及机制。
2.1 余甘子提取物
余甘子水、醇提取物及多酚部位可对乙醇诱导的体内、外肝损伤生物学模型具有改善作用,其机制可能与调节乙醇代谢酶活性、调控脂质代谢、抗氧化、抗炎或抗凋亡等有关[11-14]。余甘子对抗结核药物(异烟肼、利福平和吡嗪酰胺)和对乙酰氨基酚(acetaminophen,APAP)引起的药源性肝损伤亦具有显著改善作用,如其水提醇沉物可通过调控核因子E2相关因子2(nuclear factor NF-E2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号通路,诱导下游靶基因、、的表达,降低活性氧(reactive oxygen species,ROS)水平,进而改善APAP引发的肝细胞损伤[15-17]。在环磷酰胺[18]、硫代乙酰胺(thioacetamide,TAA)[19]、-半乳糖胺(-galactosamine,-Gal-N)[20]、六氯环己烷(hexachlorocyclohexane,HCH)[21]、四氯化碳(carbon tetrachloride,CCl4)[22-24]等化学毒物诱导的肝损伤动物模型中,余甘子可升高体内超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、还原型谷胱甘肽(reduced glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)水平,降低丙二醛(malonaldehyde,MDA)水平[18-24],提示余甘子的抗氧化作用是发挥保肝的主要机制之一。除此之外,在铁[25]、砷[26]、镉[27]、赭曲霉毒素[28]等造成的重金属或毒物性肝损伤模型中,余甘子也可以降低动物血清中丙氨酸氨基转移酶(alanine aminotransferase,ALT)及天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)含量,从而减少肝细胞受损,改善肝功能,其机制亦主要与调节氧化应激平衡有关。
2.2 余甘子单体成分
2.2.1 没食子酸 没食子酸是余甘子质量控制的重要指标性成分,具有抗菌、抗炎、抗氧化及抗癌等广泛的生物活性。研究表明,没食子酸可通过清除自由基、抑制MDA水平、激活抗氧化酶和下调促炎标志物、增加肝再生基因的表达来改善CCl4诱导的肝损伤[29-30]。此外,没食子酸也被证实对阿霉素[31]、APAP[32]、过氧化叔丁醇[33]、亚砷酸钠[34]、甲氨蝶呤[35]、氟西汀[36]、乙醇[37]等因素诱导的肝损伤具有改善作用。在过氧化叔丁醇诱导的肝L02细胞模型中,没食子酸通过干扰Kelch样环氧氯丙烷相关蛋白1(kelch-like ECH-associated protein 1,Keap1)和Nrf2之间的蛋白-蛋白相互作用,诱导细胞外信号调节激酶(extracellular-signal-regulated kinases,ERK)/Nrf2介导的抗氧化信号通路来减轻肝细胞损伤[33]。没食子酸还可改善亚砷酸钠引起的大鼠肝损伤,其机制可能与清除自由基和增加细胞内抗氧化能力有关[34]。
2.2.2 鞣花酸 鞣花酸是一种天然多酚,存在于多种植物药材中,在余甘子中质量分数为1.00%~3.81%[38],其对于酒精[39]、化学毒物[40]、重金属[41-42]和药物[43]等造成的肝损伤以及免疫性肝损伤[44]均有显著的改善作用。鞣花酸可通过抑制核因子-κB(nuclear factor-κB,NF-κB)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)通路,调节Nrf2和半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)-3通路,改善CCl4诱导的肝损伤[40]。对于右旋糖酐铁诱导的小鼠肝损伤,鞣花酸可以清除自由基、抑制过量ROS的产生以及上调Caspase-3和多聚ADP核糖聚合酶(poly ADP-ribose polymerase,PARP)的表达,显示其对铁过负荷诱导的肝损伤有保护功能[42]。在刀豆球蛋白A诱导的小鼠免疫性肝损伤中,鞣花酸可通过Toll样受体(toll-like receptor,TLR)和丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)/NF-κB信号通路改善T细胞介导的肝炎[44]。
2.2.3 柯里拉京 柯里拉京是一种在余甘子中含量较高的水溶性鞣质,具有较强的抗炎、抗氧化、保肝和抗肿瘤等药理活性[45]。据报道,在被敲除Nrf2的肝HepG2细胞模型中,柯里拉京被证实可通过增强腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)/糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3β)-Nrf2信号通路减轻APAP导致的肝细胞损伤;柯里拉京可通过调控AMPK/GSK3β-Nrf2信号通路缓解被敲除Nrf2的小鼠急性肝功能衰竭[46]。对于α-异硫氰酸萘酯诱导的胆汁淤积型肝损伤,柯里拉京可升高SOD,降低MDA水平,减少NF-κB p65的表达[47]。此外,从余甘子中分离的没食子酸十二酯也被证明能减轻CCl4诱导的急性肝损伤和慢性肝纤维化程度[30]。余甘子提取物及单体成分对肝损伤的保护作用及机制见表1。
上述研究表明升高机体抗氧化酶活性或水平,减少氧化应激缓解肝脏炎症反应可能是其对不同诱因导致肝损伤发挥保护作用的重要共性机制之一,一定程度上体现了余甘子中多成分协同保肝的功能特点。然而,余甘子中除酚酸类的其他类型成分是否亦有抗肝损伤作用仍需进一步深入挖掘。
表1 余甘子提取物及单体成分对肝损伤的保护作用及机制
Table 1 Protective effects and mechanisms of extracts and monomer components of P. emblica on liver injury
余甘子提取物及单体成分诱导因素动物模型/细胞系主要结果文献 余甘子精粉(主要成分为多酚)乙醇小鼠ALT↓,AST↓,TG↓,ADH↑,CAT↑,CYP2E1 mRNA↓,FAS↓,ADRP↓,TNF-α↓,IL-6↓,Caspase-3↓,PPARα↑11 余甘子水提取物乙醇Wistar大鼠ALT↓,AST↓,ALP↓,MDA↓,线粒体蛋白羰基↓,NO↓,γ-GT↓,SOD↑,GSH-Px↑,GSH↑,SDH↑,细胞色素C氧化酶↑,NADH↑,细胞色素↑12 赭曲霉毒素Swiss小鼠DNA↑,RNA↑,总蛋白↑28 余甘子50%乙醇提取物乙醇大鼠原代肝细胞、Wistar大鼠ALT↓,AST↓,血清TG↓,肝组织TG↓,TNF-α↓,IL-1β↓13 抗结核药Wistar大鼠ALT↓,AST↓,ALP↓,GSH↑,GSH-Px↑,LPO↓,CYP2E1↓16 余甘子多酚乙醇肝BRL-3A细胞株细胞存活率↑,MDA↓,SOD↑,ALT↓,AST↓,GSH↑,Nrf2 mRNA↑,HO-1 mRNA↓,Nrf2↑,HO-1蛋白↓14
续表1
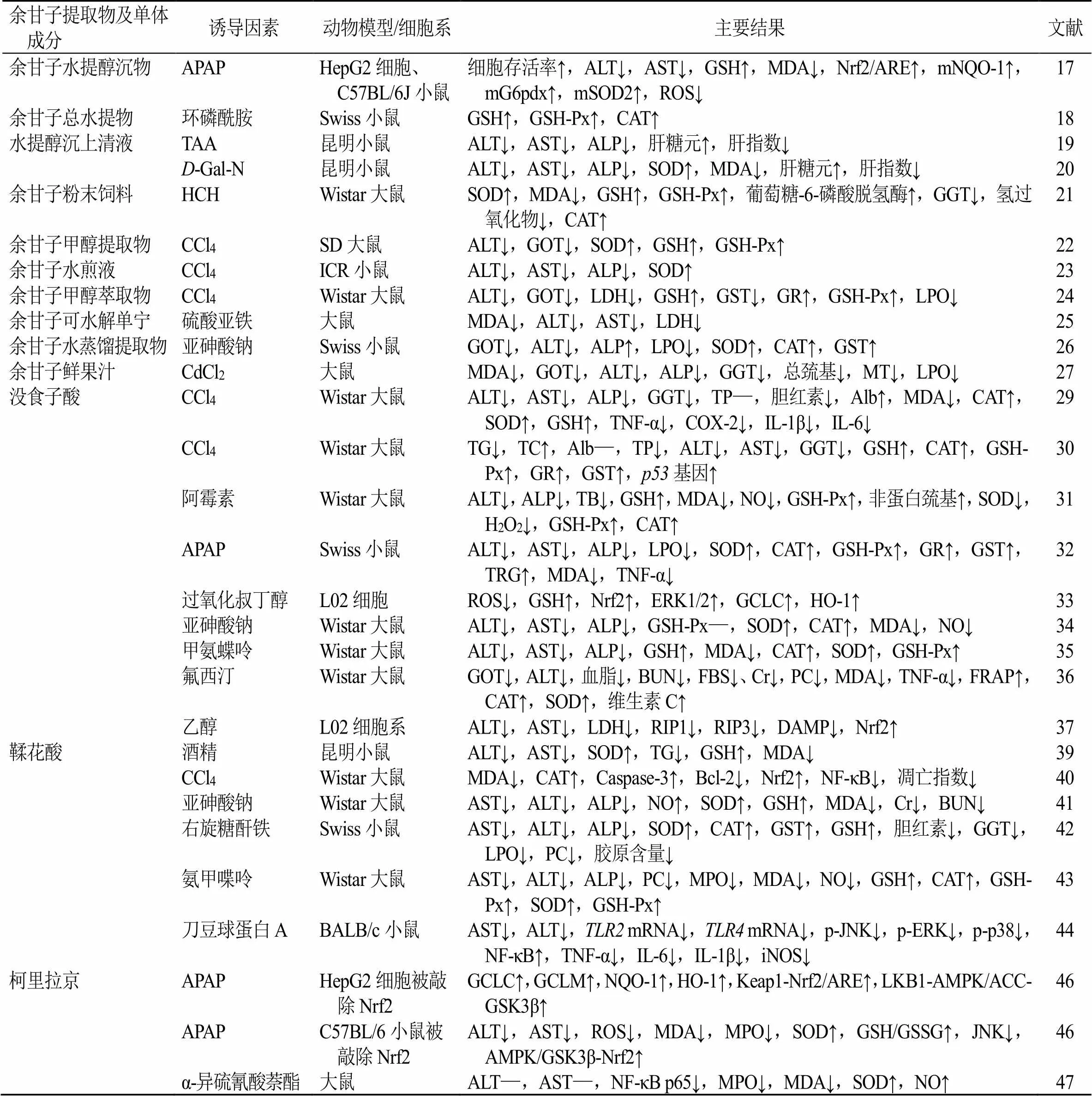
余甘子提取物及单体成分诱导因素动物模型/细胞系主要结果文献 余甘子水提醇沉物APAPHepG2细胞、C57BL/6J小鼠细胞存活率↑,ALT↓,AST↓,GSH↑,MDA↓,Nrf2/ARE↑,mNQO-1↑,mG6pdx↑,mSOD2↑,ROS↓17 余甘子总水提物环磷酰胺Swiss小鼠GSH↑,GSH-Px↑,CAT↑18 水提醇沉上清液TAA昆明小鼠ALT↓,AST↓,ALP↓,肝糖元↑,肝指数↓19 D-Gal-N昆明小鼠ALT↓,AST↓,ALP↓,SOD↑,MDA↓,肝糖元↑,肝指数↓20 余甘子粉末饲料HCHWistar大鼠SOD↑,MDA↓,GSH↑,GSH-Px↑,葡萄糖-6-磷酸脱氢酶↑,GGT↓,氢过氧化物↓,CAT↑21 余甘子甲醇提取物CCl4SD大鼠ALT↓,GOT↓,SOD↑,GSH↑,GSH-Px↑22 余甘子水煎液CCl4ICR小鼠ALT↓,AST↓,ALP↓,SOD↑23 余甘子甲醇萃取物CCl4Wistar大鼠ALT↓,GOT↓,LDH↓,GSH↑,GST↓,GR↑,GSH-Px↑,LPO↓24 余甘子可水解单宁硫酸亚铁大鼠MDA↓,ALT↓,AST↓,LDH↓25 余甘子水蒸馏提取物亚砷酸钠Swiss小鼠GOT↓,ALT↓,ALP↑,LPO↓,SOD↑,CAT↑,GST↑26 余甘子鲜果汁CdCl2大鼠MDA↓,GOT↓,ALT↓,ALP↓,GGT↓,总巯基↓,MT↓,LPO↓27 没食子酸CCl4Wistar大鼠ALT↓,AST↓,ALP↓,GGT↓,TP—,胆红素↓,Alb↑,MDA↓,CAT↑,SOD↑,GSH↑,TNF-α↓,COX-2↓,IL-1β↓,IL-6↓29 CCl4Wistar大鼠TG↓,TC↑,Alb—,TP↓,ALT↓,AST↓,GGT↓,GSH↑,CAT↑,GSH-Px↑,GR↑,GST↑,p53基因↑30 阿霉素Wistar大鼠ALT↓,ALP↓,TB↓,GSH↑,MDA↓,NO↓,GSH-Px↑,非蛋白巯基↑,SOD↓,H2O2↓,GSH-Px↑,CAT↑31 APAPSwiss小鼠ALT↓,AST↓,ALP↓,LPO↓,SOD↑,CAT↑,GSH-Px↑,GR↑,GST↑,TRG↑,MDA↓,TNF-α↓32 过氧化叔丁醇L02细胞ROS↓,GSH↑,Nrf2↑,ERK1/2↑,GCLC↑,HO-1↑33 亚砷酸钠Wistar大鼠ALT↓,AST↓,ALP↓,GSH-Px—,SOD↑,CAT↑,MDA↓,NO↓34 甲氨蝶呤Wistar大鼠ALT↓,AST↓,ALP↓,GSH↑,MDA↓,CAT↑,SOD↑,GSH-Px↑35 氟西汀Wistar大鼠GOT↓,ALT↓,血脂↓,BUN↓,FBS↓、Cr↓,PC↓,MDA↓,TNF-α↓,FRAP↑,CAT↑,SOD↑,维生素C↑36 乙醇L02细胞系ALT↓,AST↓,LDH↓,RIP1↓,RIP3↓,DAMP↓,Nrf2↑37 鞣花酸酒精昆明小鼠ALT↓,AST↓,SOD↑,TG↓,GSH↑,MDA↓39 CCl4Wistar大鼠MDA↓,CAT↑,Caspase-3↑,Bcl-2↓,Nrf2↑,NF-κB↓,凋亡指数↓40 亚砷酸钠Wistar大鼠AST↓,ALT↓,ALP↓,NO↑,SOD↑,GSH↑,MDA↓,Cr↓,BUN↓41 右旋糖酐铁Swiss小鼠AST↓,ALT↓,ALP↓,SOD↑,CAT↑,GST↑,GSH↑,胆红素↓,GGT↓,LPO↓,PC↓,胶原含量↓42 氨甲喋呤Wistar大鼠AST↓,ALT↓,ALP↓,PC↓,MPO↓,MDA↓,NO↓,GSH↑,CAT↑,GSH-Px↑,SOD↑,GSH-Px↑43 刀豆球蛋白ABALB/c小鼠AST↓,ALT↓,TLR2 mRNA↓,TLR4 mRNA↓,p-JNK↓,p-ERK↓,p-p38↓,NF-κB↑,TNF-α↓,IL-6↓,IL-1β↓,iNOS↓44 柯里拉京APAPHepG2细胞被敲除Nrf2GCLC↑,GCLM↑,NQO-1↑,HO-1↑,Keap1-Nrf2/ARE↑,LKB1-AMPK/ACC-GSK3β↑46 APAPC57BL/6小鼠被敲除Nrf2ALT↓,AST↓,ROS↓,MDA↓,MPO↓,SOD↑,GSH/GSSG↑,JNK↓,AMPK/GSK3β-Nrf2↑46 α-异硫氰酸萘酯大鼠ALT—,AST—,NF-κB p65↓,MPO↓,MDA↓,SOD↑,NO↑47
“↑”表示上升,“↓”表示下降,“—”表示无显著变化,下表同 TG-三酰甘油 ADH-乙醇脱氢酶 CYP2E1-细胞色素P450 2E1 FAS-脂肪酸合成酶 ADRP-脂肪分化相关蛋白 TNF-α-肿瘤坏死因子-α IL-6-白细胞介素-6 PPARα-过氧化酶体增殖激活受体α ALP-碱性磷酸酶 γ-GT-γ-谷酰基转移酶 SDH-琥珀酸脱氢酶 NADH-烟酰胺腺嘌呤二核苷酸 HO-1-血红素加氧酶-1 LPO-脂质过氧化物 GGT-谷酰转肽酶 GOT-谷氨酸转移酶 LDH-乳酸脱氢酶 GST-谷胱甘肽--转移酶 GR-谷胱甘肽还原酶 COX-2-环氧合酶-2 TC-总胆固醇 Alb-白蛋白 MT-金属硫蛋白 TB-胆红素 TRG-总谷光甘肽 GCLC-谷氨酸半胱氨酸连接酶催化修饰亚基 NO-一氧化氮 Cr-肌酐 BUN-血尿素氮 FBS-空腹血糖 PC-蛋白羰基 FRAP-血浆铁还原能力 RIP1-受体相互作用蛋白1 DAMP-损伤相关分子模式 MPO-髓过氧化物酶 iNOS-诱导型一氧化氮合酶 GCLC-谷氨酸半胱氨酸连接催化酶 GCLM-谷氨酸半胱氨酸连接修饰酶 LKB1-肝激酶B1 ACC-乙酰辅酶A羧化酶
“↑” means rising, “↓” means falling, “—” means no significant change, same as the below tables TG-triglyceride ADH-alcohol dehydrogenase CYP2E1-cytochrome P450 2E1 FAS-fatty acid synthetase ADRP-adipose differentiation related proteins TNF-α-tumor necrosis factor-α IL-6-interleukin-6 PPARα-peroxidase body proliferation activates alpha receptors ALP-alkaline phosphatase γ-GT-γ-glutamyl transferase SDH-succinodehydrogenase NADH-nicotinamide adenine dinucleotide hydrate HO-1-heme oxygenase-1 LPO-lipid peroxidation GGT-gamma glutamyl transpeptidase GOT-glutamate-oxalate-transaminase LDH-lactin dehydrogenase GST-glutathione--transferase GR-glutathione reductase COX-2-cyclooxygenase-2 TC-totalcholesterol Alb-albumin MT-metallothionein TB-total bilirubin TRG-total glutathione GCLC-glutamate cysteine ligase catalytic modify subunit NO-nitric oxide Cr-creatinine BUN-blood urea nitrogen FBS-fasting blood sugar PC-protein carbonyl FRAP-ferric reducing ability of plasma RIP1-receptor-interacting protein 1 DAMP-damage-associated molecular patterns MPO-myeloperoxidase iNOS-inducible nitric oxide synthase GCLC-glutamate-cysteine ligase catalytic GCLM-glutamate-cysteine ligase modifier LKB1-liver kinase B1 ACC-acetyl-CoA carboxylase
3 抗病毒性肝炎作用及机制
现代临床表明余甘子对乙型肝炎有治疗作用,实验研究也证明其有抗乙型肝炎病毒(hepatitis B virus,HBV)活性。惠安县医院收集30例乙型肝炎患者,经余甘冲剂治疗可显著改善肝功能,临床总有效率达89.9%[48]。在实验研究方面,有学者对28种藏药提取物进行抗HBV活性筛选,结果显示仅余甘子提取物对肝HepG2.215细胞的乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)和e抗原(HBeAg)表达具有抑制作用[49]。一项余甘子抗HBV活性成分筛选研究结果表明,从余甘子中分离得到的双没食子酸、elaeocarpusin、1,6-二-没食子酰基-β--葡萄糖和没食子酸具有显著的抗HBV活性[50]。Lv等[51]从余甘子中分离出8个新的倍半萜苷类化合物和3个已知化合物,并对其抗HBV活性进行评价,结果表明phyllaemblic G6对HBsAg和HBeAg的分泌有抑制作用。
另外,有研究采用表达丙型肝炎病毒(hepatitis C virus,HCV)非结构蛋白的HCV复制子亚基因组细胞培养系统探究没食子酸对HCV表达的影响,结果发现没食子酸较强的抗氧化能力可能抑制了肝癌细胞中HCV的复制[52]。鞣花酸也可抑制HBV诱导的病毒复制的转录激活,有效降低HBeAg的产生及其在血清中的积累,阻断HBeAg对免疫耐受的抑制作用,恢复B细胞产生抗HBeAg免疫球蛋白,维持T细胞的活化和增殖,增强淋巴细胞的产生[53];鞣花酸在体外可抑制非结构蛋白3/4A(non-structural protein 3/4A,NS3/4A)蛋白酶活性,并通过这种方式抑制NS4B/5A和NS5A/5B连接的蛋白水解过程,从而降低NS5B活性和HCV RNA水平[53]。在HCV复制子携带肝癌细胞系和基因嵌合小鼠模型中,柯里拉京通过抑制关键酶NS3蛋白酶和NS5B RNA依赖的RNA聚合酶,调控转化生长因子-β(transforming growth factor-β,TGF-β)/Smad通路抑制HCV复制[54]。此外,还有研究者从余甘子中提取得到其他单体成分,如没食子酸乙酯和1,2,4,6-四--没食子酰-β--葡萄糖,能抑制HepG2.2.15细胞表达HBsAg和HBeAg,表明其具有抗HBV活性[49-55]。
目前,余甘子抗病毒性肝炎的研究主要集中于乙型肝炎和丙型肝炎,而对其他类型病毒性肝炎的相关研究鲜见报道。此外,余甘子的抗HCV研究仅停留在体外细胞实验水平,考虑到相关成分的体内代谢过程,其体内药效及作用机制仍需确认和进一步阐明。
4 抗非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)的作用及机制
NAFLD是目前发生率超过病毒性肝炎的一种临床常见肝脏疾病[56]。余甘子及多种主要活性成分对NAFLD具有显著改善作用。
4.1 余甘子提取物
Lu等[57]采用游离脂肪酸混合物刺激下的HepG2细胞为研究载体,观察到余甘子水提物可降低其脂肪累积和减少ROS,推测其机制可能与调控脂肪生成相关基因表达及激活AMPK信号通路有关。基于余甘子调脂、抗炎、抗氧化的作用,朱炜等[58]探究其对高脂饮食诱导的NAFLD大鼠的改善作用,发现其水提物可降低大鼠ALT、AST活性的升高,改善肝脏损伤和减少炎症的发生。在采用幼鼠NAFLD模型进行余甘子乙醇提取物的药效评价研究中,发现其可降低肝组织中胆固醇(cholesterol,CHO)、低密度脂蛋白(low density lipoprotein,LDL)含量从而减轻肝脂肪病变[59]。在高脂饮食[60]和蛋氨酸-胆碱缺乏饲料(methionine-choline deficiency,MCD)[61]诱导的NAFLD模型中,余甘子水提物通过减少脂肪变性,降低ALT和AST活性来减慢NAFLD的快速发展,其可能通过抑制促炎因子表达、上调抗氧化酶、抑制脂质过氧化和肝脏特异性酶、降低脂肪生成基因固醇调节元件结合蛋白(sterol regulatory element binding proteins-1c,SREBP-1c)的表达等阻止NAFLD的恶化[59-60]。
4.2 余甘子单体成分
没食子酸对NAFLD的调节作用也被相关实验研究证实,其可通过激活HepG2细胞中的AMPK来减弱棕榈酸诱导的脂肪积累,抑制凋亡相关基因的表达和Caspase-3/7活性。在含脂的肝癌Hepa 1-6细胞和RAW264.7细胞的共同培养中,没食子酸可显著降低炎症介质水平,并诱导抗氧化酶的表达[62]。没食子酸能改善高脂饮食、粉尘等导致的NAFLD模型动物的血清肝功能生化指标异常,这可能与其抗氧化以及调节脂质代谢作用相关[63-65]。鞣花酸可通过抑制TNF-α、IL-6等炎症因子的表达,提高抗氧化能力来改善蛋白激酶B(protein kinase B,)质粒导入FVB小鼠中导致的NAFLD[66]。有研究者通过肝AML12细胞和动物的生物学模型探究了柯里拉京对NAFLD的作用,发现其可通过减轻氧化应激,降低自噬通量来改善NAFLD[67]。余甘子提取物及单体成分对NAFLD的保护作用及机制见表2。
上述研究表明余甘子提取物及单体成分抗NAFLD的机制主要与调控脂肪生成基因、降低脂肪积聚、改善氧化应激及降低炎性反应等相关。且已有研究广泛地证实了余甘子水提物抗NAFLD的体内有效性,鉴于水提物中除酚酸类成分外存在多糖等含量较高的大分子类物质,该类成分是否也具有抗NAFLD作用仍需进一步深入探索。
表2 余甘子提取物及单体成分对NAFLD的保护作用及机制
Table 2 Protective effects and mechanisms of extracts and monomer components of P. emblica on NAFLD
余甘子提取物及单体成分诱导因素动物模型/细胞系主要结果文献 余甘子水提物游离脂肪酸混合物HepG2细胞ROS↓,PPARα↓,CPT-1↓,ACC↓,FAS↓,AMPK↑57 高脂饮食SD大鼠ALT↓,AST↓,TNF-α↓,IL-1β↓,COX-2↓58 高脂饮食SD大鼠ALT↓,AST↓,GLU↓,TG—,CHOL↓,LDL↓,HDL↓,Cr—,UA—,CAT↑,GSH-Px↑,GR↑,GST↑,SREBP-1c↓60 MCDC57BL/6小鼠ALT↓,AST↓,CHOL↓,TG↑,SOD↑,CAT↑,GSH-Px↑,GR↑,GST↑,CYP2E1↓,TNF-α↓,IL-1β↓61 余甘子70%乙醇回流提取物高脂饮食SD幼鼠ALT↓,AST↓,GLU↓,TG—,CHO↓,LDL↓,INS↓,HOMA-IR↓59 没食子酸棕榈酸小鼠HepG2细胞、Hepa 1-6小鼠巨噬细胞RAW264.7脂质沉积↓,CD36↓,SLC27A2↓,ACACA↓,SREBP-1c↓,LXR α↓,AMPK↓,p-AMPK/AMPK↑,Bax/Bcl-2↓,ATF3mRNA↓,Caspase-3/7↑,TNF-α↓,IL-1β↓,HO-1↑,MCP-1↑,iNOS↓,CAT↑62 高脂饮食C57BL/6小鼠HDL↓,TCHO↓,INS↓,葡萄糖↓,TG↓,ALT↓,AST↓63 HPDSwiss小鼠ACC↓,AST—,ALT—,FAS↑,TG—,TC↓,INS↑,SREBP-1↓64 粉尘Wistar大鼠LDL—,TG↓,TC—,MDA↓,NF-κB↓,TNF-α↓,IL-6↓,HO1↓,HDL—65 鞣花酸Akt质粒FVB小鼠AST↓,ALT↓,MDA↓,SOD↑,NF-κB↓,TNF-α↓,IL-6↓,COX-2↓66 柯里拉京高脂饮食AML12细胞、C57BL/6小鼠FASN↓,ACC1↓,SREBP-1c↓,PPARα↑,CPT-1α↓,ACOX1↑,MCP-1↓,F4/80↓,TNF-α↓,IL-6↓,TG↓,TC↓,LDL↓,LDH↓,CAT↑,GSH-Px↑,SOD↑,MDA↓,ROS↑67
CPT-1-肉碱棕榈酰转移酶-1 CHOL-胆固醇 UA-尿酸 LXR α-肝X受体α MCP-1-单核细胞趋化蛋白-1 HOMA-IR-稳态模型胰岛素抵抗指数 TCHO-总胆固醇 ACACA-乙酰辅酶A羧化酶 Bax-细胞凋亡促进基因 IR-胰岛素抵抗 GLU-血糖 INS-胰岛素 HDL-高密度脂蛋白 FASN-脂肪酸合酶 ACOX1-过氧化物酶酰基辅酶A氧化酶1
CPT-1-carnitine palmitoyl transferase-1 CHOL-cholesterol UA-uric acid LXR α-liver X receptor-alpha MCP-1-monocyte chemoattractant protein-1 HOMA-IR-homeostasis model assessment-insulin resistance TCHO-total cholesterol ACACA-acetyl-CoA carboxylase Bax-Bcl-2-associated X IR-insulin resistance GLU-blood glucose INS-insulin HDL-high density lipoprotein FASN-fatty acid synthase ACOX1-peroxidase acyl-coA oxidase 1
5 抗肝纤维化作用及机制
5.1 余甘子提取物
肝纤维化是慢性肝病向肝硬化及肝癌等终末期肝病转变的重要病理过程,其中肝星状细胞(hepatic stellate cell,HSC)的激活是肝纤维化发生的核心环节。Lu等[57]借助瘦素刺激下的HSC活化模型,发现余甘子水提物能减少其α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)及I型胶原表达,并促进HSC凋亡。Mir等[68]使用CCl4和TAA联合诱导大鼠肝纤维化,结果显示余甘子可逆转肝脏纤维化病理改变。在CCl4诱导的小鼠肝纤维化模型中,同样证实余甘子乙醇提取物能减少胶原纤维的形成[69]。李萍等[70]制备得到余甘子水提醇沉上清液,发现其能降低CCl4诱导肝纤维化小鼠的ALT和AST活性,升高Alb及白蛋白/球蛋白值,降低羟脯氨酸(hydroxyproline,Hyp)含量,并认为与其抗脂质过氧化相关。在猪血清诱导的大鼠肝纤维化模型中,余甘子提取物也可抑制其TGF-β表达,降低Hyp含量,并升高SOD活性,提示其保护作用可能与减少氧自由基及炎症因子释放、抑制HSC活化等有关[71-72]。此外,余甘子还能通过较强的铁螯合能力显著减少右旋糖酐铁诱导的小鼠肝组织PC和Hyp的生成[73]。
5.2 余甘子单体成分
没食子酸在体内外生物学模型中均被证实能减轻肝纤维化进程。对大鼠原代HSC于不同时间给予不同剂量的没食子酸干预,结果发现没食子酸以剂量和时间相关性地方式选择性地抑制HSC激活,而对正常肝细胞无显著影响[74]。Wang等[75]在CCl4小鼠纤维化实验中,得出没食子酸可抑制HSC活化,降低基质金属蛋白酶的表达以此降低纤维化等级。有学者采用二甲基亚硝胺(dimethylnitrosamine,DMNA)诱导肝纤维化模型评价没食子酸的体内药效作用,结果表明其能通过TGF-β/Smad通路来改善纤维化进程[76]。没食子酸还可下调肝组织中miR-21的表达,上调miR-30和miR-200的表达,抑制TGF-β1/Smad3信号来减轻TAA诱导大鼠肝纤维化[77]。
此外,在双氯芬酸钠诱导大鼠慢性肝病的肝组织病理切片中观察到鞣花酸可以改善纤维延伸,减少大纤维间隔形成及纤维堆积[78]。鞣花酸还可通过抗氧化能力维持HSC静止状态,降低胶质纤维酸性蛋白和α-SMA的表达[79]。在血吸虫病诱导的肝纤维化小鼠中,柯里拉京可通过干扰miR-21/ Smad7/ERK信号通路抑制纤维化进程[45],另有研究证实其也可通过调节IL-13/信号转导和转录激活因子6(signal transducer and activator of transcription 6,STAT6)信号通路,直接影响IL-13介导的肝纤维化信号通路[80]。诃子酸和诃黎勒酸在余甘子中含量也较高,研究发现其能通过抑制Smad信号通路来增加对HSC-T6细胞的毒性从而减少增殖,具有抗肝纤维化的潜在作用[81-83]。余甘子提取物及单体成分的抗肝纤维化作用及机制见表3。
表3 余甘子提取物及单体成分的抗肝纤维化作用及机制
Table 3 Anti-liver fibrosis effects and mechanisms of extracts and monomer components of P. emblica
余甘子提取物及单体成分诱导因素动物模型/细胞系主要结果文献 余甘子水提物瘦素HSC-T6细胞α-SMA↓,I型胶原↓,MMP-9↓,MMP-2↓,Caspase-3/-9↑,Bax/Bcl-2↑57 余甘子70%乙醇提取物CCl4昆明小鼠HA↓,PIIINP↓,LN↓,MDA↓,Hyp↓,SOD↑69 猪血清SD大鼠ALT↓,AST↓,GLO↓,TP↓,Alb↑,HA↓,PIIINP↓,LN↓, MDA↓,Hyp↓,TNF-α↓,TGF-β↓,SOD↑71-72 余甘子水提醇沉上清液CCl4昆明小鼠ALT↓,AST↓,Alb↑,A/G↑,Hyp↓70 余甘子70%甲醇提取物右旋糖酐铁Swiss小鼠AST↓,ALT↓,SOD↑,GSH↑,CAT↑,ALP↓,GST↑,Hyp↓,PC↓73 没食子酸 大鼠原代HSCsHSCs↓,CAL↑,caspase↑,ROS↑,Ca2+↓74 CCl4BALB/c小鼠纤维化等级↓,HA↓,cIV↓,ALT↓,AST↓,γ-GT↓,MMP-2↓,TIMP-1↓75 DMNASD大鼠ALT↓,AST↓,ALP↓,TB↓,SOD↑,CAT↑,GSH↑,MDA↓,TGF-β1↓,EGF↓,Hyp↓,α-SMA↓,PDGFR↓,TIMP-1↓,TIMP-2↓,I型胶原↓,p-Smad2↓,p-Smad3↓,76 TAAWistar大鼠ALT↓,AST↓,ALP↓,SOD↑,CAT↑,GSH↑,MDA↓,TGF-β1↓,p-Smad3↓,总Smad3↓,CAT↑,miR-30↓,miR-200↑,miR-21↓,TGF-β1/Smad 3↓77 鞣花酸双氯芬酸钠Wistar大鼠AST↓,ALT↓,ALP↓,Cr↓,总蛋白↓,尿酸↓,SOD↑,CAT↑78 HSCsGFAP↓,α-SMA↓79 柯里拉京吸血虫Balb/c小鼠IL-13↓,吸血虫抗原↓,miR-21 mRNA↓,Smad7 mRNA↑,p-Smad 1↓,p-Smad2↓,p-Erk1/2↓,Erk1/2↓,TGF-β1↓,CTGF↓45 吸血虫Balb/c小鼠IL-13α1↓,IL-4α↓,SOCS1↓,KLF4↓,PPARγ↓,PPARδ↓,Phospho-STAT6↓80
MMP-9-基质金属蛋白酶-9 HA-透明质酸 PIIINP-III型前胶原氨基端肽 LN-层黏连蛋白 TP-总蛋白 GLO-球蛋白 TIMP-基质金属蛋白酶抑制剂 cIV-IV胶原 EGF-表皮生长因子 PDGFR-血小板衍生生长因子受体 GFAP-胶质纤维酸性蛋白 SOCS1-细胞因子信号抑制物1 KLF4-Krüppel样因子4
MMP-9-matrixmetalloproteinase-9 HA-hyaluronic acid PIIINP-amino-terminal propeptide of type III procollagen LN-laminin TP-total protein GLO-globulin TIMP-matrix metallo-proteinase inhibitor cIV-type IV collagen EGF-epidermal growth factor PDGFR-platelet-derived growth factor receptor GFAP-glial fibrillary acidic protein SOCS1-suppressor of cytokine signaling 1 KLF4-Krüppel-like factor 4
综上所述,多数研究证实余甘子水提醇沉上清液及70%醇提物具有减轻肝纤维化的作用,主要机制涉及抑制HSC活化及减轻胶原沉积等。然而,相关研究大多停留在药效评价层面,缺乏深入的分子机制探讨。没食子酸、鞣花酸及柯里拉京等可通过多种信号通路途径抑制HSC增殖、降低炎症从而减轻肝纤维化,这为余甘子抗肝纤维化的整合作用机制阐释提供了有益启示和研究方向。
6 抗肝癌的作用及机制
6.1 余甘子提取物
肝细胞癌是世界范围内常见的恶性肿瘤,动物实验研究表明余甘子可有效防止化学性物质诱导肝癌的发生。有学者观察到余甘子可以降低二乙基亚硝胺(diethylnitrosamine,NDEA)诱导的大鼠肝肿瘤,并通过降低血清GGT、ALP、ALT和TB水平介导余甘子的抗肝癌作用[84]。在NDEA诱导大鼠肝细胞瘤中,余甘子显著降低大鼠血清ALP、ALT、TB、GST和GSH水平[85]。在另外的NDEA诱导肿瘤、2-乙酰氨基氟(2-acetylamino fluorine,2-AAF)促进肝癌的大鼠实验中,余甘子甲醇提取物预防治疗可显著抑制γ-GT病灶的出现、病理表现和肿瘤的形成,并抑制细胞增殖标志物的表达[86]。此外,采用余甘子预防性治疗可逆转TAA诱导的氧化应激和原发性肝癌的发生[87]。余甘子提取物也可诱导肝癌细胞株的凋亡[88-89],没食子酸乙酯通过上调Bax蛋白表达、下调Bcl-2蛋白表达诱导人肝细胞癌BEL-7404凋亡,这可能与G0/G1和G2/M周期阻滞有关[89]。
6.2 余甘子单体成分
没食子酸对肝癌的抑制作用也被报道。钟振国等[90]研究显示没食子酸5~80 mg/mL对肝癌BEL-7404细胞有不同程度的抑制作用,且测得其半数抑制浓度(median inhibitory concentration,IC50)值为24.61 μg/mL。在NDEA诱导大鼠体内肝癌模型中,没食子酸降低了肝功能生化指标和癌症标志物增殖细胞核抗原(proliferation cell nuclear antigen,PCNA)水平[91]。Aglan等[92]同样使用NDEA诱导大鼠肝癌发生,研究表明没食子酸能下调血清甲胎蛋白(serum alpha-fetoprotein,AFP)、磷脂酰肌醇蛋白聚糖-3(glypican-3,GPC-3)、STAT3、细胞因子信号通路3(cytokine signaling pathway 3,SOCS3)、肝脏和基因,并通过调节信号转导因子和STAT3信号通路来达到其抗氧化、抗炎、促凋亡和抗肿瘤效果。鞣花酸可通过减少肝细胞凋亡、抗血管生成和抗肝癌细胞增殖等活性来达到预防大鼠肝癌的作用[93]。在NDEA诱导的大鼠肝癌研究中,发现柯里拉京可通过线粒体凋亡途径和死亡受体途径显著促进肝癌细胞凋亡[94]。诃黎勒酸通过下调COX-2增强了HepG2细胞的凋亡,显示出潜在抗肝癌活性[82]。余甘子提取物及单体成分的抗肝癌作用及机制见表4。
表4 余甘子提取物及单体成分的抗肝癌作用及机制
Table 4 Anti-liver cancer effects and mechanisms of extracts and monomer components of P. emblica
余甘子提取物及单体成分诱导因素动物模型/细胞系主要结果文献 余甘子10%水提物NDEAWistar大鼠GST↓,GGT↓,ALP↓,ALT↓,TB↓,LPO↓,ALT↓84 余甘子多酚部位NDEADLA肿瘤细胞系、Wistar大鼠γ-GT↓,GSH↓,GST↓,ALP↓,ALT↓,LPO↓,TB↓85 余甘子石油醚提取,甲醇萃取物NDEA、2-AAFWistar大鼠GSH↑,GST↓,γ-GT↓86 TAAWistar大鼠GSH↑,MDA↓,SGOT↓,SALT↓,GGT↓,ST↓,GSH-Px↑,GR↓,G6PD↓87 余甘子醋酸乙酯部位 BEL-7404细胞株BEL-7404细胞↓,Bax↑,Bcl-2↓89 没食子酸NDEAWistar大鼠AST↓,ALT↓,ACP↓,ALP↓,LDH↓,GGT↑,AFP↓,CEA↓,AgNORs↓,PCNA↓,结合胆红素↓,TB↓,非结合胆红素↓91 NDEAWistar大鼠AFP↓,GPC-3↓,STAT3↓,SOCS3↓,肝GGT↓,HSPgp96基因↓92 鞣花酸NDEAWistar大鼠AFP↓,GPC-3↓,STAT3↓,SOCS3↑,VEGF↓93 柯里拉京 SMMC-7721、Bel-l7402、MHCC97-H细胞细胞增殖↓,p-Akt↓,Bcl-2↓,p53↑,Caspase-9↓,Caspase-3↓,PARP↓,Fas↑,FasL↑,Caspase-8↓94
G6PD-葡萄糖-6-磷酸脱氢酶 CEA-癌胚抗原 CAL-钙蛋白酶 VEGF-血管内皮生长因子 AgNORs-核仁组成区嗜银蛋白 FasL-Fas配体
G6PD-glucose 6-phosphate dehydrogenase CEA-carcinoembryonic antigen CAL-Calpai VEGF-vascular endothelial growth factor AgNORs- argyrophilicnucleolar organizer regions FasL-Fas ligand
由上述研究结果可知,余甘子对肝癌的治疗改善作用与其清除自由基、抗脂质过氧化、抑制肿瘤细胞增殖相关。
7 结语与展望
余甘子作为一种药食同源植物药,在印度医药、我国中医药及多个民族医药中具有广泛且悠久的应用历史。近几十年来,大量研究报道了余甘子的化学成分、药理作用及相关功能产品,进一步证实了其药用价值的有效性和多向性。其中,对肝脏的保护和修复作用是余甘子功能活性研究的重要热点之一。余甘子水提物和醇提物对肝损伤、NAFLD、病毒性肝炎、肝纤维化和肝癌等肝脏疾病均有较好的防治作用。从已报道的实验研究结果来看,余甘子中含量较高的单体成分如没食子酸、柯里拉京、鞣花酸等显示出与提取物相似的抗肝病作用,包括酒精、化学毒物、抗结核药、高脂饲料等诱导的肝脏疾病等,其共同作用机制主要包括抗氧化、抗炎、抗肝细胞凋亡、调节脂质代谢、抗肿瘤、维持HSC形态、减少细胞外基质沉降等。余甘子提取物及单体成分对不同肝病的作用机制有所不同,涉及到的信号通路也不同,主要包括Nrf2/HO-1、Nrf2/ARE、AMPK/NF-κB、TGF-β/Smad、IL-13/STAT6等,体现了余甘子多成分、多环节及多通路干预肝脏疾病的作用优势。通过对余甘子提取物及单体成分作用及机制的关联分析,一定程度上反映了酚酸类成分可能是余甘子抗肝病的主要活性组分(图2)。

图2 余甘子保肝活性成分与作用机制
目前对余甘子保肝作用研究取得了一定的进展,但多数仍以粗提取物和酚酸组分为研究对象,缺乏系统的药效物质筛选和评价。如余甘子中的多糖含量较高且具有显著的抗氧化等生物活性,而其是否有保肝活性却鲜见报道。因此,今后可从余甘子整体化学物质组出发,系统筛选其保肝活性组分或成分,并基于此进行组分提取和配伍优化,从而提高该药物资源的有效利用,并为相关功能产品的质量控制提供质量标志物参考。此外,关于余甘子及单体成分的保肝研究主要集中于药效评价层面,未来可结合代谢组学、蛋白质组学及转录组学等系统生物学手段探究其作用机制,以阐释其整合作用特点,为扩大余甘子抗肝病的临床应用提供参考,并为其相关药物及功能保健品的开发提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 仇敏, 黄浩洲, 林俊芝, 等. 基于专利视角的余甘子全产业链开发现状分析与评述[J]. 中草药, 2020, 51(12): 3355-3364.
[2] 杨崇仁, 张颖君, 王海涛, 等. 余甘子应用源流考 [J]. 亚太传统医药, 2021, 17(2): 197-200.
[3] Sriwatcharakul S. Evaluation of bioactivities ofseed [J]., 2020, 6: 442-447.
[4] Krishnaveni M, Mirunalini S. Therapeutic potential of(Amla): The ayurvedic wonder [J]., 2010, 21(1): 93-105.
[5] 罗维. 余甘子干果活性成分的分离鉴定与生理活性研究 [D]. 广州: 华南理工大学, 2010.
[6] 刘延泽, 李海霞, 许利嘉, 等. 药食兼用余甘子的现代研究概述及应用前景分析 [J]. 中草药, 2013, 44(12): 1700-1706.
[7] 中国药典 [S]. 一部. 2020: 186.
[8] 周涛, 邱德文. 民族药余甘子的本草学概况 [J]. 贵阳中医学院学报, 2002, 24(3): 3-5.
[9] 朱华伟, 李伟, 陈运娇, 等. 余甘子化学成分及其抗炎作用的研究进展 [J]. 中成药, 2018, 40(3): 670-674.
[10] 吴玲芳. 藏药余甘子鞣质部位体内成分分析 [D]. 北京: 北京中医药大学, 2014.
[11] 张志毕, 张媛, 于浩飞, 等. 余甘子提取物对小鼠急性酒精肝损伤的保护作用研究 [J]. 食品工业科技, 2017, 38(5): 350-356.
[12] Reddy V D, Padmavathi P, Varadacharyulu N.protects against alcohol-induced liver mitochondrial dysfunction in rats [J]., 2009, 12(2): 327-333.
[13] Pramyothin P, Samosorn P, Poungshompoo S,. The protective effects ofLinn. extract on ethanol induced rat hepatic injury [J]., 2006, 107(3): 361-364.
[14] 杨冰鑫. 余甘子多酚对酒精性肝损伤的保护作用研究 [D]. 广州: 广东工业大学, 2020.
[15] Panchabhai T S, Ambarkhane S V, Joshi A S,. Protective effect of,and their combination against antitubercular drugs induced hepatic damage: An experimental study [J]., 2008, 22(5): 646-650.
[16] Tasduq S A, Kaisar P, Gupta D K,. Protective effect of a 50% hydroalcoholic fruit extract ofagainst anti-tuberculosis drugs induced liver toxicity [J]., 2005, 19(3): 193-197.
[17] 姚亮亮, 张丁, 刘家琛, 等. 余甘子对对乙酰氨基酚(APAP)诱发的肝损伤的保护机制研究 [J]. 现代食品科技, 2019, 35(3): 7-14.
[18] Haque R, Bin-Hafeez B, Ahmad I,. Protective effects ofGaertn. in cyclophosphamide-treated mice [J]., 2001, 20(12): 643-650.
[19] 李萍, 谢金鲜, 林启云. 民族药余甘子对-半乳糖胺致小鼠急性肝损伤的影响 [J]. 中国民族民间医药杂志, 2003, 12(3): 161-164.
[20] 李萍, 谢金鲜, 林启云. 余甘子对-半乳糖胺致小鼠急性肝损伤的影响 [J]. 云南中医中药杂志, 2003, 24(1): 31-33.
[21] Anilakumar K R, Nagaraj N S, Santhanam K. Reduction of hexachlorocyclohexane-induced oxidative stress and cytotoxicity in rat liver byGaertn [J]., 2007, 45(5): 450-454.
[22] Lee C Y, Peng W H, Cheng H Y,. Hepatoprotective effect ofin Taiwan on acute liver damage induced by carbon tetrachloride [J]., 2006, 34(3): 471-482.
[23] 王锦菊, 王瑞国, 林久茂, 等. 余甘子对急性肝损伤的干预作用 [J]. 福建中医学院学报, 2006, 16(1): 42-43.
[24] Sultana S, Ahmad S, Khan N,. Effect of(Gaertn) on CCl4induced hepatic toxicity and DNA synthesis in Wistar rats [J]., 2005, 43(5): 430-436.
[25] Bhattacharya A, Kumar M, Ghosal S,. Effect of bioactive tannoid principles ofon iron-induced hepatic toxicity in rats [J]., 2000, 7(2): 173-175.
[26] Sharma A, Sharma M K, Kumar M. Modulatory role offruit extract against arsenic induced oxidative stress in Swiss albino mice [J]., 2009, 180(1): 20-30.
[27] Khandelwal S, Shukla L J, Shanker R. Modulation of acute cadmium toxicity byfruit in rat [J]., 2002, 40(5): 564-570.
[28] Verma R, Chakraborty D. Alterations in DNA, RNA and protein contents in liver and kidney of mice treated with ochratoxin and their amelioration byaqueous extract [J]., 2008, 65(1): 3-9.
[29] Ojeaburu S I, Oriakhi K. Hepatoprotective, antioxidant and, anti-inflammatory potentials of gallic acid in carbon tetrachloride-induced hepatic damage in Wistar rats [J]., 2021, 8: 177-185.
[30] Perazzoli M R, Perondi C K, Baratto C M,. Gallic acid and dodecyl gallate prevents carbon tetrachloride-induced acute and chronic hepatotoxicity by enhancing hepatic antioxidant status and increasing p53 expression [J]., 2017, 40(4): 425-434.
[31] Omobowale T O, Oyagbemi A A, Ajufo U E,. Ameliorative effect of gallic acid in doxorubicin-induced hepatotoxicity in Wistar rats through antioxidant defense system [J]., 2018, 15(2): 183-196.
[32] Rasool M K, Sabina E P, Ramya S R,. Hepatoprotective and antioxidant effects of gallic acid in paracetamol-induced liver damage in mice [J]., 2010, 62(5): 638-643.
[33] Feng R B, Wang Y, He C,. Gallic acid, a natural polyphenol, protects against tert-butyl hydroperoxide-induced hepatotoxicity by activating ERK-Nrf2-Keap1-mediated antioxidative response [J]., 2018, 119: 479-488.
[34] Gholamine B, Houshmand G, Hosseinzadeh A,. Gallic acid ameliorates sodium arsenite-induced renal and hepatic toxicity in rats [J]., 2021, 44(4): 341-352.
[35] Safaei F, Mehrzadi S, Khadem Haghighian H,. Protective effects of gallic acid against methotrexate-induced toxicity in rats [J]., 2018, 118(3): 152-160.
[36] Karimi-Khouzani O, Heidarian E, Amini S A. Anti-inflammatory and ameliorative effects of gallic acid on fluoxetine-induced oxidative stress and liver damage in rats [J]., 2017, 69(4): 830-835.
[37] Zhou Y, Jin H, Wu Y,. Gallic acid protects against ethanol-induced hepatocyte necroptosis via an NRF2-dependent mechanism [J]., 2019, 57: 226-232.
[38] 罗兰, 黄慧, 饶雪娥, 等. UPLC测定余甘子产地、采收时间和炮制对其质量关系影响 [J]. 海峡药学, 2020, 32(1): 30-34.
[39] 杨丽娜, 乔楠, 胡敏予, 等. 鞣花酸对小鼠酒精性肝损伤的保护作用 [J]. 吉林大学学报: 医学版, 2015, 41(5): 956-960.
[40] Aslan A, Gok O, Erman O,. Ellagic acid impedes carbontetrachloride-induced liver damage in rats through suppression of NF-κB, Bcl-2 and regulating Nrf-2 and caspase pathway [J]., 2018, 105: 662-669.
[41] Mehrzadi S, Fatemi I, Malayeri A R,. Ellagic acid mitigates sodium arsenite-induced renal and hepatic toxicity in male Wistar rats [J]., 2018, 70(4): 712-719.
[42] Shendge A K, Basu T, Panja S,. An ellagic acid isolated fromleaves ameliorates iron-overload induced hepatotoxicity in Swiss albino mice through inhibition of oxidative stress and the apoptotic pathway [J]., 2018, 106: 454-465.
[43] Mehrzadi S, Mehrabani M, Malayeri A R,. Ellagic acid as a potential antioxidant, alleviates methotrexate-induced hepatotoxicity in male rats [J]., 2019, 119(2): 69-77.
[44] Lee J H, Won J H, Choi J M,. Protective effect of ellagic acid on concanavalin A-induced hepatitis via toll-like receptor and mitogen-activated protein kinase/nuclear factor κB signaling pathways [J]., 2014, 62(41): 10110-10117.
[45] Yang F, Wang Y, Xue J,. Effect of corilagin on the miR-21/smad7/ERK signaling pathway in a schistosomiasis- induced hepatic fibrosis mouse model [J]., 2016, 65(4): 308-315.
[46] Lv H, Hong L H, Tian Y,. Corilagin alleviates acetaminophen-induced hepatotoxicity via enhancing the AMPK/GSK3β-Nrf2 signaling pathway [J]., 2019, 17(1): 2.
[47] Jin F, Cheng D, Tao J Y,. Anti-inflammatory and anti-oxidative effects of corilagin in a rat model of acute cholestasis [J]., 2013, 13: 79.
[48] 陈章荣. 余甘冲剂治疗乙型肝炎30例疗效观察 [J]. 福建中医药, 1985, 16(1): 32.
[49] 吉守祥, 鞠怀强, 向阳飞, 等. 余甘子等28种藏药提取物体外抗乙型肝炎病毒的实验研究 [J]. 中药材, 2011, 34(3): 438-440.
[50] 侯海燕. 中药余甘子抗HBV活性成分研究 [D]. 北京: 中国人民解放军军事医学科学院, 2006.
[51] Lv J J, Wang Y F, Zhang J M,. Anti-hepatitis B virus activities and absolute configurations of sesquiterpenoid glycosides from[J]., 2014, 12(43): 8764-8774.
[52] Govea-Salas M, Rivas-Estilla A M, Rodríguez-Herrera R,. Gallic acid decreases hepatitis C virus expression through its antioxidant capacity [J]., 2016, 11(2): 619-624.
[53] García-Niño W R, Zazueta C. Ellagic acid: Pharmacological activities and molecular mechanisms involved in liver protection [J]., 2015, 97: 84-103.
[54] Reddy B U, Mullick R, Kumar A,. A natural small molecule inhibitor corilagin blocks HCV replication and modulates oxidative stress to reduce liver damage [J]., 2018, 150: 47-59.
[55] Xiang Y F, Ju H Q, Li S,. Effects of 1,2,4,6-tetra--galloyl-β--glucose fromon HBsAg and HBeAg secretion in HepG2.2.15 cell culture [J]., 2010, 25(5): 375-380.
[56] 余虹, 武俊紫, 宋波, 等. 基于Notch信号通路研究银杏内酯B对非酒精性脂肪肝病的影响 [J]. 康复学报, 2021, 31(2): 138-144.
[57] Lu C C, Yang S H, Hsia S M,Inhibitory effects ofL. on hepatic steatosis and liver fibrosis[J]., 2016, 20: 20-30.
[58] 朱炜, 俞宏斌, 戴闯, 等. 余甘子对大鼠非酒精性脂肪肝疾病中肝损伤和炎症的抑制作用研究 [J]. 医学研究杂志, 2012, 41(2): 140-143.
[59] 林敏华, 欧宇轩, 邓桂清, 等. 余甘子提取物对幼鼠非酒精性脂肪肝病的防治作用 [J]. 解剖学研究, 2019, 41(5): 412-417.
[60] Huang C Z, Tung Y T, Hsia S M,. The hepatoprotective effect ofL. fruit on high fat diet-induced non-alcoholic fatty liver disease (NAFLD) in SD rats [J]., 2017, 8(2): 842-850.
[61] Tung Y T, Huang C Z, Lin J H,. Effect ofL. fruit on methionine and choline-deficiency diet-induced nonalcoholic steatohepatitis [J]., 2018, 26(4): 1245-1252.
[62] Tanaka M, Sato A, Kishimoto Y,. Gallic acid inhibits lipid accumulation via AMPK pathway and suppresses apoptosis and macrophage-mediated inflammation in hepatocytes [J]., 2020, 12(5): E1479.
[63] Chao J, Huo T I, Cheng H Y,. Gallic acid ameliorated impaired glucose and lipid homeostasis in high fat diet-induced NAFLD mice [J]., 2014, 9(2): e96969.
[64] Sousa J N, Paraíso A F, Andrade J M O,. Oral gallic acid improve liver steatosis and metabolism modulating hepatic lipogenic markers in obese mice [J]., 2020, 134: 110881.
[65] Fanaei H, Mard S A, Sarkaki A,. Gallic acid treats dust-induced NAFLD in rats by improving the liver’s anti-oxidant capacity and inhibiting ROS/NF-κB/TNFα inflammatory pathway [J]., 2021, 24(2): 240-247.
[66] 张聪, 盛磊, 杨恬, 等. 鞣花酸对AKT基因转染诱导小鼠脂肪性肝病中炎症及氧化应激的影响 [J]. 中国中药杂志, 2019, 44(9): 1869-1875.
[67] Zhang R, Chu K, Zhao N,. Corilagin alleviates nonalcoholic fatty liver disease in high-fat diet-induced C57BL/6 mice by ameliorating oxidative stress and restoring autophagic flux [J]., 2019, 10: 1693.
[68] Mir A I, Kumar B, Tasduq S A,. Reversal of hepatotoxin-induced pre-fibrogenic events by: A histological study [J]., 2007, 45(7): 626-629.
[69] 彭百承, 周海松, 李萍. 余甘子抗实验性肝纤维化作用的研究 [J]. 内蒙古中医药, 2012, 31(11): 86-87.
[70] 李萍, 谢金鲜, 林启云, 等. 余甘子抗慢性肝损伤性肝纤维化的实验研究 [J]. 中西医结合肝病杂志, 2002, 12(6): 355-357.
[71] 李萍, 杨政腾, 彭百承, 等. 余甘子抗大鼠免疫性肝纤维化作用(I) [J]. 中国实验方剂学杂志, 2010, 16(6): 171-173.
[72] 李萍, 彭百承, 杨政腾, 等. 余甘子抗免疫性肝纤维化大鼠的作用(II) [J]. 中国实验方剂学杂志, 2010, 16(8): 139-141.
[73] Sarkar R, Hazra B, Mandal N. Amelioration of iron overload-induced liver toxicity by a potent antioxidant and iron chelator,Gaertn [J]., 2015, 31(7): 656-669.
[74] Hsieh S C, Wu C H, Wu C C,. Gallic acid selectively induces the necrosis of activated hepatic stellate cells via a calcium-dependent calpain I activation pathway [J]., 2014, 102(1): 55-64.
[75] Wang J, Tang L, White J,. Inhibitory effect of gallic acid on CCl4-mediated liver fibrosis in mice [J]., 2014, 69(1): 21-26.
[76] Chen Y X, Zhou Z P, Mo Q G,. Gallic acid attenuates dimethylnitrosamine-induced liver fibrosis by alteration of smad phosphoisoform signaling in rats [J]., 2018, 2018: 1682743.
[77] Hussein R M, Anwar M M, Farghaly H S,. Gallic acid and ferulic acid protect the liver from thioacetamide-induced fibrosis in rats via differential expression of miR-21, miR-30 and miR-200 and impact on TGF-β1/Smad3 signaling [J]., 2020, 324: 109098.
[78] Gupta A, Kumar R, Ganguly R,. Antioxidant, anti-inflammatory and hepatoprotective activities ofand its bioactive component ellagic acid against diclofenac induced oxidative stress and hepatotoxicity [J]., 2021, 8: 44-52.
[79] Buniatian G H. Stages of activation of hepatic stellate cells: Effects of ellagic acid, an inhibiter of liver fibrosis, on their differentiation in culture [J]., 2003, 36(6): 307-319.
[80] Du P, Ma Q, Zhu Z D,. Mechanism of Corilagin interference with IL-13/STAT6 signaling pathways in hepatic alternative activation macrophages in schistosomiasis- induced liver fibrosis in mouse model [J]., 2016, 793: 119-126.
[81] Kinoshita S, Inoue Y, Nakama S,. Antioxidant and hepatoprotective actions of medicinal herb,L. from Okinawa island and its tannin corilagin [J]., 2007, 14(11): 755-762.
[82] Achari C, Reddy G V, Reddy T C,. Chebulagic acid synergizes the cytotoxicity of doxorubicin in human hepatocellular carcinoma through COX-2 dependant modulation of MDR-1 [J]., 2011, 7(5): 432-442.
[83] Chuang H Y, Ng L T, Lin L T,. Hydrolysable tannins of tropical almond show antifibrotic effects in TGF-β1-induced hepatic stellate cells [J]., 2011, 91(15): 2777-2784.
[84] Jeena K J, Joy K L, Kuttan R. Effect of,andon-nitrosodiethylamine induced hepatocarcinogenesis [J]., 1999, 136(1): 11-16.
[85] Rajeshkumar N V, Pillai M R, Kuttan R, Induction of apoptosis in mouse and human carcinoma cell lines bypolyphenols and its effect on chemical carcinogenesis [J]., 2003, 22(2): 201-212.
[86] Sultana S, Ahmed S, Jahangir T.and hepatocarcinogenesis: A chemopreventive study in Wistar rats [J]., 2008, 118(1): 1-6.
[87] Sultana S, Ahmed S, Sharma S,.reverses thioacetamide-induced oxidative stress and early promotional events of primary hepatocarcinogenesis [J]., 2004, 56(12): 1573-1579.
[88] Ngamkitidechakul C, Jaijoy K, Hansakul P,. Antitumour effects ofL.: Induction of cancer cell apoptosis and Inhibition oftumour promotion andinvasion of human cancer cells [J]., 2010, 24(9): 1405-1413.
[89] Zhong Z G, Wu D P, Huang J L,. Progallin A isolated from the acetic ether part of the leaves ofL. induces apoptosis of human hepatocellular carcinoma BEL-7404 cells by up-regulation of Bax expression and down-regulation of Bcl-2 expression [J]., 2011, 133(2): 765-772.
[90] 钟振国, 黄金兰, 梁红, 等. 余甘子叶化学成分没食子酸对人肝癌BEL-7404细胞株凋亡的影响 [J]. 中药材, 2009, 32(7): 1097-1101.
[91] Jagan S, Ramakrishnan G, Anandakumar P,. Antiproliferative potential of gallic acid against diethylnitrosamine-induced rat hepatocellular carcinoma [J]., 2008, 319(1/2): 51-59.
[92] Aglan H A, Ahmed H H, El-Toumy S A,. Gallic acid against hepatocellular carcinoma: An integrated scheme of the potential mechanisms of action fromstudy [J]., 2017, 39(6): 1010428317699127.
[93] Zaazaa A M, Lokman M S, Shalby A B,. Ellagic acid holds promise against hepatocellular carcinomain an experimental model: Mechanisms of action [J]., 2018, 19(2): 387-393.
[94] Deng Y, Li X D, Li X,. Corilagin induces the apoptosis of hepatocellular carcinoma cells through the mitochondrial apoptotic and death receptor pathways [J]., 2018, 39(6): 2545-2552.
Research progress on hepatoprotective effect and mechanism ofand its active components
YIN Ke-huan1, LUO Xiao-min1, DING Yi1, QUE Han-yun1, TAN Rui2, LI Da-peng3, GONG Pu-yang1, GU Jian1
1. College of Pharmacy, Southwest Minzu University, Chengdu 610041, China 2. College of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China 3. West China School of Pharmacy, Sichuan University, Chengdu 610041, China
Yuganzi () is derived from dried ripe fruits of, and is an important medicinal and food homologous variety in China, which possessed a wide range of biological activities including anti-inflammatory, anti-oxidant, anti-tumor and immune regulation. By summarizing the pharmacological effects ofextracts and its active ingredients such as gallic acid, ellagic acid and corilagin, it is indicated that the extracts and monomer components have therapeutic effects on liver damage, viral hepatitis, non-alcoholic fatty liver, liver fibrosis and liver cancer mainly through inhibiting lipid peroxidation, reducing inflammation, anti-apoptosis of hepatocytes, regulating lipid metabolism, maintaining the homeostasis of hepatic stellate cells and promoting apoptosis of hepatoma cells. Hepatoprotective effects and related mechanisms ofand its components are summarized and analyzed in this paper, in order to provide a reference for further research and development ofin prevention and treatment of liver diseases.
L.; gallic acid; ellagic acid; corilagin; liver damage; viral hepatitis; non-alcoholic fatty liver; liver fibrosis; liver cancer
R282.710.5
A
0253 - 2670(2022)01 - 0295 - 13
10.7501/j.issn.0253-2670.2022.01.034
2021-09-22
国家自然科学基金青年科学基金资助项目(82004069);四川省重点研发计划项目(20ZDYF3291);西南民族大学中央高校基本科研业务费专项资金项目(校2021121)
尹可欢(1996—),女,硕士研究生,研究方向为中药药理学。E-mail: kehyin@163.com
龚普阳(1990—),讲师,博士,主要从事中药药效物质基础研究。E-mail: gongpuyang1990@163.com
[责任编辑 崔艳丽]