垂体3.0T MRI 成像联合生长激素诱发试验在儿童矮小症中的诊断价值
2022-01-12吴白龙王芷玥叶晓琴
吴白龙,刘 浩,王芷玥,叶晓琴
(蚌埠医学院附属蚌埠市第三人民医院,蚌埠 233000)
儿童矮小症是指儿童的身高低于同性别、同年龄、同种族儿童平均身高的2 个标准差。既往研究指出,大多数矮小症患儿因身材矮小,会出现不同程度的心理问题,严重影响了其身心健康,故早期对儿童矮小症进行诊断,并给予合理干预极为重要[1]。目前认为,生长激素(Growth hormone,GH)分泌异常是导致儿童矮小症发生的重要因素,患儿因青春期前GH 分泌不足,导致儿童期线性生长异常,而出现成年后身高矮小现象[2]。但目前有研究发现,垂体形态、结构异常与GH 分泌异常密切相关,也是导致儿童矮小症发生的主要原因[3]。垂体3.0T MRI 成像具有较好的组织分辨率,可从多角度观察垂体的解剖结构及形态改变,是垂体病变的畅通检查方法,但目前对于两种方法联合诊断儿童矮小症的研究尚处于探索阶段。故本研究旨在探究垂体3.0T MRI 成像联合GH 诱发试验在儿童矮小症中的诊断价值,为该疾病的临床诊断提供参考依据。
1 资料与方法
1.1 临床资料 以2019 年7 月~2021 年7 月146 例矮小症患儿为研究组,符合卫生部发布的《矮小症临床路径(2010 版)》[4]中关于矮小症的诊断标准,并以同期83 例性早熟患儿为对照组,符合卫生部2015 年发布的《性早熟诊疗指南》[5]中关于性早熟的诊断标准。研究组中男91 例,女55 例;年龄平均(8.86±2.65)岁。对照组中男0 例,女83 例;年龄平均(7.59±1.19)岁。两组年龄对比无明显差异(P>0.05)。
1.2 纳入标准 ①年龄≤14 岁;②经我院伦理委员会审核通过,患者知情同意且签署同意书;③垂体3.0T MRI 成像检查。
1.3 排除标准 ①严重肝肾功能异常者;②存在MRI及GH 诱发试验禁忌症者;③合并恶性肿瘤疾病患者;④既往有口服外源性激素史者。
1.4 方法 MRI 检查:应用美国GE 公司DISCOVERY 750 型3.0T MRI 扫描仪,8 通道颅脑线圈,先行鞍区平扫,然后行CUBE 动态增强扫描,扫描序列包括矢状位T1、冠状位T1、冠状位T2抑脂,FOV 20cm×20cm,层厚2.0mm、层距0.3mm,矩阵256×256,其中T1序列TR 490ms、TE 20ms,T2抑脂序列TR 3000ms、TE 100ms;CUBE 动态增强扫描括矢状位、冠状位,FOV 20cm×20cm,层厚1.0mm、层距-1mm,矩阵256×256,TR 490ms、TE 20ms,静脉注射Gd-DTPA 剂量为0.05mmol/kg。
GH 诱发试验:患儿于晨起空腹状态下安置静脉留置针,抽取第1 次全血2mL,然后口服可乐定(常州制药厂有限公司,批号:国药准字H32021681),剂量为4~4.5ug/kg,最大剂量为160ug。同时静脉滴注10%精氨酸注射液(上海信谊金朱药业有限公司,批号:国药准字H31021692),剂量为2mL/kg,30min 内滴完。于试验后0min、30min、60min、90min、120min 分别采血2mL,分离血清,应用罗氏COBAS6000 型γ免疫计数器,采用放射免疫法检测GH 水平,试剂盒由罗氏公司提供。
1.5 观察指标 (1)分析垂体3.0T MRI 成像对儿童矮小症及性早熟的鉴别价值。(2)比较特发性矮小症(Idiopathic Short Stature,ISS)及生长激素缺乏症(growth hormone deficiency,GHD)患儿垂体3.0TMRI 成像特征及GH 诱发峰值,分析联合检查对ISS 及GHD 的鉴别价值;并分析不同垂体病变患儿的垂体3.0T MRI 成像特征。
1.6 统计学处理 应用SPSS 22 软件处理数据,计数资料以%表示,采用χ2检验比较组间差异;计量资料经正态检验后用mean±SD 表示,用t 检验比较组间差异;采用ROC 曲线分析垂体3.0T MRI 成像、GH 诱发试验联合检测对ISS 及GHD 的鉴别价值,各指标间曲线下面积(area under curve,AUC)的比较采用Z 检验。P<0.05 即差异具有统计学意义。
2 结果
2.1 两组垂体3.0T MRI 成像特征分析 研究组的垂体冠状高径、冠状宽径、矢状前后径均短于对照组,垂体形态异常发生率高于对照组(P<0.05),见表1。
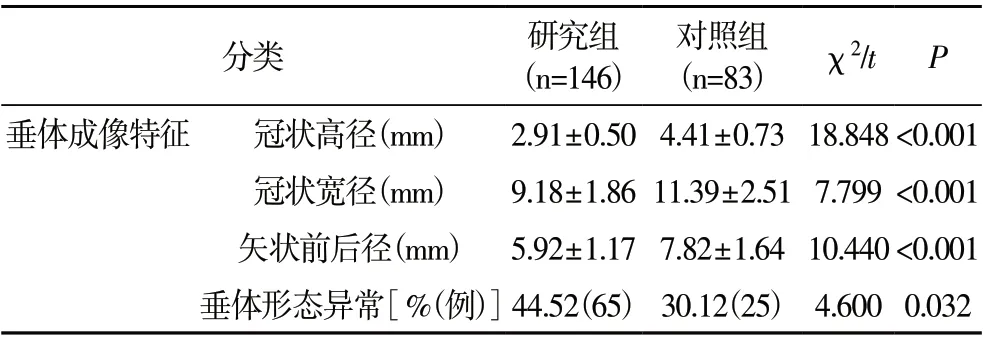
表1 两组垂体3.0T MRI成像特征分析
2.2 垂体3.0T MRI 成像特征对矮小症的诊断价值分析 垂体3.0T MRI 成像特征联合检测鉴别矮小症及性早熟的AUC 大于各成像特征单独检测(P<0.05),见表2、图1。
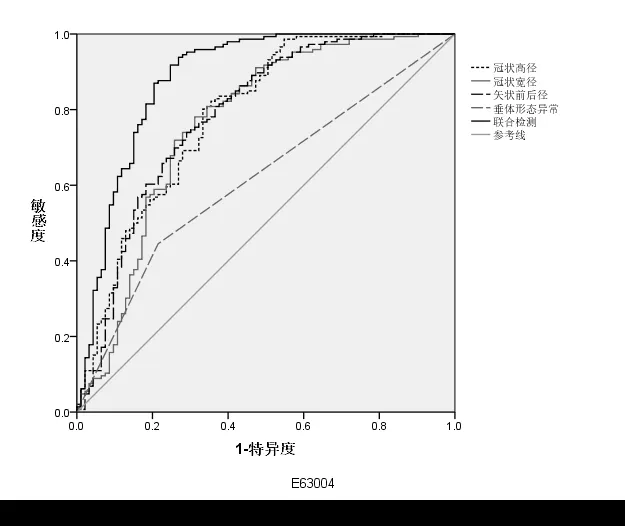
图1 3.0T MRI成像特征诊断矮小症的ROC曲线分析
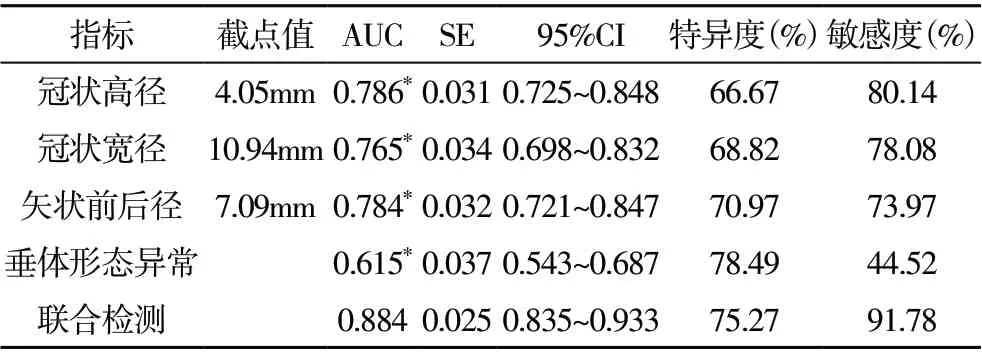
表2 垂体3.0T MRI成像特征对矮小症的诊断价值分析
2.3 ISS 组及GHD 组的垂体3.0T MRI 成像特征及GH 诱发峰值比较 GHD 组的垂体冠状高径、冠状宽径、矢状前后径均短于ISS 组,垂体形态异常发生率高于ISS 组,盐酸可乐定GHmax、精氨酸GHmax 值均小于ISS 组(P<0.05),见表3。
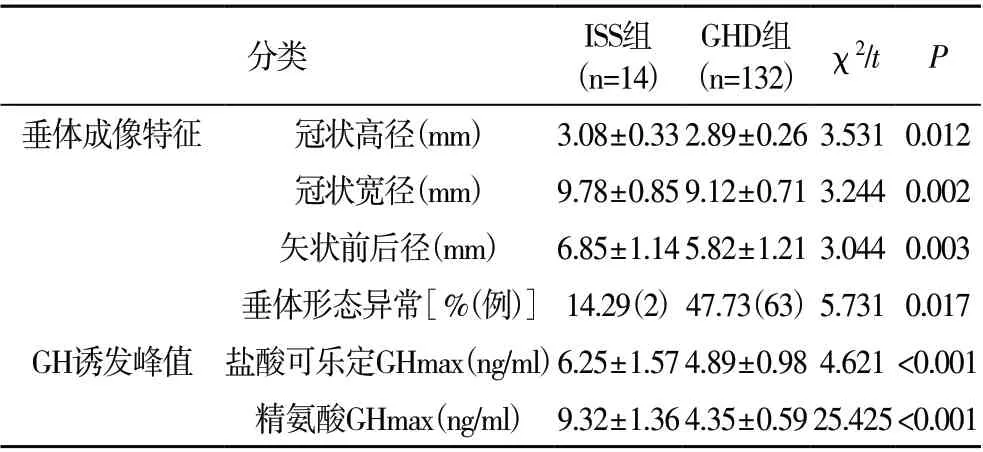
表3 ISS组及GHD组的垂体3.0T MRI成像特征及GH诱发峰值比较
2.4 垂体3.0T MRI 成像、GH 诱发试验联合检测对ISS 及GHD 的鉴别价值分析 联合检查鉴别ISS 及GHD 的AUC 大于垂体3.0T MRI 成像、GH 诱发试验单独检查(P<0.05),见表4、图2。
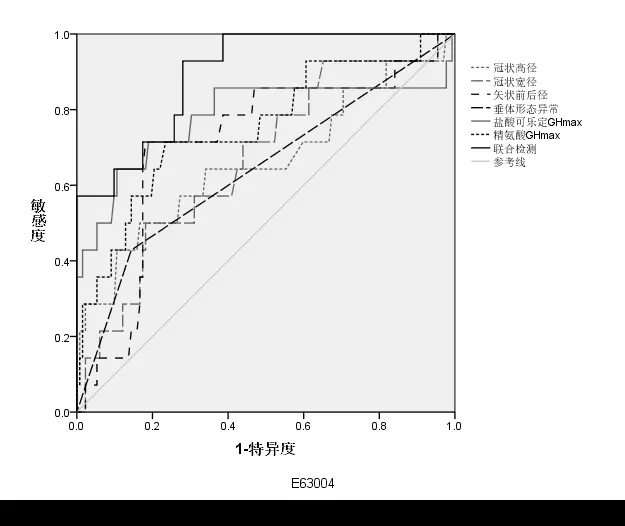
图2 垂体3.0T MRI成像、GH诱发试验联合检测鉴别ISS及GHD的ROC曲线
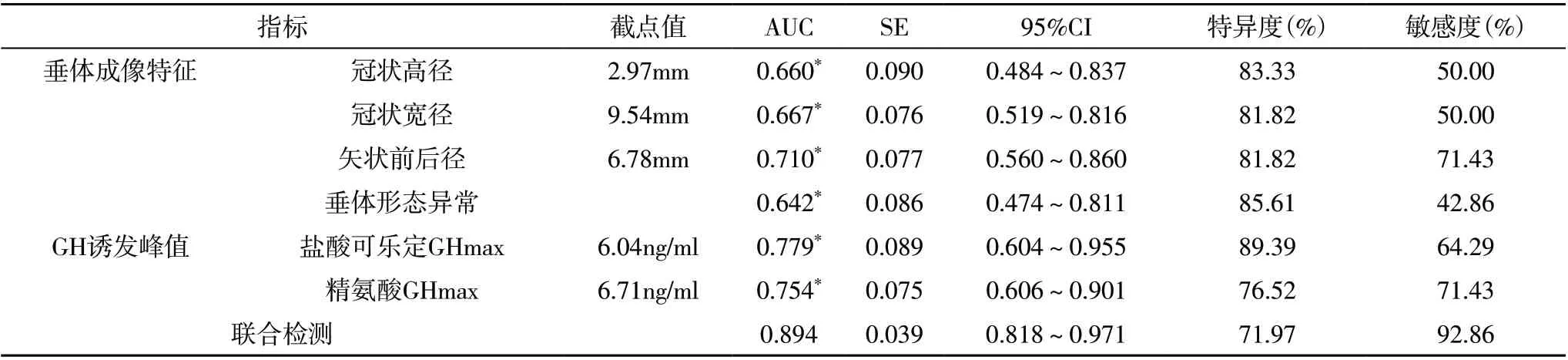
表4 垂体3.0T MRI成像、GH诱发试验联合检测对ISS及GHD的鉴别价值分析
2.5 不同垂体病变患儿的垂体3.0T MRI 成像特征分析 146 例矮小症患者中共检出65 例垂体形态异常(垂体阻断综合征2 例、垂体发育不良58 例、空泡蝶鞍5例),检出率为44.52%。垂体阻断综合征表现为垂体前叶发育不良,垂体后叶T1WI 高信号异位;垂体发育不良主要表现为垂体前叶薄小,高度小于正常值;空泡蝶鞍横断位T1WI、T2WI 图像可见垂体窝处有类圆形脑脊液信号,其内可见点状与脑组织等信号的垂体柄。见图3。
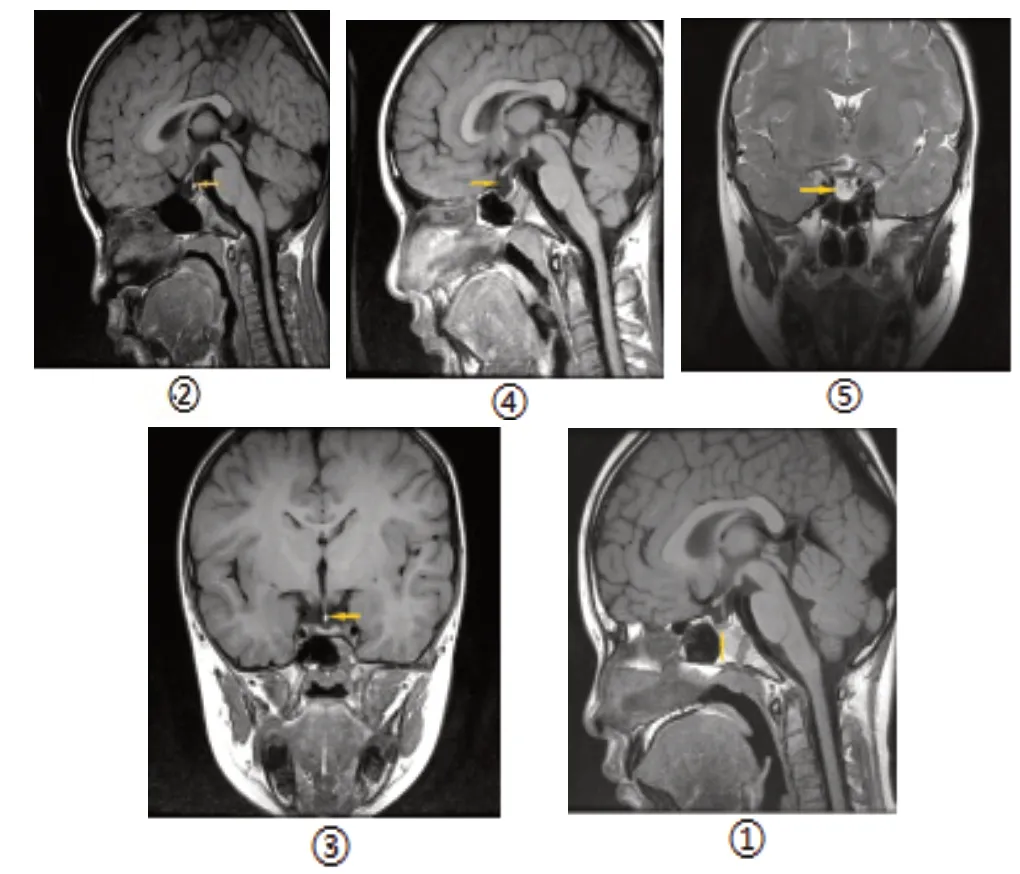
图3 不同垂体病变患儿的垂体3.0TMRI图像分析
3 讨论
垂体是调节生长发育的主要内分泌器官,垂体病变可影响GH 分泌,进而导致儿童矮小症的发生[6]。相关研究指出,性早熟患儿也存在垂体功能异常现象,提示或可通过检测儿童矮小症及性早熟患儿的垂体形态、结构来进行诊断[7-8]。MRI 可清晰显示垂体腺及周围结构的解剖关系,可多角度、多维度角度上观察垂体正常解剖结构和病变[9]。本研究通过测量MRI 上垂体的冠状高径、冠状宽径等来评估垂体大小。经分析发现,研究组的垂体冠状高径、冠状宽径、矢状前后径均短于对照组,垂体形态异常发生率高于对照组,说明矮小症患儿垂体发育较性早熟差。这主要与性早熟患儿垂体腺细胞增生肥大,导致下丘脑-垂体-性腺轴提前激活,进而使垂体体积增大有关[10]。本研究结果显示,垂体3.0T MRI 成像鉴别矮小症及性早熟的AUC 大于0.8,表明其对矮小症及性早熟具有诊断价值,表明可通过垂体3.0TMRI 成像检查来鉴别儿童矮小症及性早熟。
临床上根据儿童矮小症GH 分泌情况分为GHD、ISS,GH 诱发试验是诊断用于诊断两种疾病的重要依据。但仅采用GH 诱发试验鉴别GHD、ISS 的敏感度、特异度较低,无法确保诊断的完全准确性[11-12]。故本研究分析了GHD、ISS 患者的垂体结构形态差异,发现GHD 组的垂体冠状高径、冠状宽径、矢状前后径均短于ISS 组,垂体形态异常发生率高于ISS 组,表明GHD患者的垂体发育较ISS 患者差,本研究发现,GHD 盐酸可乐定GHmax、精氨酸GHmax 值均小于ISS 组,表明GHD 患者存在生长激素分泌异常现象,与既往研究结果相符[13],这可能与GHD 患者垂体发育差,形态异常发生高而影响垂体前叶分泌GH 的功能有关。本研究结果显示,联合检查鉴别ISS 及GHD 的AUC 大于垂体3.0T MRI 成像、GH 诱发试验单独检查,表明联合检测对ISS 及GHD 的鉴别价值高于各指标单独检测。
垂体前叶发育不良、空泡蝶鞍等为儿童矮小症MRI 诊断标准,其与生长激素等垂体激素缺乏有关[14]。本研究对纳入病例进行分析,发现146 例矮小症患者中共检出垂体阻断综合征2 例、垂体发育不良58 例、空泡蝶鞍5 例,表明矮小症垂体异常患者中垂体发育不良患者的检出率较高,与既往研究结果相同[15],说明垂体发育不良仍是导致儿童矮小症发生的主要原因,垂体前叶包括GH 细胞等,当垂体柄缺如或明显变细时,垂体前叶正常的血液供应中断,导致垂体前叶发育不良而出现GH 分泌异常现象。
综上所述,垂体3.0T MRI 成像对矮小症具有诊断价值,且其联合GH 诱发试验检查对ISS 及GHD 具有鉴别价值。
