芹菜素经上调miR148a-3p 表达抑制MHCC97H 细胞迁移和侵袭
2022-01-12刘丽华周志凌张坚松
刘丽华,孙 菲,周志凌,张坚松
(1. 珠海市人民医院/暨南大学附属珠海医院,珠海 519000;2. 湖南师范大学医学院,长沙 410013)
肝细胞癌(hepatocellular carcinoma,HCC)的高侵袭转移是亟待解决的临床治疗难题[1]。新近的研究显示非编码调控性微小RNAs(microRNAs)能有效地抑制HCC 细胞迁移和侵袭[2,3]。我们先前的研究证明芹菜素(apigenin,API)类似物异牡荆素抑制HCC 肿瘤干细胞特性和侵袭能力[4],然而,其作用机制尚未完全阐明。本文旨在研究API 是否通过上调miR-148a-3p 表达抑制体外HCC 细胞迁移和侵袭能力。
1 材料与方法
1.1 细胞培养与处理 高侵袭性人肝细胞癌MHCC97H 细胞系购自中国科学院细胞库(中国上海市)。按照先前文献的描述[4],细胞放置在37°C、饱和湿度的5% CO2 培养箱中单层贴壁生长;然后,通过阳离子脂质体转染miR-148a-3p 模拟物或不同浓度的API(apigenin,API:5、10 和20μM)或API(20μM)联合miR-148a-3p 抑制物转染MHCC97H 细胞处理24 小时。
1.2 miRNA 转染 如先前文献[5]的阐释的方法,按照制造商的说明(RiboBio,中国广州市),用iboFECT™CP 试剂将micrON™miR-148a 模拟物(50 nM)或抑制物(100 nM)转染入MHCC97H 细胞。同时,按照相同的方法和步骤转染miR-148a-3p 模拟物的阴性对照(miRCtrl)或miR-148a-3p 抑制物的阴性对照(Anti-Ctrl)。
1.3 实时定量PCR 参考文献[5]的实验方法,用miRcute miRNA 分离试剂盒(cat. DP501,Tiangen Biotech,中国)制备总microRNA。基于TaqMan MicroRNA 分析(Applied Biosystems)的All-in-One™miRNA qRT-PCR 检测试剂盒转录和扩增总miRNA(2μg),以测定microRNA 的量。用2-ΔΔCt方法分析结果。研究使用的引物是:成熟miRNA-148a-3p(F:TGCGGTCAGTGCACTACAGAAC;R:CCAGTGCAGGGTVVGAGGT)和内参U6(F:5'-CGC TTC GGC AGC ACA TAT ACT A-3';R:5'-CGC TTC ACG AAT TTG CGT GTC A-3'。
1.4 划痕法 参照文献[4]的描述,转染的MHCC97H细胞或不同浓度的API(apigenin,API:5、10 和20μM)或API(20μM)联合miR-148a-3p 抑制物处理细胞接种于6 孔细胞培养板,生长至90%汇合度。然后,用无菌的100μL 微量移液器的吸头垂直划过形成伤口。接下来,洗涤细胞并分别于0 和24h 时在放大倍数为100 的视野中拍照分析。miR-Ctrl 或Anti-Ctrl 或溶媒(0.1%DMSO)处理MHCC97H 细胞用于标化迁移细胞率(%)。
1.5 Transwell 小室侵袭试验 参照文献[4]的描述,用基质胶包被的8μm 孔膜Transwell 系统(Corning Incorporated,NY,USA)进行细胞侵袭测定。简而言之,在有或没有API 的况下,无血清DMEM 培养基悬浮的MHCC97H 细胞接种入上室。含10%胎牛血清完全培养基加入下室中,作为化学诱导剂,培养24 小时。侵袭细胞用甲醇固定,并行瑞氏染料染色,并用Vectashield 固定溶液(Vectorshield,Vector Laboratories)固定。光学显微镜(Olympus DP72,德国汉堡)拍照(放大倍数:200)。
1.6 统计学处理 用SPSS 20.0 软件(IBM,Armonk,NY,美国)进行统计分析。数据为平均值±标准差。非配对双尾Student’s t 检验比较实验组与对照组之间的均数。用单因素方差分析的post-hoc Tukey's 检验进行各组均数的两两比较。P<0.05 认为有统计学意义。
2 结果
2.1 miR-148a-3p 抑制MHCC97H 细胞迁移能力
图1 显示:miR-148a-3p 转染显著降低体外培养MHCC97H 细胞迁移率(P<0.05)。
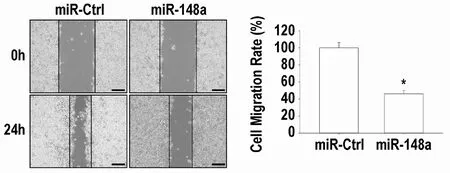
图1 miR-148a-3p模拟物抑制体外培养MHCC97H细胞迁移能力(mean±SD,n=3)
2.2 miR-148a-3p 降低MHCC97H 细胞侵袭率 图2可见:miR-148a-3p 显著降低体外培养MHCC97H 细胞侵袭率(P<0.05)。
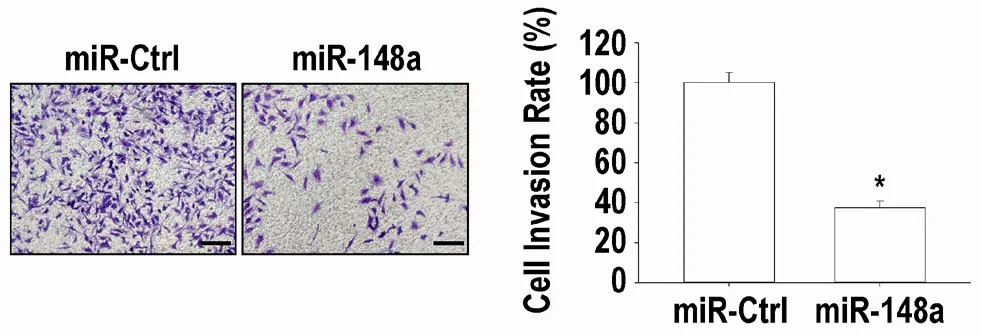
图2 miR-148a-3p模拟物抑制体外培养MHCC97H细胞侵袭能力(mean±SD,n=3)
2.3 API 上调MHCC97H 细胞miR-148a-3p 表达图3 示:与0.1 % DMSO 处理的MHCC97H 细胞相比,API(5、10 和20μM)以浓度依赖方式增高MHCC97H 细胞miR148a-3p 表达水平(P<0.05)。
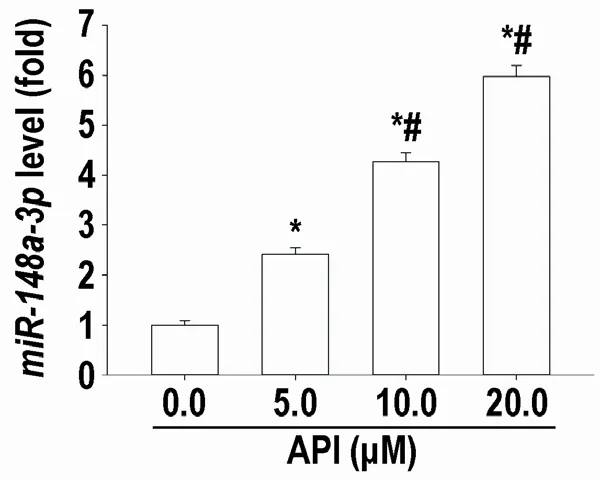
图3 API显著上调MHCC97H细胞miR-148a-3p表达(mean±SD,n=3)RT-qPCR分析MHCC97H细胞miR-148a-3p表达水平。与溶媒(0.1%DMSO)处理的MHCC97H细胞相比:* P<0.05 ;与5.0μM API处理的MHCC97H细胞相比:#P<0.05。
2.4 API 抑制MHCC97H 细胞迁移和侵袭能力 如图4 所示:API(5、10 和20μM)以浓度依赖方式降低MHCC97H 细胞迁移和侵袭率(P<0.05)。
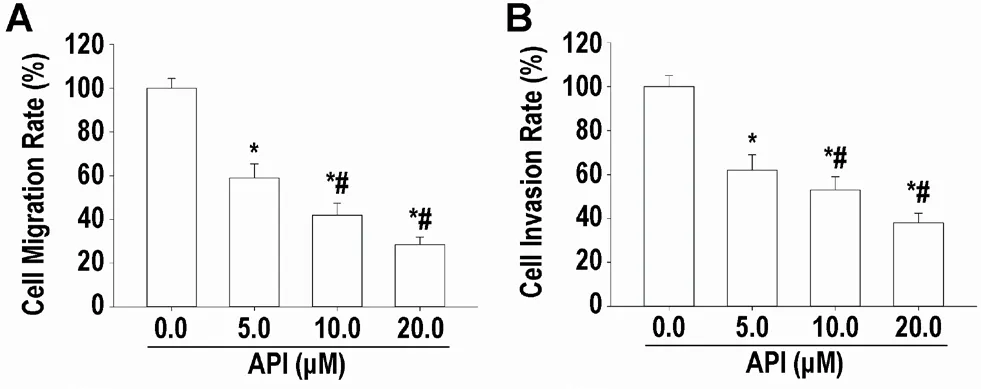
图4 API剂量依赖性抑制MHCC97H细胞迁移和侵袭(mean±SD,n=3)
2.5 miR-148a-3p 抑制物拮抗API 抑制MHCC97H细胞迁移和侵袭作用 miR-148a-3p 抑制物增强MHCC97H 细胞迁移(图5 A;P<0.05)和侵袭能力(图5 B;P<0.05),并且miR-148a-3p 抑制物能消除API 抑制细胞迁移和侵袭作用(图5 A 和4B;P<0.05)。
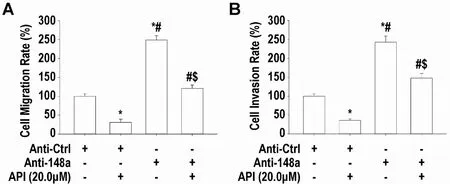
图5 miR-148a-3p抑制物对API抑制MHCC97H细胞迁移和侵袭的影响(mean±SD,n=3)
划痕法和Transwell 小室法分别测定MHCC97H 细胞迁移(A)和侵袭(B)率。与miR-148-3p 抑制物阴性对照(Anti-Ctrl)转染的MHCC97H 细胞相比:*P<0.05;与单独API(20μM)处理的MHCC97H 细胞相比:#P<0.05;与单独miR-148a-3p 抑制物转染的MHCC97H细胞相比:$P<0.05。
3 讨论
HCC 的高侵袭转移特性是其致死的主要原因之一[1]。有研究表明,miR-148a 作为癌基因能增加IDH1 R132H 突变的人胶质瘤细胞迁移和侵袭;与此相反,miR-148a 作为抑癌基因有效抑制人胃癌[7]、卵巢癌[8]和非小细胞肺癌[9],包括HCC[10]细胞增殖、迁移和侵袭能力。与Huang 等报告的结果一致,本文的结果再次证实miR-148a-3p 模拟物有效地降低HCC 细胞迁移率和侵袭率。
API 属于无基因毒性的饮食黄酮类化合物。Wang等人[11]最近报道API 通过影响microRNA 转录本的表达抑制HCC 细胞生长。我们先前的研究证实API 的糖苷类化合物(异牡荆素)具有抑制HCC 肿瘤干样细胞迁移和侵袭作用[4],然而,其作用分子机制有待深入研究。在本文的研究中,我们提呈了一种新的API 药理分子机制认识,即:API 通过上调miR-148a-3p 表达有效地抑制HCC 细胞迁移和侵袭能力。在随后的研究中,我们拟探讨API 以何种方式上调miR-148a-3p 表达以及miR-148a-3p 转录后调控何种或哪类靶基因发挥抑制人HCC 迁移和侵袭作用。
