蒙药阿拉嘎斑布有效成分对肝癌HepG2 细胞作用机制的研究
2022-01-11马世琦邓秀玲吴亚男韩晶晶乔一芸王海生
马世琦 邓秀玲 吴亚男 韩晶晶 赵 阳 乔一芸 王海生▲
1.内蒙古自治区中医医院门诊办公室,内蒙古呼和浩特 010020;2.内蒙古医科大学基础医学院生物化学与分子生物学系,内蒙古呼和浩特 010110;3.内蒙古医科大学基础医学院医学实验中心,内蒙古呼和浩特 010110
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的肝癌组织学亚型,占全世界原发性肝癌的80%以上[1]。 在全球范围内,HCC 是与癌症相关死亡的第四大最常见原因,其五年生存率仅为18%,是仅次于胰腺癌的第二大致命肿瘤[2-3]。 由于大部分HCC 患者发现时已处于进展期,而全身化疗的中位生存时间也不到1 年,治疗效果不理想[4]。阿拉嘎斑布是我国的传统蒙药,是芫菁科昆虫的干燥虫体,其具有破血逐瘀、散结消癥、滋补肾阳、调理体素、增强抵抗力等功效[5],其有效药物成分主要为斑蝥素(cantharidin,CTD),分子式C10H12O4,分子量196.2 D。 有关CTD 的提取方法不尽相同,主要有震荡静置提取法、超声波震荡提取法、冷浸提取法、碱水提取法、热回流提取法等[6-9]。有文献报道,芫菁虫体不同部位的CTD 产率有差别,其中产率最高的部位为虫体的腹部,并且发现干燥虫体较活体虫体能获得更多的CTD[10]。CTD 对多种人类恶性肿瘤均表现出显著的抗癌活性,如对喉癌、肾癌、肺癌、肝癌、胃癌、皮肤癌等多种肿瘤的生长表现出明显的抑制作用[11-14]。但是,CTD 对肝癌抑制作用的具体分子机制目前仍不完全清楚。本研究选用蒙药阿拉嘎斑布虫体作为研究药物,使用课题组前期通过混合法提取的CTD 作为实验用药,研究其对HepG2 细胞的影响,并通过RNA 测序, 尝试从分子水平及基因表达谱的角度对CTD 治疗肝癌的分子机制进行研究, 为蒙药用于肝癌的治疗提供新的线索和依据。
1 材料与方法
1.1 细胞与主要试剂
HepG2 细胞株购自武汉普诺赛生物科技有限公司;阿拉嘎斑布干燥虫体购自内蒙古自治区中医医院;胎牛血清购自美国GIBCO 公司;CTD 标准品及PI细胞周期检测试剂盒购自西格玛奥德里奇上海贸易有限公司;MTT 试剂盒购自北京鼎国昌盛生物技术有限责任公司;Caspase-GloR3/7 检测试剂盒购自普洛麦格北京生物技术有限公司;RNAiso Plus Total RNA 提取试剂盒等。
1.2 方法
1.2.1 细胞培养 本研究所用的HepG2 细胞株, 于含有10%胎牛血清、1%青链霉素双抗的DMEM 完全培养液中进行培养,根据细胞生长状态,2~3 d 传代一次。
1.2.2 CTD 母液的配制 将课题组前期提取的CTD 白色粉末用含1‰二甲基亚砜(dimethyl sulfoxide,DMSO)的DMEM 基础培养液进行超声溶解配制母液, 使用时再用完全培养液稀释至所需浓度。
1.2.3 实验分组设置 空白对照组(Blank):不含细胞,加只含有1‰ DMSO 药物溶剂的完全培养液;溶剂对照组(Mock):含正常目的细胞,加只含有1‰ DMSO药物溶剂的完全培养液;实验组(CTD):含正常目的细胞,加含有相应浓度CTD 的含药培养液。
1.2.4 MTT 法检测增殖 于3 块96 孔板内接种细胞,每组三个复孔,孵育24 h 后加药处理,分别于24、48、72 h 后检测光密度(optical density,OD)值。 实验分为Blank 组、Mock 组和 CTD 组, 其中 CTD 组的浓度分别为 0.05、0.1、0.5、1、2、4、8、16、32、64、128、256、512、1024 μmol/L。使用 Graphpad prism 5 软件进行半抑制浓度(half maximal inhibitory concentration,IC50)数值计算。
1.2.5 Caspase 3/7 荧光法检测凋亡 于96 孔板内接种细胞,每组三个复孔,孵育48 h 后加药处理,48 h后加Caspase 3/7 反应液检测。 实验分组同1.2.4。
1.2.6 流式细胞仪PI 单染法检测细胞周期 于6 孔板内接种细胞,每组三个复孔,孵育24 h 后加药处理,48 h 后收集细胞,于4℃冰箱固定24 h,加入Rnase A溶液和PI 染色液后上机检测。 实验分为Mock 组和CTD 组,实验重复 3 次。
1.2.7 测序技术检测差异表达的mRNA 收集足量细胞,采用Trizol 法提取总RNA 后进行建库,质检合格后,采用Illumina 测序平台进行RNA seq,随后进行差异基因筛选,并进行富集分析。
1.3 统计学方法
采用SPSS 17.0 统计学软件和GraphPad Prism 5进行数据分析,计量资料用均数±标准差()表示,两组间比较采用t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 MTT 法检测结果
检测结果见图1。CTD 对HepG2 的抑制呈现一定程度的剂量-时间依赖,且 24、48、72 h 的 IC50分别为54.420、9.892、4.132 μmol/L,48 h 对应曲线的线性效果最佳。因此,参考 48 h 的 IC50值,将 10 μmol/L 作为后续实验的CTD 药物浓度。
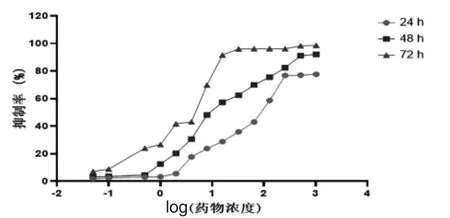
图1 CTD 作用于HepG2 的剂量反应曲线
2.2 Caspase 3/7 荧光法检测结果
Caspase 3/7 荧光法检测结果见图2。结果表明,加药作用 48 h 后,MOCK 组荧光强度为 7661.67±108.87,CTD 组为 24 310.00±305.50,与 MOCK 组比较,CTD组荧光强度有明显的增强, 差异有统计学意义(P<0.01),CTD 是 HepG2 凋亡的有效诱导物。
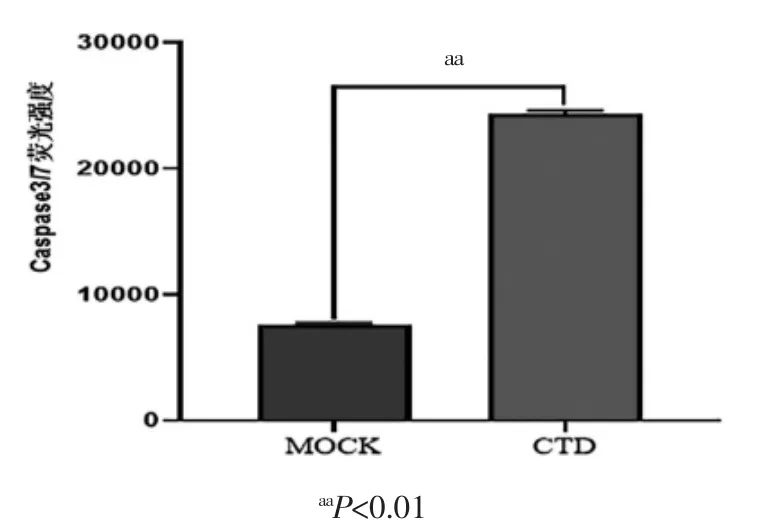
图2 CTD 对HepG2 细胞凋亡的影响
2.3 流式细胞仪PI 单染法检测的 CTD 对HepG2 细胞周期的影响
流式细胞仪PI 单染法检测结果见图3(封三)。与MOCK 组比较, 加药作用 48 h 后,G0/G1期和 S 期下降,差异均有统计学意义(P<0.05),而 G2/M 期则明显上升,差异有统计学意义(P<0.01),CTD 可将 HepG2细胞周期阻滞于G2/M 期。
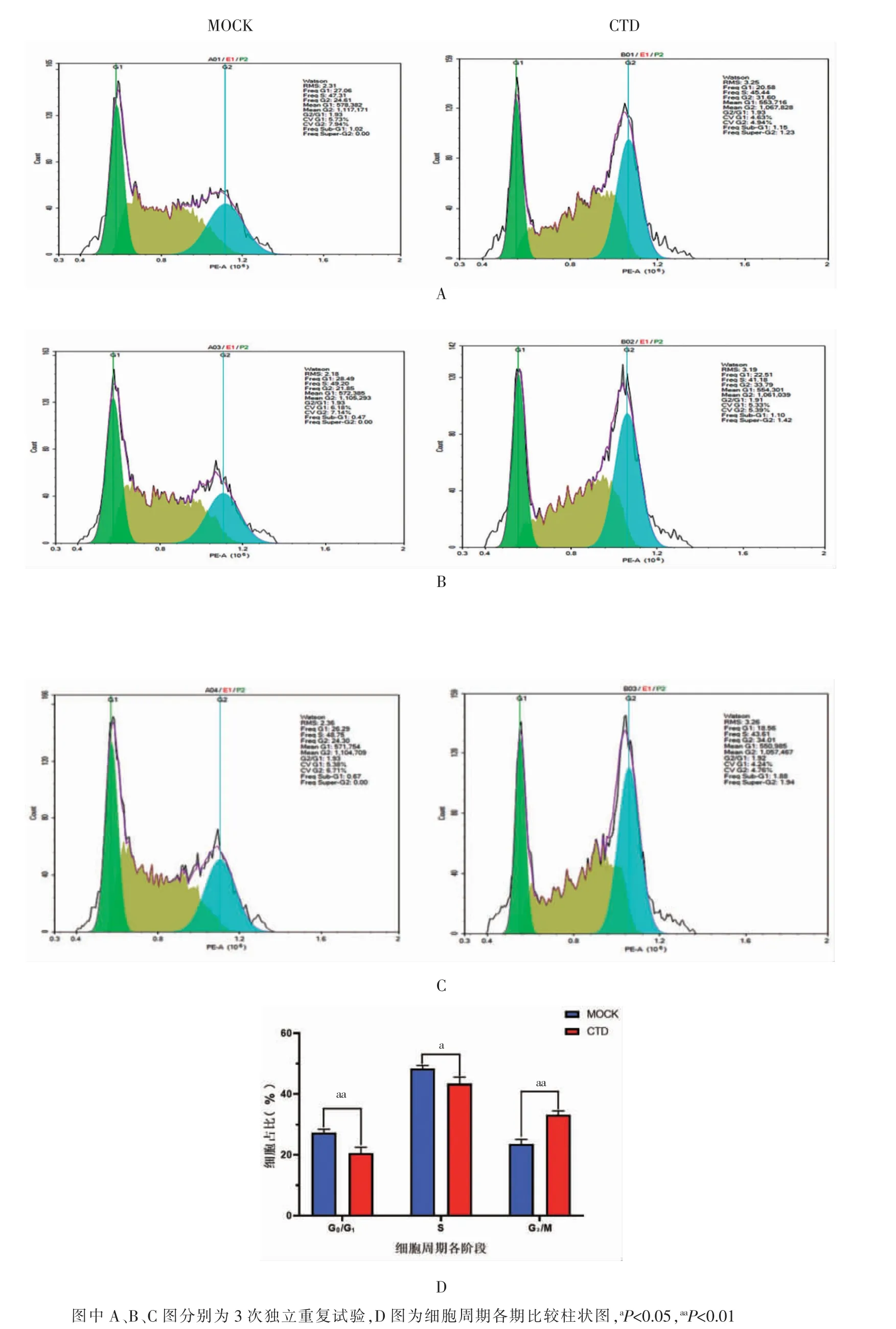
图3 CTD 对HepG2 细胞周期的影响
2.4 测序技术检测 CTD 对 HepG2 细胞 mRNA 差异表达谱的影响
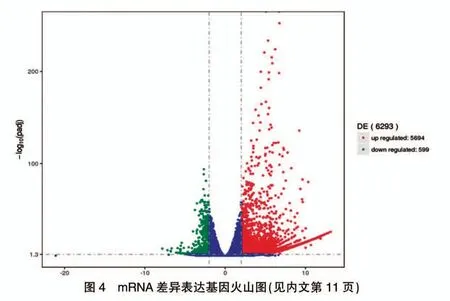
2.4.1 差异基因筛选结果 mRNA 差异基因统计结果见图4(封四)。 当差异基因筛选的阈值为|log2(Fold Change)|>2 且 Padj<0.05 时 ,mRNA 差 异 基 因 共 计6293 个,其中5694 个差异表达水平升高,599 个差异表达水平下降。
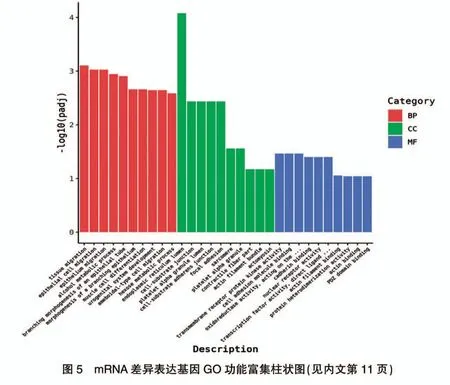
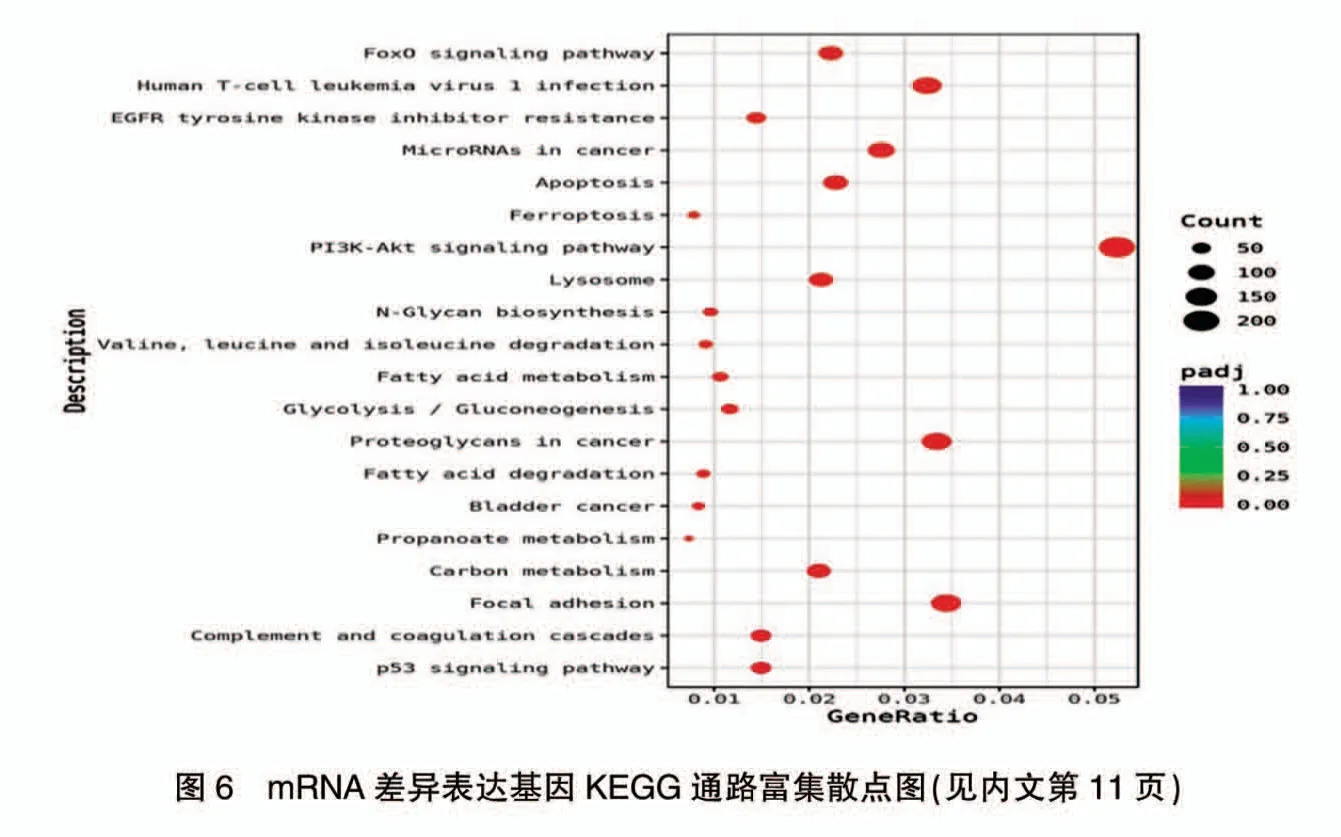
2.4.2 差异基因富集分析结果 差异mRNA 靶基因的GO 功能富集和KEGG 通路富集结果分别见图5~6(封四),筛选条件均为 Padj<0.05。 GO 功能富集选择显著性最明显的一个注释, 即为endoplasmic reticulum lumen(P<0.05),属于 cellular component 类目。KEGG通路富集主要富集在p53 signaling pathway、PI3KAkt signaling pathway、Apoptosis、MicroRNAs in cancer以及多种代谢途径(P<0.05),差异基因可能通过这些不同的功能及通路调控HepG2 细胞的生物进程。 对于以上筛选出的显著差异表达mRNA,通过大量的查阅文献并结合GO 功能富集和KEGG 通路富集分析,以及按照差异基因相对表达量的变化倍数从高到低进一步筛选出mRNA 共计18 个基因,其中14 个基因表达水平上调,4 个基因表达水平下调, 结果见表1,这些基因在CTD 作用于HepG2 细胞时可能发挥关键作用。
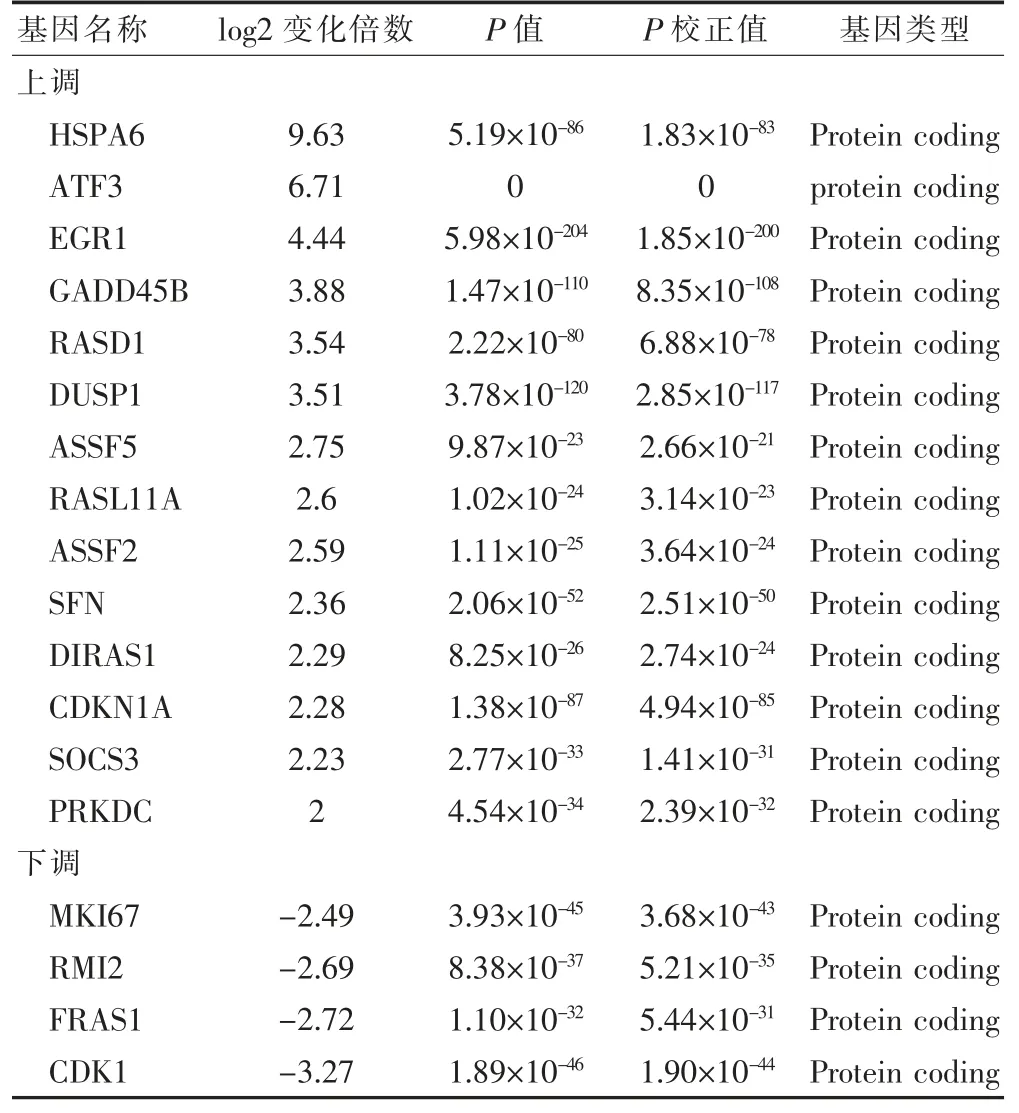
表1 显著差异表达的mRNA 基因汇总表
3 讨论
本研究将阿拉嘎斑布的有效成分CTD 选为研究药物,以HepG2 细胞为研究对象,先后从CTD 作用于HepG2 细胞后的细胞增殖、凋亡和周期分布三个角度进行了实验研究,结果显示,CTD 可显著抑制HepG2的增殖,其机制可能与诱导凋亡和触发细胞周期阻滞于G2/M 期有关。
为了进一步研究CTD 抑制肝癌的作用机制,本研究采用RNA-seq 测序技术, 从mRNA 基因差异表达谱的角度研究CTD 抑制肝癌的分子机制。 最终筛选出18 个显著差异表达的mRNA, 这些基因参与调控多种信号通路如p53 信号通路、PI3K-Akt 信号通路、p38-MAPK 信号通路等。
双特异性磷酸酶(dual specificity phosphatase,DUSP)、CDKN1A 和 CDK1 是以上筛选出的显著差异表达的mRNA。DUSP 属于酪氨酸磷酸酶中的亚家族,其在体内可参与调控多种信号途径, 与肿瘤关系密切[15-16]。 DUSP1 是 DUSP 的家族成员之一, 研究表明DUSP1 可通过对MAPK 信号通路进行负性调控从而对肝癌细胞的增殖进行抑制[17-19],提示DUSP1 在肝癌中发挥的是抑癌作用, 与本研究的测序结果一致,即用 CTD 处理 HepG2 细胞后, 与对照组比较,CTD 组的DUSP1 mRNA 表达水平上调, 可以推测DUSP1 在CTD 的抗肝癌过程中发挥重要作用。
CDKN1A,又名P21,是细胞周期依赖性蛋白激酶(cyclin-dependent kinase,CDK)的抑制剂,其对细胞周期的调控具有关键作用[20-21]。 研究发现,CDK1 是CDKN1A 的重要靶标,CDKN1A 通过下调CDK1 使其活性受到抑制,从而将细胞周期阻滞于G2/M 期[22]。 这表明CDKN1A 和CDK1 在调控细胞周期阶段转化中起关键作用,与本研究的结果一致,即将CTD 作用于HepG2 细胞后,与对照组比较,CTD 组 HepG2 细胞被阻滞于G2/M 期,且 CTD 组的CDKN1A mRNA 表达水平上调, 而CDK1 mRNA 表达水平下调, 提示CDKN1A 对CDK1 的负性调控可能是CTD 将 HepG2 细胞阻滞于G2/M 期的重要环节。
以上这些基因中,一部分已经有文献报道其与肝癌或者其他肿瘤在分子机制上的关系,但绝大多数均未从CTD 的角度进行过分析研究, 而本研究目前的结果已表明这些基因可能会是CTD 抑制肝癌的重要应答基因,因此这些基因将会是本研究下一步继续深入研究CTD 抑制肝癌分子机制的研究对象。
