Pitx2对缺氧诱导的心肌细胞H9c2凋亡的影响
2022-01-11王大强王革新薛士鹏张庆远杜碧丽
王大强,王革新,薛士鹏,张庆远,杜碧丽
近年来,我国冠心病等心血管疾病发病率呈升高趋势,目前药物治疗多数是通过扩张血管、抗凝、改善心肌重塑等改善心肌缺血,通过介入治疗、溶栓等促进血液流通,延长心肌细胞生存时间,恢复心肌功能,但由于心肌细胞防御功能未发挥或自身存在抵抗作用,较多病人治疗后疗效不佳[1]。有研究显示,通过基因手段可改善心肌细胞适应能力,减少由缺血引起的细胞凋亡,抑制心肌损伤,可能为预防和治疗心肌缺血研究的方向[2]。
Pitx2基因全名为paried-like homodmain transcription factor 2,其定位于4q25-26染色体上,Pitx2属于Bicoid家族成员,是一个转录因子,Pitx2和Pitx1、Pitx3共同构成了Pitx亚家族[3]。有研究表明,Pitx2在胚胎发育的眼睛周围、脐带、上下颌区域及四肢基部等部位表达,成人舌、脑、肺、肾等器官中也有Pitx2表达,Pitx2与左右不对称发育有关[4]。Pitx2突变引起多种疾病,如青光眼、角膜环状皮样瘤、乳腺癌等[5-7]。相关研究显示,Pitx2与心脏发育有关,敲除Pitx2可诱发小鼠心脏出现脂肪样组织,而获得Pitx2小鼠可免受缺血性心肌细胞损伤[8]。Pitx2缺陷的小鼠心尖部切除后不能及时修复,而增强Pitx2之后的小鼠心肌梗死后心肌组织再生能力明显增强,Pitx2具有保护心脏、促进心脏修复的作用[9]。目前关于Pitx2在缺氧诱导心肌细胞凋亡中的作用尚不明确。本研究以心肌细胞H9c2作为研究对象,探讨Pitx2对缺氧诱导的心肌细胞凋亡的影响及作用机制,以期为基因治疗和改善心肌缺血提供可能思路。
1 材料与方法
1.1 实验材料 C-Caspase-3抗体、Pitx2抗体购自美国Abcam公司;Pitx2过表达载体、C/EBP同源蛋白(CHOP)过表达载体、阴性对照载体均由普健生物(武汉)科技有限公司提供;CHOP抗体、C-Caspase-12抗体购自美国Proteintech公司;心肌细胞H9c2购自通派(上海)生物科技有限公司;CytoFLEX流式细胞仪购自美国贝克曼库尔特;MR-96A酶标仪购自深圳迈瑞生物医疗电子股份有限公司。
1.2 细胞分组 心肌细胞培养条件为37 ℃,饱和湿度,5%CO2培养箱,细胞培养在添加10%胎牛血清的DMEM/F12培养液中,细胞传代培养以0.25%的胰蛋白酶消化进行传代培养。将心肌细胞分为4组,对照组:常规条件培养,为空白对照细胞;模型组:在实验开始时,进行缺氧复氧处理;Vector组:实验开始前24 h在细胞中转染阴性对照载体,实验开始时给予缺氧复氧处理;Pitx2组:实验开始前24 h在细胞中转染Pitx2过表达载体,实验开始时给予缺氧复氧处理。缺氧复氧处理方法:将细胞置于含有5%CO2、1%O2的37 ℃培养箱内培养。细胞转染方法按照脂质体转染试剂Lipofectamine 2000操作说明进行。
1.3 实时荧光定量逆转录-聚合酶链式反应(RT-qPCR)检测Pitx2 mRNA 收集1.2方法处理24 h后的对照组、模型组、Vector组和Pitx2组细胞,将孔中的上清溶液弃掉后,吸取磷酸缓冲盐溶液(PBS)反复洗涤细胞2次,在细胞内添加Trizol试剂,常规方法提取细胞总RNA。冰浴条件下的EP管中添加1 μL的oligo dT、1 μL的random,添加ddH2O至12.5 μL,置于70 ℃孵育5 min后,置于冰上冷却2 min,之后再加入2 μL的dNTP、4 μL的5×Buffer、0.5 μL的RNasin、1 μL的M-MLV,均匀混合后,置于25 ℃温浴10 min,42 ℃温浴50 min,之后置于80 ℃孵育10 min,冰上冷却,得到的cDNA置于-20 ℃保存。PCR反应体系:1 μL的cDNA、10 μL的SYBR Green mastermix、0.5 μL的正向、反向引物,添加ddH2O至20 μL,PCR反应条件:94 ℃孵育5 min,94 ℃孵育10 s,60 ℃孵育20 s,72 ℃孵育30 s,共进行40个循环。Pitx2正向引物为5′-GGACCACCGCATCTCTACAT-3′,反向引物为5′-GACAGAAAGGAAAGCGCAAC-3′。
1.4 免疫印迹法检测Pitx2蛋白 收集1.2方法处理24 h后的对照组、模型组、Vector组和Pitx2组细胞,将孔中的上清溶液弃掉后,吸取PBS反复洗涤细胞2次,之后在细胞内添加放射免疫沉淀(RIPA)裂解溶液,晃动细胞培养板使裂解液完全覆盖细胞,置于冰上裂解20 min,期间采用移液枪吹打细胞4次。吸取裂解溶液并转移到离心管内,置于4 ℃低温离心机中,以12 000 g离心10 min。吸取上清溶液,分装并保存。采用2,2-联喹啉-4,4-二甲酸二钠(BCA)方法测定提取蛋白浓度。使用滤纸将洗净的玻璃板吸干,干燥后常规方法组装。使用浓度分别为10%分离胶和5%分离胶进行SDS-PAGE电泳,在蛋白中加入5×上样缓冲溶液,置于沸水浴中孵育5 min,制备成上样液。每个孔添加20 μL的上样液(含有30 μg蛋白),连接电源,以80 V的恒定电压持续电泳3 h。电泳即将结束时,将聚偏二氟乙烯(PVDF)膜提前浸泡在转移缓冲液中,按照“三明治”方法进行转膜,转膜电压调整为60 V,转膜进行1.5 h。将PVDF膜置于5%牛血清白蛋白溶液中,在室温下摇床震荡反应1 h。一抗和二抗使用前以封闭液稀释,Pitx2抗体按照1∶600稀释,内参3-磷酸甘油醛脱氢酶(GAPDH)抗体按照1∶1 000稀释,二抗按照1∶2 000稀释。将PVDF膜置于一抗孵育袋中,在室温中孵育结合2 h,之后将PVDF膜置于二抗孵育袋中,在室温中结合2 h。将提前混合好的电化学发光(ECL)试剂A和B混合物滴加到PVDF膜上,静置5 min。采用Image J分析条带的灰度值。Pitx2蛋白相对表达=Pitx2条带灰度值/GAPDH灰度值。
1.5 四唑盐(MTT)测定细胞增殖情况 将对照组、模型组、Vector组和Pitx2组心肌细胞按照每个孔4×103个细胞接种到96孔板内,置于37 ℃、5%CO2培养箱内培养24 h。将培养箱取出,在每个孔内添加10 μL的MTT工作液,37 ℃孵育4 h。吸取孔内液体,再添加150 μL的二甲基亚砜(DMSO)溶液,使用酶标仪测定每个孔OD值。细胞存活率=(对照组OD值/实验组OD值)×100%。
1.6 流式细胞术检测细胞凋亡情况 收集按照1.2方法处理24 h后的对照组、模型组、Vector组和Pitx2组细胞,将孔中上清溶液弃掉后,吸取PBS反复洗涤细胞2次,添加胰蛋白酶,置于37 ℃消化1 min,1 000 g离心10 min,采用PBS将细胞悬浮,将细胞浓度调整至1×106个/mL。吸取1 mL细胞培养液,离心后取细胞沉淀,添加400 μL的结合缓冲溶液,之后再吸取5 μL的Annexin V-FITC和PI染色液添加到细胞内,避光条件下结合15 min。采用流式细胞仪检测凋亡变化。
1.7 免疫印迹法检测C-Caspase-3、C-Caspase-12、CHOP蛋白表达 收集1.2方法处理24 h后的对照组、模型组、Vector组和Pitx2组细胞,按照1.4中免疫印迹法步骤检测C-Caspase-3、C-Caspase-12、CHOP蛋白表达,C-Caspase-3、C-Caspase-12抗体按照1∶200稀释,CHOP抗体按照1∶400稀释。
1.8 CHOP过表达载体对上调Pitx2影响心肌细胞作用的测定 采用Lipofectamine 2000分别将CHOP过表达载体、Pitx2过表达载体和阴性对照载体、Pitx2过表达载体共转染到心肌细胞内,之后给予缺氧处理,作为Pitx2+CHOP组、Pitx2+NC组。细胞培养24 h后,MTT方法检测增殖细胞(步骤参照1.5),流式细胞术检测凋亡细胞(步骤参照1.6),免疫印迹法检测C-Caspase-3、C-Caspase-12、CHOP蛋白表达(步骤参照1.7)。
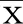
2 结 果
2.1 Pitx2过表达载体对缺氧诱导的心肌细胞中Pitx2表达的影响 与对照组比较,模型组心肌细胞Pitx2 mRNA和蛋白水平均降低(P<0.05);与Vector组比较,Pitx2组心肌细胞Pitx2 mRNA和蛋白水平均升高(P<0.05)。提示Pitx2过表达载体提高缺氧条件下心肌细胞中Pitx2表达水平。详见图1、表1。
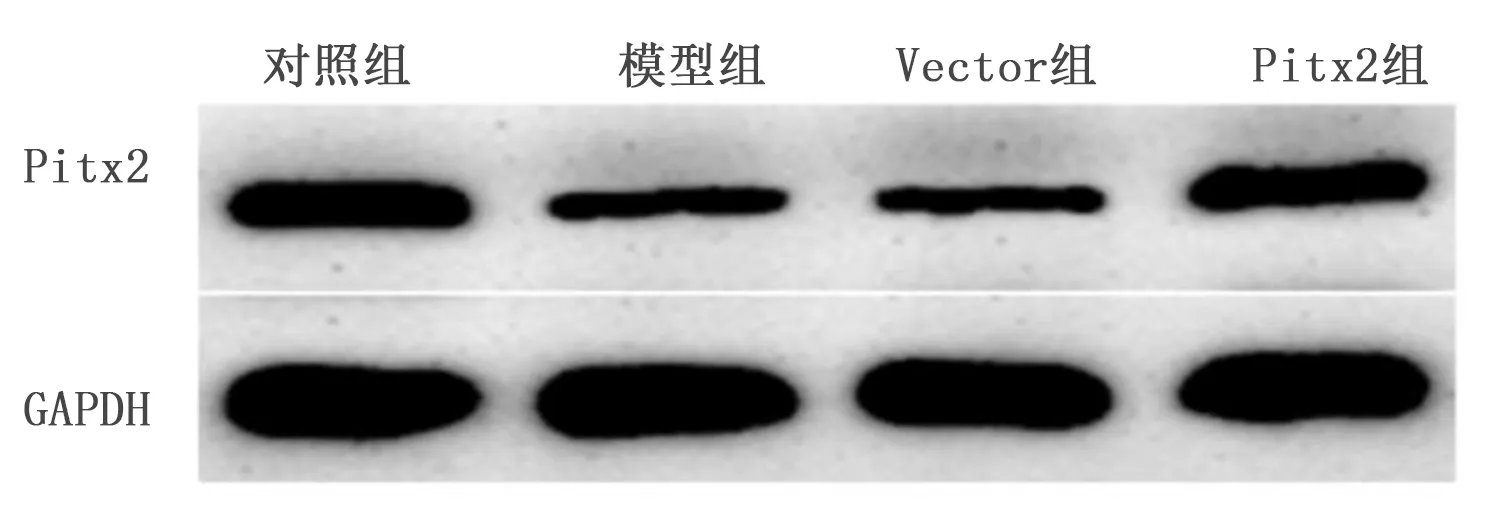
图1 Pitx2过表达载体转染后缺氧诱导的心肌细胞中Pitx2蛋白表达条带图

表1 Pitx2过表达载体转染后缺氧诱导的心肌细胞中Pitx2 mRNA和蛋白水平(±s)
2.2 上调Pitx2对缺氧诱导的心肌细胞凋亡的影响 与对照组比较,模型组心肌细胞存活率降低,细胞凋亡率升高,细胞C-Caspase-3、C-Caspase-12蛋白表达水平均提高(P<0.05);与Vector组比较,Pitx2组心肌细胞存活率升高,细胞凋亡率降低,细胞C-Caspase-3、C-Caspase-12蛋白表达水平均降低(P<0.05)。提示上调Pitx2可提高缺氧条件下心肌细胞增殖能力,减少细胞凋亡。详见图2、表2。

图2 上调Pitx2对缺氧诱导的心肌细胞凋亡和C-Caspase-3、C-Caspase-12蛋白表达的影响(A为心肌细胞凋亡的流式细胞图;B为C-Caspase-3、C-Caspase-12蛋白表达条带图)

表2 上调Pitx2后缺氧诱导的心肌细胞存活率、凋亡率和C-Caspase-3、C-Caspase-12蛋白表达水平比较(±s)
2.3 上调Pitx2对缺氧诱导的心肌细胞内质网应激相关蛋白CHOP表达影响 与对照组比较,模型组心肌细胞CHOP蛋白表达水平增高(P<0.05);与Vector组比较,Pitx2组心肌细胞CHOP蛋白表达水平降低(P<0.05)。提示上调Pitx2抑制缺氧条件下心肌细胞CHOP表达。详见图3、表3。

图3 上调Pitx2对缺氧诱导的心肌细胞中CHOP蛋白表达影响的条带图

表3 上调Pitx2后缺氧诱导的心肌细胞CHOP蛋白水平比较(±s)
2.4 CHOP过表达载体对上调Pitx2的缺氧心肌细胞CHOP蛋白表达的影响 与Pitx2+NC组比较,Pitx2+CHOP组心肌细胞CHOP蛋白表达水平升高(P<0.001)。提示CHOP过表达载体促进Pitx2缺氧心肌细胞CHOP蛋白表达。详见图4、表4。

图4 CHOP和Pitx2过表达载体共转染对缺氧诱导的心肌细胞CHOP蛋白表达影响的条带图

表4 CHOP和Pitx2过表达载体共转染后缺氧诱导的心肌细胞CHOP蛋白水平比较(±s)
2.5 CHOP对上调Pitx2的缺氧心肌细胞增殖和凋亡影响 与Pitx2+NC组比较,Pitx2+CHOP组心肌细胞存活率降低,凋亡率升高,C-Caspase-3、C-Caspase-12蛋白表达增多(P<0.001)。提示上调CHOP可逆转Pitx2的保护作用。详见图5、表5。
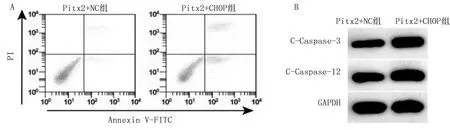
图5 CHOP和Pitx2过表达载体共转染对缺氧诱导的心肌细胞凋亡和C-Caspase-3、C-Caspase-12蛋白表达的影响(A为心肌细胞凋亡检测的流式细胞图;B为C-Caspase-3、C-Caspase-12蛋白表达的条带图)

表5 CHOP和Pitx2过表达载体共转染后缺氧诱导的心肌细胞存活率、凋亡率和C-Caspase-3、C-Caspase-12蛋白水平比较(±s)
3 讨 论
缺血性心脏病是临床常见的心血管系统疾病,缺血条件下,心肌细胞增殖能力降低,细胞凋亡增加,导致心肌组织完整性受损,引起心肌损伤,体外缺氧心肌细胞模型是常见的缺血心肌损伤的研究模型。缺氧条件下,细胞增殖能力降低,细胞凋亡水平升高[10]。本研究结果显示,缺氧处理后的心肌细胞存活率降低,细胞凋亡率增高,说明成功构建了缺氧心肌细胞损伤模型。
Pitx2是一种重要的转录因子,是Pitx家族中的成员之一[11]。Pitx2蛋白是同源域蛋白中与二倍体有关的一种亚类,Pitx2氨基酸残基在第三螺旋的第9个位置,在DNA和RNA结合中发挥着决定性作用,C端高度保守[12]。转录因子Pitx2在不同的物种中均有表达,与眼畸形、心血管畸形、垂体异常畸形等有关,在心脏、四肢、眼睛等器官发育中发挥着关键作用[13]。缺失Pitx2的小鼠出现明显的右心房异构且静脉回流受阻,肺组织及窦房结发育受到严重损害[8-9,14]。Pitx2功能增加后的成年小鼠心肌细胞心肌梗死后可再生[8]。敲除Pitx2后的小鼠出现心肌梗死,而恢复Pitx2可有效缓解成熟的心肌细胞免受缺血损伤[9]。Pitx2在心肌组织中发挥保护作用。本研究结果显示,缺氧处理后的心肌细胞Pitx2表达水平下调,而上调Pitx2可提高缺氧条件下心肌细胞增殖能力,减少细胞凋亡,表明Pitx2具有抑制缺氧诱导的心肌细胞凋亡作用,证实了Pitx2在缺氧心肌细胞中的作用。本研究结果与上述研究结果一致,说明Pitx2可能具有保护心肌组织缺氧损伤的作用。
缺氧诱导心肌细胞凋亡是造成缺血性心肌组织损伤的重要原因[15]。有研究表明,内质网应激在缺氧心肌细胞凋亡中发挥着作用[16]。内质网存在于真核细胞内,是与蛋白质折叠、应激反应等有关的细胞器之一,对缺氧、缺血、葡萄糖、ATP耗竭等应激刺激的敏感程度较高,一定程度的内质网应激可以改善内质网功能,而长时间、高强度的内质网应激则诱导细胞凋亡,导致组织损伤发生[17]。介导内质网应激细胞凋亡的关键调节因子之一为CHOP。CHOP是内质网应激中的转录因子,是碱性亮氨酸锌指结构蛋白样转录因子家族中的重要成员之一,在哺乳动物体内广泛存在[18]。机体受到外界因素刺激后,CHOP表达水平增加,内质网应激水平升高,CHOP又可激活Caspase-12,进而诱导Caspase级联反应发生,最终促进凋亡执行因子Caspase-3活化,促进细胞凋亡发生[19-20]。Caspase是与细胞凋亡有关的蛋白家族,其含有多个蛋白成员,分别位于Caspase凋亡反应的上游、中游和下游[21]。Caspase-12和Caspase-3均属于Caspase蛋白家族成员,在正常情况下多以无活性形式存在,只有被激活后形成C-Caspase-12、C-Caspase-3可诱导细胞凋亡的发生[22-23]。本研究结果显示,缺氧促进心肌细胞表达C-Caspase-12、C-Caspase-3、CHOP,而上调Pitx2抑制C-Caspase-12、C-Caspase-3、CHOP蛋白表达,说明上调Pitx2可激活缺氧条件下心肌细胞中内质网凋亡途径。同时结果显示,上调CHOP可逆转Pitx2的保护作用,证实了上调Pitx2影响心肌细胞凋亡,与CHOP有关。
综上所述,Pitx2在缺氧诱导的心肌细胞凋亡中发挥着保护作用,Pitx2在缺血性心肌损伤中可能发挥抑制功能,Pitx2的作用机制与影响CHOP调控内质网应激有关。本研究未详细论述Pitx2通过何种直接或间接靶向机制影响CHOP表达,今后需进一步研究。
