基于肝脏时钟基因bmal1、clock和per2探讨清达颗粒降压的作用机制
2022-01-11褚剑锋王天一鲁竹青王乙连彭美中陈可冀
褚剑锋,王天一,鲁竹青,王乙连,卢 妍,彭美中,彭 军,陈可冀
《内经》记载:“阙,在下者肝也”“肝大则逼胃迫咽,迫咽则苦膈中,且胁下痛”。“阙”指胸廓,“在下”指季肋部,可见,古人已确定肝的位置位于季肋,与胃、食管、膈相邻,现代解剖学与此论述[1]基本一致。中医学认为“肝者,体阴而用阳也,二者一血一气,一阴一阳,互根互用”。“肝主藏血”为阴,“肝主疏泄”为阳,若肝失疏泄则人体气机失调,导致肝气郁结,甚者肝气上逆,化火伤阴,脏腑阴阳失衡,肝阳上亢而出现烦躁易怒、血压升高等症状或体征[2-3]。此理论为从肝论治高血压提供了理论前提,也为平肝潜阳法治疗高血压奠定了论治基础。清达颗粒是由陈可冀院士防治高血压专方清眩降压汤化裁而来,全方由天麻、钩藤、黄芩、莲子心四味药物组成,共奏清肝热、平肝阳、泻心火之功,对高血压病人降压效果显著[4]。本研究采用自发性高血压大鼠(spontaneously hypertensive rats,SHR)模型,观察清达颗粒对血压、心脏功能、血管病理形态及肝脏昼夜节律基因的影响,为探讨清达颗粒的作用机制提供部分生物学基础。
1 材料与方法
1.1 实验动物与分组 Wistar Kyoto(WKY)大鼠8只,SHR 16只,均为雄性,无特定病原体(SPF)级,4周龄,体质量(200±20)g,北京维通利华实验动物技术有限公司提供[实验动物许可证号:SCXK(京)2019-0009],由福建中医药大学实验动物中心代购并饲养[SYXK(闽)2009-0001]。将16只SHR随机分为模型组(SHR组)和清达颗粒组(SHR+QDG组),各8只;8只同周龄Wistar Kyoto大鼠作为空白组(WKY组)。分笼饲养,光照/黑夜各12 h,恒温、恒湿,自由进食、饮水。实验过程均严格按照国际动物保护及使用指南进行。
1.2 主要试剂与仪器 苏木精染色液(北京索莱宝科技有限公司);伊红染色液(北京索莱宝科技有限公司);Masson三色染色试剂盒(北京索莱宝科技有限公司);异氟烷(深圳瑞沃德生命科技有限公司);clock抗体(SAB,33580);per2抗体(ABclonal,A13168);bmal1抗体(Abbkine,ABP53154);即用型免疫组化试剂盒(兔)(福州迈新生物技术开发有限公司);二氨基联苯胺法(DAB)显色试剂盒(×20)(福州迈新生物技术开发有限公司);CODA无创鼠尾血压系统(美国 Kent Scientific公司);DM400B显微镜(德国莱卡仪器有限公司);生物自动脱水机(湖北孝感亚光医用电子技术有限公司);生物组织石蜡包埋机(湖北孝感亚光医用电子技术有限公司);全自动石蜡切片机(德国徕卡仪器有限公司);小动物超声影像系统(加拿大VisualSonics公司);Vevo LAB软件(富士 VisualSonics公司)。
1.3 清达颗粒药液制备 清达颗粒由江阴天江药业有限公司提供。按照临床给药量换算,取清达颗粒(每袋5 g),按0.9 g/(kg·d)加入一定比例生理盐水搅拌震荡至完全溶解。
1.4 干预方法 大鼠在适应性饲养1周后,SHR+QDG组给予清达颗粒0.9 g/(kg·d)灌胃,SHR组和WKY组均给予等体积生理盐水灌胃。每日1次,3组均连续给药10周。每周采用鼠尾无创血压仪器测量大鼠血压,称量体质量。
1.5 鼠尾无创血压测量 首先安装CODA无创鼠尾血压系统,打开电源开关、加热板、电脑Coda软件、连接传感器装置等。根据室温选择合适的加热档及加热时间,将大鼠固定器置于加热板上进行预热,按每组每轮8只大鼠诱导其钻进固定器,并将合适的尾袖套在大鼠尾巴根部,让大鼠稳定5 min,设置电脑的CODA软件,每只大鼠预测试5次,正式测定10次,循环3次,测量开始并记录合格的血压数据。
1.6 心脏超声与脉冲波检查 实验结束时,大鼠在异氟烷吸入麻醉下,将小动物超声探头MS250置于胸骨左缘,对大鼠进行超声心动图与脉冲波检查,通过M型心动图测量大鼠形态学和功能参数,包括室间隔厚度(IVS)、左室后壁厚度(LVPW)、左室收缩末期容积(LVESV)、左室舒张末期容积(LVEDV)、左室收缩末期内径(LVESD)、左室舒张末期内径(LVEDD)、左室射血分数(LVEF)和左室短轴缩短率(LVFS)。LVEF和LVFS通过Vevo LAB软件计算得出:LVEF(%)=[(LVEDV-LVESV)/LVEDV]×100%,LVFS(%)=[(LVEDD-LVESD)/LVEDD]×100%。所有超声心动图参数取连续3个心动周期平均值。
1.7 取材及实验指标检测 干预10周后,大鼠采用异氟烷麻醉并处死,收集腹主动脉血样,分离血清,将其保存在-80 ℃下进行后续实验。取出心脏,冰上剔除大血管与结缔组织,剥离腹主动脉并分离为3部分,将肝脏左外叶的左侧和右侧两部分及腹主动脉的其中两部分置于-80 ℃保存用于分析,其余部分固定在4%多聚甲醛中,用于苏木精-伊红(HE)染色和Masson染色。
1.8 肝脏转录组测序 使用Illumina公司的NEBNext Ultra RNA Library Prep Kit构建测序库。用RNase抑制剂和ProtoScript Ⅱ Reverse合成互补DNA(cDNA)第一链。样品在PTC-225 Peltier热循环器中培养,在25 ℃下10 min,在42 ℃下15 min,在70 ℃下15 min,在4 ℃下保持。第二链的cDNA合成使用第二链合成反应缓冲液和第二链合成酶混合,并在PTC-225 Peltier热循环器中16 ℃孵育1 h。之后使用1.8X agcourt AMPure XP Beads对双链DNA进行纯化,最后制备cDNA文库。进行PCR扩增。采用QUBIT DNA HS Assay Kit对聚合酶链式反应产物进行准确定量。采用2100生物分析仪芯片对文库质量进行评价。转录组文库在Illumina测序平台上测序。利用FastQC软件对测序5′-3′的碱基质量进行分析,并对测序数据中的碱基含量进行测量。对原始测序结果进行过滤,得到适合下游数据分析的高质量序列。
1.9 实时荧光定量聚合酶链式反应(RT-qPCR) 采用RT-qPCR检测肝脏组织bmal1、clock和per2 mRNA表达水平。使用Trizol试剂对肝脏组织进行裂解,提取肝脏组织RNA,采用NanoDrop 2000分光光度计测量260 nm和280 nm处的吸光度比,定量测定提取的RNA。采用PrimeScript RT reagent Kit 合成cDNA,并使用SYBR Green qPCR Master Mix进行qPCR。目的基因mRNA相对表达量归一化至管家基因(GAPDH),并采用比较Ct法和公式2-△△CT进行定量。引物序列如下:GAPDH正向引物序列5′-3′TATGTCGTGGAGTCTACTGGCG,反向引物序列5′-3′ATGAGCCCTTCCACGATGC;bmal1正向引物序列5′-3′CACAGGATAAGAGGGTCATCAC,反向引物序列5′-3′CGGAAGGAATGTCTGGAGTC;per2正向引物序列5′-3′GCAACGGGGAGTACATCACA,反向引物序列5′-3′GTGCGGAGTCTTCTCCTCTG;clock正向引物序列5′-3′CACTCAGGACAGACAGATAAGGT,反向引物序列5′-3′GCTGCTGTTGCTGTGTTACT。
1.10 免疫组织化学法 将新鲜大鼠部分肝脏组织置于4%多聚甲醛固定24 h,之后采用75%乙醇室温下浸泡。常规脱水、包埋,制作石蜡切片,脱蜡入水后,以柠檬酸法进行抗原修复,按照免疫组化试剂盒步骤进行下一步操作,阻断内源性过氧化物酶封闭10 min,配制bmal1、clock和per2一抗(bmal1为1∶100;clock为1∶200;per2为1∶100),4 ℃低温过夜孵育,次日孵育酶标聚合抗兔IgG二抗,链霉菌抗生物素蛋白孵育1 h,过氧化物酶孵育1 h,DAB染色,苏木精复染色,最后晾干封片。所有切片采用光学显微镜进行放大400倍检查,每个切片随机选取6张图分析clock、bmal1、per2蛋白的表达情况。利用显微镜图像分析软件Motic MED 6.0图像分析软件计算阳性表达率。
2 结 果
2.1 清达颗粒对SHR血压及体质量的影响 第0周起(除第1周外),SHR组与WKY组收缩压、舒张压及平均动脉压比较,差异均有统计学意义(P<0.05),提示高血压模型可靠。清达颗粒灌胃第2周起,与SHR组比较,SHR+QDG组收缩压、平均动脉压上升幅度均受到抑制(P<0.05);给药3周后,与SHR组比较,SHR+QDG组舒张压下降(P<0.05)。提示清达颗粒可明显降低SHR血压。详见图1。

SHR组与WKY组比较,*P<0.05;SHR+QDG组与SHR组比较,#P<0.05。图1 清达颗粒对SHR血压及体质量的影响(A为收缩压;B为舒张压;C为平均动脉压;D为体质量。1 mmHg=0.133 kPa)
2.2 清达颗粒对SHR超声心动图指标和腹主动脉脉冲波传导速度的影响 给药第10周结束,通过小动物超声对大鼠进行超声心动图及腹主动脉脉冲波检查,结果显示:与WKY组比较,SHR组大鼠LVEF和LVFS降低(P<0.05),腹主动脉脉冲波传导速度升高(P<0.05);与SHR组比较,SHR+QDG组大鼠LVEF、LVFS升高和腹主动脉脉冲波传导速度降低(P<0.05)。提示清达颗粒可改善SHR心脏和腹主动脉功能。详见图2。

SHR组与WKY组比较,*P<0.05;SHR+QDG组与SHR组比较,#P<0.05。图2 清达颗粒对SHR超声心动图、腹主动脉脉冲波传导速度的影响(A为各组超声心动图图像;B为LVEF;C为LVFS;D为腹主动脉脉冲波传导速度)
2.3 清达颗粒对SHR腹主动脉病理形态及血管纤维化的影响 HE染色观察显示:与WKY组比较,SHR组腹主动脉内膜明显增厚,内膜结构紊乱,内皮细胞排列不完整;与SHR组比较,SHR+QDG组腹主动脉内膜结构、厚度均有所改善。提示清达颗粒可减轻SHR腹主动脉病理改变。Masson染色观察显示:与WKY组比较,SHR组腹主动脉壁胶原纤维增多;与SHR组比较,SHR+QDG组腹主动脉壁纤维化程度减轻。提示清达颗粒可明显减轻SHR腹主动脉血管纤维化。详见图3。
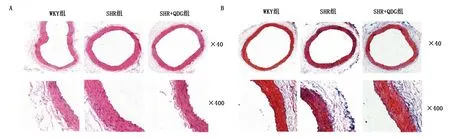
图3 清达颗粒对SHR腹主动脉血管病理形态及血管纤维化的影响(A为HE染色图;B为Masson染色图)
2.4 清达颗粒对SHR肝脏组织病理形态的影响 WKY组肝小叶结构完整,肝细胞排列成条索状,以中央静脉为中心向四周放射状排列,肝细胞轮廓清晰,未见脂肪变性和炎细胞分布;SHR组肝小叶结构被破坏,小叶间可见大量粗条状结缔组织增生,肝细胞肿胀坏死;SHR+QDG组肝脏病变明显减轻。详见图4。

图4 清达颗粒对SHR肝脏组织病理形态的影响(×400)
2.5 全基因组基因表达谱分析 通过转录组测序比较各组肝脏组织中差异表达基因分析(DEGs),并根据DEGs绘制聚类图(见图5A、5B)和火山图(见图5C、图D),以便较好地显示DEGs分布情况。结果显示,与WKY组比较,SHR组中有936个DEGs显著表达,其中512个基因显著上调,424个基因显著下调。与SHR组比较,SHR+QDG组中有365个DEGs显著表达,其中155个基因显著上调,210个基因显著下调。SHR组有107个重叠基因表达上调,清达颗粒处理后表达下调(见图5E)。SHR组有63个重叠基因下调,清达颗粒处理后上调(见图5F)。SHR组上调和清达颗粒处理后下调前5个基因的信息见表1。SHR组下调基因和SHR+QDG组上调基因居前5位的信息见表2。

图5 清达颗粒对SHR的DEGs影响(A为SHR组比WKY组聚类图;B为SHR+QDG组比SHR组聚类图;C为SHR组比WKY组火山图;D为SHR+QDG组比SHR组火山图;E、F为各组DEGs的交集)

表1 SHR组上调和SHR+QDG组下调的基因信息(居前5位)

表2 SHR组下调和SHR+QDG组上调的基因信息(居前5位)
2.6 基因本体(GO)、京都基因与基因组百科全书(KEGG)富集分析 GO功能富集分析主要从生物过程(BP)、细胞组成(CC)、分子功能(MF)等方面对生物靶标进行分析。图6A和6B显示丰富的GO项。对SHR组与WKY组和SHR+QDG组进行了交叉分析,得到了3 315种常见的生物过程(见图6C)、321种常见的细胞成分(见图6D)和555种常见的分子功能(见图6E)。结果表明,富集基因主要表现在小分子代谢、多细胞生物发育、细胞对化学刺激、有机物质的反应、对脂质、激素、应激的反应等。同时进行了KEGG通路富集分析,进一步探讨了QDG治疗高血压的病理机制,并鉴定了SHR组与WKY组和SHR+QDG组与SHR组功能相关的基因通路。图7A和图7B显示KEGG富集显著的前30个信号通路。其中,SHR组与WKY组和SHR+QDG组与SHR组有206条重叠信号通路(见图7C)。其中Circadiam rhythm信号通路最丰富。

图6 GO功能富集分析(A、B为GO富集分析;C为BP;D为CC;E为MF)

图7 KEGG通路富集分析(A为SHR组和WKY组;B为SHR+QDG组与SHR组;C为重叠信号通路)
2.7 RT-qPCR RT-qPCR结果显示,与WKY组比较,SHR组肝脏组织bmal1 mRNA表达上调(P<0.05);与SHR组比较,SHR+QDG组抑制了这种上调(P<0.05)。各组间clock mRNA表达比较,差异无统计学意义(P>0.05)。与WKY组比较,SHR组肝脏组织per2 mRNA表达明显下调(P<0.05);与SHR组比较,SHR+QDG组QDG处理抑制了这种下调(P<0.05)。详见图8。

图8 qPCR检测肝脏组织bmal1、clock和per2的mRNA表达(A为bmal1 mRNA;B为clock mRNA;C为per2 mRNA)
2.8 免疫组织化学法 免疫组织化学法检测肝脏组织bmal1、clock和per2蛋白表达情况。与WKY组比较,SHR组bmal1和clock蛋白表达比较,差异无统计学意义(P>0.05);与SHR组比较,SHR+QDG组bmal1和clock蛋白表达比较,差异无统计学意义(P>0.05)。与WKY组比较,SHR组per2蛋白表达下调(P<0.05);与SHR组比较,SHR+QDG组per2蛋白表达上调(P<0.05)。详见图9。

图9 免疫组化检测各组大鼠肝脏组织bmal1、clock和per2蛋白表达(×400)(A为bmal1;B为clock;C为per2)
3 讨 论
《十四经发挥》记载:“肝之为脏,左三叶,右四叶,凡七叶,其治在左。其脏在右胁右肾之前,并胃著脊之第九椎”,并以《脏腑名堂图》描述了肝脏在人体的具体位置,对肝的形态位置与毗邻关系进行了记载,中医学与现代解剖学的肝脏位置相同[5]。
“肝藏血,主疏泄”概括了中医学中肝脏的功能,一方面,肝脏贮藏血液,调节全身血液流动;另一方面,肝脏调畅气机,促进津血的运行和代谢,促进脾胃的运化及调节生殖机能等。中医学认为导致高血压的内因多为年老体虚、阴阳失衡、先天禀赋不足、后天失调,外因多为起居无常、饮食不节、情志刺激、劳逸失度[6]。这些病因从不同角度影响肝脏正常的生理功能,如长期的情志失调、抑郁恼怒,致使肝失疏泄,肝气郁结,郁结日久而化火,导致肝阳上亢,形成本虚标实之证,出现血压升高的临床症状;饮食不节,嗜食肥甘厚味之物,导致脾胃运化失常,内生痰湿之邪,阻碍人体津血正常的运行和代谢,进一步扰乱肝气运行,血压升高同时多伴有头重、昏蒙的临床症状[7]。可见,“肝藏血主疏泄”的功能与高血压发病密切相关。
现代医学对高血压的病因多归于遗传因素、饮食、吸烟、精神应激等环境因素,其中,精神应激、饮食与中医学所言情志失调、饮食不节等不谋而合。现代社会生活节奏日益加快,人们承受的心理压力日渐加大,随之出现高血压病人数量呈快速增多的趋势[7],研究人员开始关注精神应激和高血压发病之间的关系。有研究通过对老年原发性高血压病人研究发现,高血压发病与焦虑、抑郁、低社会支持及高应激状态等不良情绪存在相关性[8]。宁亮等[9]认为心理情绪障碍是原发性高血压发生的独立危险因素之一,可增加高血压相关心脑血管事件发生率。从肝藏血、主疏泄、调畅情志的功能出发,采用清肝热、平肝阳、恢复肝脏正常生理功能的中药成方是治疗高血压病的公认思路。
清达颗粒是在清眩降压汤基础上的简化配方,由天麻、钩藤、黄芩、莲子心4味中药组成,全方共奏清肝热、平肝阳之效。相关研究表明,清达颗粒通过促进血管舒张降低SHR血压,还可抑制核转录因子-κB通路,从而减轻心脏重构和炎症[10-11]。本研究采用SHR模型,发现清达颗粒可降低SHR血压,改善心脏收缩功能,减轻动脉血管重构同时调控SHR肝脏昼夜节律基因的表达。
根据肝脏转录组测序分析结果发现,SHR组与WKY组和SHR+QDG组与SHR相比,GO功能分析表明富集基因主要表现在小分子代谢、多细胞生物发育、细胞对化学刺激、有机物质的反应、对脂质、激素、应激的反应等方面。KEGG通路富集分析,发现Circadiam rhythm信号通路最为丰富。生物过程和功能,如血压的调控等呈时间节律性,是由下丘脑视交叉上核(SCN)中的遗传主时钟控制的,时钟基因per1、per2、per3、bmal1、clock及cry及其基因产物的节律性活动构成了中枢节律维持机制[12]。有研究显示,对生物钟成分的遗传操作,如clock和bmal1,人类生物钟基因per3的串联重复变异及内皮细胞或血管平滑肌细胞内生物钟的遗传消融,显著减弱甚至消除了心律或血压的昼夜节律,影响机体自身昼夜节律的稳定[13-15]。可见,昼夜节律与高血压呈一定的相关性,调控肝脏昼夜节律基因的表达可调控血压。本研究结果显示,清达颗粒降低血压同时可调控肝脏组织bmal1和per2 mRNA表达,二者的作用机制需进一步探讨。
综上所述,清达颗粒能降低血压,改善心脏收缩功能,减轻动脉血管重构,调控肝脏昼夜节律基因的表达。清达颗粒降血压的机制可能与清肝热、平肝阳,使肝主疏泄的功能恢复正常,调控肝脏昼夜节律基因表达有关,肝脏昼夜节律基因表达的改变可能是清达颗粒的药效机制或相关成分的靶点,为从肝论治高血压奠定了部分生物学基础。
