苯酚和喹啉降解菌Alcaligenes faecalis的降解特性及固定化应用
2022-01-11赵乾程苏凯文邱子梁王庆宇于彩虹
赵乾程苏凯文邱子梁王庆宇于彩虹
中国矿业大学(北京)化学与环境工程学院,北京 100083
苯酚及其衍生物是煤焦化、石油化工、医药、印染、造纸、农药等行业废水中常见的污染物;喹啉是一种含氮杂环化合物,为染料、冶金、油漆、除草剂、制药和橡胶工业的重要原料[1]。二者也是焦化废水组分中比例较高的两类污染物。针对二者的单基质生物降解研究中已发现了较多的菌株,如Acinetobactersp.[2]、Candida tropicalis[3]、Rhodococcus[4]、Chlorellasp[5]、Stenotrophomonassp. 和Advenellasp.[6]、Debaryomycessp.[7]等能降解苯酚;Pseudomonas putida[8]、Pseudomonas aeruginosa[9]、Ochrobactrumsp.[10]、Bacillussp.[11]、Burkholderia pickettii[12]等可以降解喹啉。而实际废水含有的污染物种类较多,单基质污染物降解菌在实际应用中受限。因此,研究双基质条件下,降解菌对2 种或以上污染物的降解作用更具有现实意义,但目前以苯酚和喹啉双基质污染物为底物的降解菌筛选和代谢的研究相对较少。
除了菌株本身特性外,微生物降解有机物污染物时的效果会受到许多因素的影响,如环境条件(pH、温度、含氧量)、碳源、氮源和底物浓度等。微生物法处理工业废水时,微生物的流失量较大,严重影响了废水中污染物的降解效果,并且在多批次连续反应后降解能力迅速下降。研究表明,与游离细胞相比,将降解污染物的微生物固定在不同的载体上可以增大单位体积内微生物的浓度,减少微生物的流失量,并且能提高降解效果、增加可持续性和可重复使用性[13-14]。本研究从焦化废水的污泥中分离出1 株能同时降解苯酚和喹啉的菌株,探讨该菌株在不同条件对苯酚和喹啉的降解的影响和降解过程的动力学参数,考察了外加碳源和氮源对共基质污染物降解的影响,分析了不同固定化载体尤其是集包埋与吸附为一体的新型固定化载体对降解的影响。研究结果能为共基质难降解焦化废水的生物处理提供应用参考。
1 材料与方法
1.1 培养基
牛肉膏蛋白胨培养基(富集培养基):牛肉膏3 g/L、蛋白胨10 g/L、NaCl 5 g/L。
无机盐培养基(驯化培养基):NaCl 1.0 g/L、K2HPO4·3H2O 0.79 g/L、MgSO4·7H2O 0.2 g/L、微量元素1 mL/L。根据需要添加苯酚和喹啉,于121 ℃高压灭菌20 min。
唯一碳源培养基:NaCl 1.0 g/L、K2HPO4·3H2O 0.79 g/L、MgSO4·7H2O 0.2 g/L、NH4NO31 g/L、微量元素1 mL/L。根据需要添加苯酚。
1.2 菌种的富集、驯化和分离
污泥样品取自某焦化厂二沉池,污泥样品按照5%的接种量接种于含100 mg/L 苯酚和50 mg/L 喹啉的富集培养基中,置于转速为150 r/min 的振荡器中30 ℃恒温培养3 d。培养期间转移至驯化培养基中逐步提高苯酚和喹啉的浓度,至溶液中两者浓度分别达到500 mg/L 和250 mg/L,进行菌株分离。通过逐级稀释涂布在固体培养基中倒置培养,并对单菌落进行划线,筛选出对苯酚和喹啉双基质污染物降解能力高的一株单菌并进行保存。
1.3 菌株的鉴定
1.3.1 形态及生理生化鉴定
(1) 待平板上长出肉眼可分辨的单个菌斑后挑取单菌落制片,并通过光学显微镜观察菌株细胞的形态特征。
(2) 按照细菌常规生理生化鉴定方法[15],对纯化后的菌株进行革兰氏染色、过氧化氢酶、糖的利用、淀粉水解和明胶水解鉴定。
1.3.2 16S rDNA 鉴定
使用Solarbio 细菌基因组DNA 提取试剂盒提取菌株的基因组DNA,利用16S rDNA 基因通用引物27F(5 -AGAGTTTGATCCTGGCTCAG-3’) 和1492R(5-GGCTACCTTGTTACGACTT-3’ )进行PCR 扩增。扩增产物由上海生工生物工程技术服务有限公司测序,测得的序列通过Blast 程序与Genbank 中已知菌株的序列进行比对分析,并利用MEGA7.0 构建系统发育树。
1.4 培养条件对喹啉和苯酚双基质降解的影响
将菌株在100 mL 富集培养基中富集24 h,待OD600约为1.2 时取菌液在10 000 r/min 条件下离心10 min,弃去上清液,用无菌水洗涤、沉淀菌体,使之重悬后再次离心,重复操作2 次后按照以下4个条件进行优化实验,其中上一步得出的最佳条件为下一步使用,并逐步提高喹啉和苯酚的浓度:菌体接种量分别为5% 、8% 、10% 、15% ,接种在含有100 mg/L 苯酚和50 mg/L 喹啉培养基中;接种在初始pH 值分别为6、7、8、9、10 的含有200 mg/L 苯酚和100 mg/L 喹啉培养基中;设定培养温度为25 ℃、30 ℃、35 ℃、40 ℃、45 ℃,接种在含有300 mg/L 苯酚和150 mg/L 喹啉的培养基中;调节振荡器转速为50 r/min、70 r/min、150 r/min、200 r/min,接种在300 mg/L 苯酚和150 mg/L 喹啉的培养基中。每组设置3 个平行实验,24 h 后取样,分别采用4-氨基安替比林分光光度法[16]和紫外分光光度法[17]测定苯酚和喹啉的浓度。
1.5 外加碳源和氮源对菌株降解苯酚和喹啉的影响
用100 mg/L 的葡萄糖和200 mg/L 硝酸铵作为外加碳源和氮源,分别添加到含有500 mg/L 的苯酚单基质培养基、400 mg/L 喹啉单基质培养基以及含有300 mg/L 苯酚和150 mg/L 喹啉的双基质培养基中,在最佳条件下恒温振荡培养60 h,定时取样测定苯酚和喹啉的浓度。
1.6 菌株降解苯酚和喹啉的降解特性
以10%的接种量,接种在不同浓度(100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L、600 mg/L、700 mg/L、800 mg/L、900 mg/L)的苯酚单基质和不同浓度(50 mg/L、80 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L)的喹啉单基质培养基中,调节初始pH 值均为7.0,在35 ℃、150 r/min 转速条件下进行振荡培养,每隔一定时间取样测定菌的生长情况(OD600)以及苯酚和喹啉的浓度。采用Haldane 底物抑制模型[18]对菌株KD1 在降解苯酚和喹啉时的比生长速率进行描述,其方程如下:

式中,μ为比生长速率,h-1;μm为最大比生长速率,h-1;Cs为初始底物浓度,mg/L;Ks为生长动力学的半饱和系数,mg/L;Ki为生长动力学的抑制系数,mg/L。
1.7 固定化作用下菌株对苯酚和喹啉的降解
1.7.1 固定化载体的筛选
(1) 凝胶小球的制备。称取适量的聚乙烯醇和海藻酸钠,在90 ℃水浴加热条件下不停搅拌使其完全溶解于100 mL 的蒸馏水中。对凝胶态混合液进行灭菌,冷却30 ~40 ℃时加入10 mL 菌悬液,混合均匀后滴入含有20 g/L 的CaCl2饱和硼酸溶液中,形成体积大小均匀的小球,室温下交联1 h后转移到0.5 mol/L 的Na2SO4溶液中,置于冰箱内低温(4 ℃)继续交联12 h。室温下分别用生理盐水、蒸馏水和磷酸缓冲液(50 mmol/L,pH 值7.0)反复冲洗后浸泡在磷酸缓冲液中,置于室温下保存,以备后用。
(2) 凝胶活性炭的制备。在聚乙烯醇和海藻酸钠溶解后加入1 g 活性炭。其他步骤同凝胶小球。
(3) 用玉米芯、海绵、凝胶小球、凝胶活性炭为载体,以不添加菌液为对照,将不同载体固定的菌体和游离菌体分别加入到含400 mg/L 的苯酚和250 mg/L 的喹啉无机盐培养基中进行培养。每隔12 h 测定溶液中苯酚和喹啉的浓度,考察游离菌和用不同载体固定后的菌株对降解苯酚和喹啉双基质的影响。
1.7.2 花生壳活性炭凝胶小球的固定化作用比较
采用微波辐照磷酸活化法[19]制备花生壳活性炭、传统活性炭,并制作二者的凝胶小球,分别加入到500 mg/L 的苯酚和300 mg/L 的喹啉双基质培养基中,以游离菌为对照进行培养,定时取样测定苯酚和喹啉的浓度。
2 结果与分析
2.1 菌株的鉴定
将经过逐步提高苯酚和喹啉浓度驯化、分离,筛选出的菌株命名为KD1。菌株KD1 在平板上的菌落颜色呈深黄色,菌体光滑湿润,为短杆菌,具有周鞭毛,其生理特征见表1。菌株KD1 为好氧的革兰氏阴性菌,能利用葡萄糖但不能水解淀粉,生理代谢过程会产生过氧化氢酶,并且能水解明胶。

表1 KD1 的生理生化特性Tab.1 Physio-biochemical characteristics of KD1
将所得菌株 KD1 ( Genbank 登录号:MW221361)的16S rDNA 序列结果通过在线Blast程序与Genbank 中核酸数据进行比对,用软件MEGA7.0 建立系统发育树(图1)。根据比对结果,菌株KD1 与Alcaligenes faecalis(KF641858,粪产碱菌)相似性在99% 以上,表明二者属于同一菌种。

图1 菌株KD1 的系统发育分析树Fig,1 Phylogenetic tree of strain KD1
2.2 不同条件对菌株KD1 降解苯酚和喹啉的影响
不同接种量、pH 值、温度和振荡器转速条件下菌株对苯酚和喹啉的降解效果如图2 所示。除了pH 值外,其他3 个条件对菌株KD1 降解苯酚和喹啉的影响基本一致。
由图2(a)可知,随着接种量升高,苯酚和喹啉的降解率逐渐提高然后稳定,接种量达到10% ,苯酚降解率达到100% ,喹啉的降解率达到80% 左右。这是由于低菌体接种量时底物浓度相对较高,菌体生长受到抑制[20],而增加接种量能提高菌群对底物毒性的耐受。与低接种量相比,菌体经过相同培养时间后达到对数期和稳定期的细菌数量多,能加快对污染物的降解。
由图2(b)可知,在较大pH 值范围(6 ~9)内菌株KD1 对苯酚的降解均保持在90% 以上,说明菌株有较大的pH 值适用性,能较好地适应酸碱的变化,在实际废水处理系统中可以耐受较大的酸碱负荷冲击[21],而在低pH 值下喹啉的降解会受到影响,可能是降解喹啉的过程中产生了酸性的中间产物[22],产酸过程会引起微生物表面电荷分布的变化[23],进而影响对喹啉的吸收和利用。
由图2(c)可知,菌株KD1 在温度为30 ~35 ℃时对苯酚和喹啉的降解效果较好,这与大多数降解菌株一致[24-25];当温度超过40 ℃时,二者的降解率均开始下降,这是由于代谢过程所需的酶因高温失活而变性[26]。在工程实践中尤其是夏季高温时,可能会影响工艺的效果。
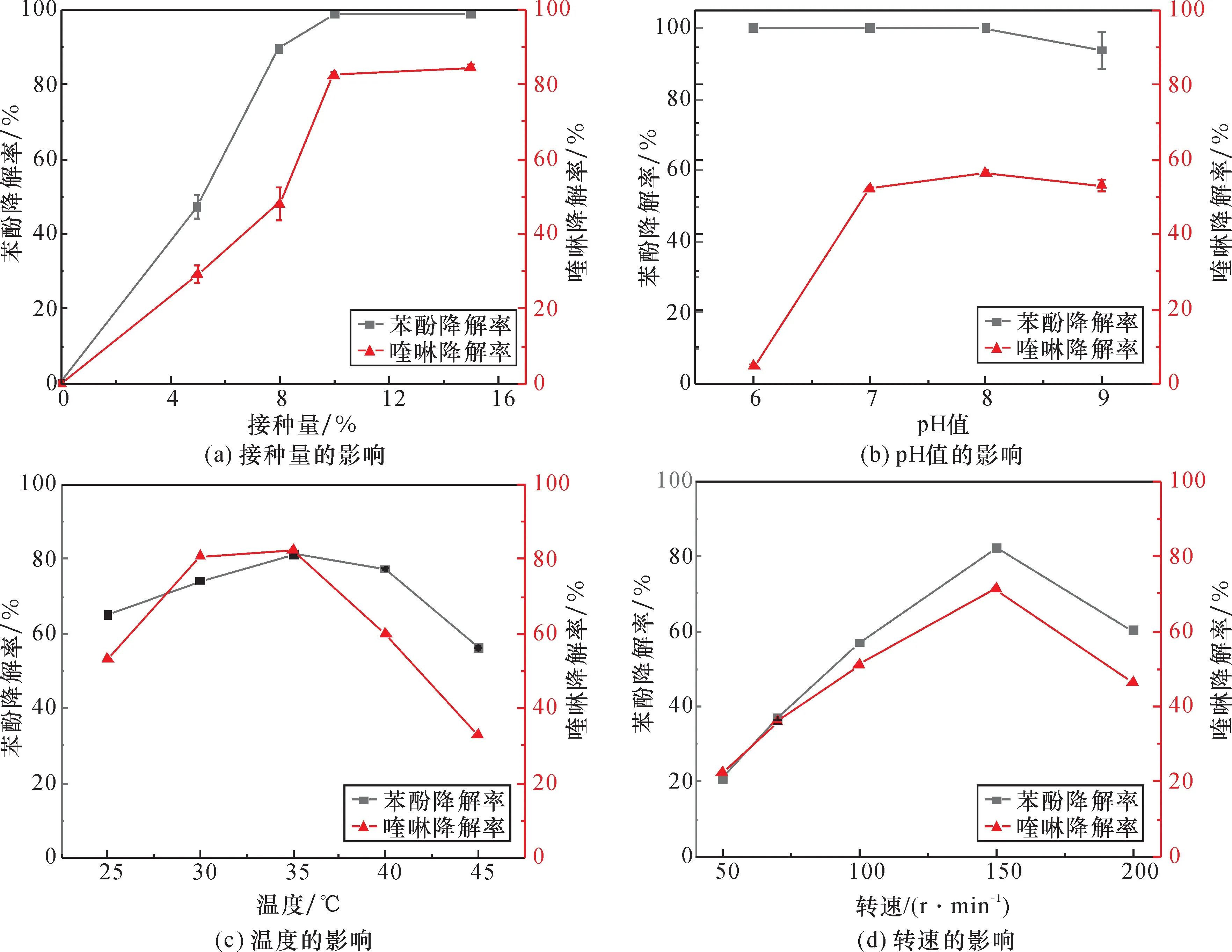
图2 不同条件对KD1 降解苯酚和喹啉的影响Fig.2 Effects of different factors on degradation of phenol and quinoline by KD1
由图2(d)可知,菌株KD1 对苯酚和喹啉的降解率随着振荡器转速的提高先逐渐升高而后降低。当转速为150 r/min 时,对苯酚的降解率达到90% ,并且对喹啉的降解率达到了70% ;进一步提高转速后,苯酚和喹啉的降解率没有提高反而降低。这是由于KD1 对苯酚和喹啉的降解属于好氧反应,提高振荡转速能增加培养基中的溶解氧量[27],但过高的振荡速度会产生较大的切向力,不利于菌体的生长。
2.3 外加碳源和氮源对降解的影响
2.3.1 对降解苯酚和喹啉单基质的影响
外加碳源和氮源对菌株KD1 降解苯酚的影响如图3(a)所示。无外加氮源时,苯酚降解率几乎不随时间变化,降解率较低;外加氮源时,菌株KD1 对苯酚的降解率呈线性升高趋势,表明氮源能制约苯酚降解,这是由于苯酚的分子结构中不含N 原子,不能作为微生物生长所需的N 源。通常,煤化工废水中氮含量为200 mg/L,在实际应用中不会因氮源的缺失而影响苯酚的降解。外加氮源条件下,无外加碳源时KD1 对苯酚的降解率最高,48 h 内能将500 mg/L 的苯酚完全降解,说明菌株KD1 能以苯酚为碳源进行生长;而外加碳源时能缩短降解过程的迟缓期,但会影响苯酚的最终降解率。
外加碳源和氮源对喹啉降解的影响如图3(b)所示。无外加碳源和氮源时,菌株KD1 在60 h 对400 mg/L 喹啉的降解率达到91% ,说明菌株KD1能以喹啉作为生长的碳源和氮源;添加碳源和氮源时,喹啉的降解率在各个时间均最低,说明KD1 菌株会优先利用外加的碳源和氮源作为生长的能源物质;无添加碳源或氮源时,菌株对喹啉的降解率较高,并且以喹啉为碳源时喹啉的降解率更高。
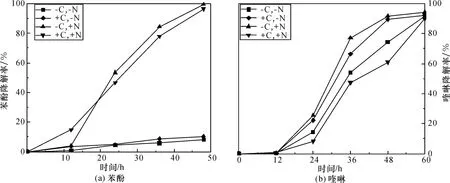
图3 外加碳源氮源对KD1 降解苯酚和喹啉单基质的影响Fig.3 Effect of carbon and nitrogen on degradation of phenol (a)and quinoline (b)by KD1 respectively
2.3.2 降解苯酚和喹啉共基质的影响
KD1 在外加碳源、氮源相互作用下对共基质污染物的降解如图4 所示。无外加碳源和氮源时,KD1 在48 h 内能完全降解300 mg/L 的苯酚,对150 mg/L 喹啉的降解率达到90% 。苯酚的降解过程需要外加氮源,由于喹啉可以作为菌株KD1 生长所需的氮源从而起到了协同降解作用。同时添加碳源和氮源时,能促进菌株KD1 对两种污染物的降解,极大缩短了降解时间,24 h 内就达到最大降解率,与不添加碳源和氮源时相比,降解率提高约10 倍。只添加氮源时,菌株KD1 能够在36 h 内完全降解苯酚,对喹啉的降解率约为90%;只添加碳源时,苯酚的降解率为50%,喹啉的降解率为40%,这说明添加氮源比添加碳源更能促进菌株KD1 对苯酚和喹啉共基质污染物的降解。
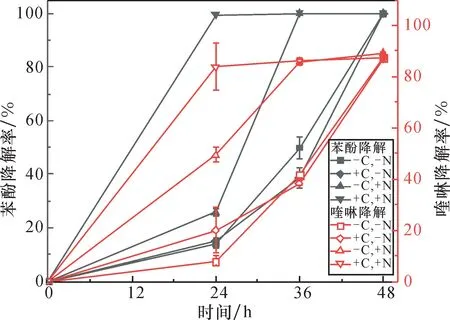
图4 外加碳源氮源对KD1 降解苯酚和喹啉双基质的影响Fig.4 Effect of carbon and nitrogen sources on degradation of phenol and quinoline by KD1
2.4 苯酚和喹啉的降解特性
2.4.1 菌株KD1 对苯酚的降解特性
菌株KD1 对不同初始浓度苯酚的降解如图5(a)所示。菌株能够将初始浓度为100 mg/L、200 mg/L、300 mg/L、400 mg/L、500 mg/L、600 mg/L 和700 mg/L 的苯酚分别在8 h、16 h、24 h、24 h、32 h、48 h 和56 h 内完全降解。菌株KD1 对苯酚的降解效率,明显高于降解200 mg/L 苯酚需要96 h 的Pseudoxanthomonassp.[28]和降解600 mg/L 苯酚需要60 h 的Brucellasp.[29],降解效果也明显好于对64 mg/L 苯酚降解率为21% 的Ochrobactrumsp.[30]。KD1 对900 mg/L 苯酚的降解率为71% ,略低于目前发现的高效单基质降解菌Ochrobactrumsp.CH10[23]的92%。这是由于菌株KD1 为针对多基质废水处理的,因此对于单一高浓度苯酚的降解并未表现出更好的效果。当苯酚浓度达到800 mg/L时,菌株KD1 对苯酚的降解出现迟缓,且菌株的生长也出现了较长的抑制期。

图5 菌株KD1 对苯酚的降解过程及动力学Fig.5 Degradation process and kinetics of phenol by strain KD1
有机物的生物降解过程本质上是化学反应,通常可以通过下式表示:

式中,C为基质的浓度,mg/L;K为降解速率常数,h;t为反应时间,h;n为反应级数。
当n=0 时,两边积分得

反应过程呈零级反应特征;
当n=1 时,两边积分整理得
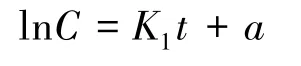
降解速率与底物浓度呈线性关系,反应过程呈一级反应特征。
分别用零级和一级动力学进行拟合发现,苯酚浓度小于800 mg/L 时,KD1 对苯酚的降解过程较符合零级反应特征,如图5(b)所示,且反应速率随苯酚浓度的升高逐渐增加;而继续提高苯酚浓度时,其降解速率逐渐降低,可能是底物浓度较高会对降解菌株产生强烈的抑制作用[31]。
KD1 在不同苯酚浓度下的比生长速率如图6所示,其生长过程符合Haldane 底物抑制模型:

图6 KD1 在不同初始浓度苯酚的比生长速率Fig.6 Specific growth rate of strain KD1 in different concentrations of phenol
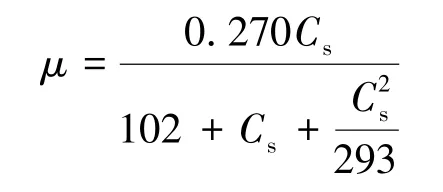
其相关性系数为0.981,其抑制浓度为293 mg/L,高于恶臭假单胞菌[32]、Candida albicansPDY-07[33]和波茨坦短芽孢杆菌[34]。可以看出,菌株KD1 在一定的苯酚浓度范围内的比生长速率先增加后减小,当苯酚浓度为172 mg/L 时,比生长速率达到最大0.270 h-1,高于恶臭假单胞菌[32]的最大比生长速率0.217 h-1。
2.4.2 KD1 对喹啉的降解特性
菌株对不同初始浓度喹啉的降解过程如图7(a)所示。菌株能够将初始浓度为50 mg/L、80 mg/L、200 mg/L、300 mg/L 和400 mg/L 的喹啉分别在12 h、12 h、24 h、36 h 和48 h 内完全降解,降解过程较符合零级反应特征,如图7(b)所示。这与Bacillussp. H1[35]和Rhodococcussp. QL2[36]对喹啉的降解过程相似。当喹啉浓度为300 mg/L时,反应速率常数达到最大,为8.47 mg/ (L·h);之后反应速率随喹啉浓度升高开始有所减小,当达到500 mg/L 时,菌株KD1 对喹啉的降解出现迟缓,且菌株的生长也出现了抑制期。

图7 菌株KD1 对喹啉的降解过程及动力学Fig.7 Degradation process and kinetics of quinoline by strain KD1
菌株KD1 在不同浓度喹啉中的比生长速率如图8 所示。对其生长过程采用Haldane 模型进行拟合,有

图8 KD1 在不同浓度喹啉的比生长速率Fig.8 Specific growth rate of KD1 at different concentrations of quinoline
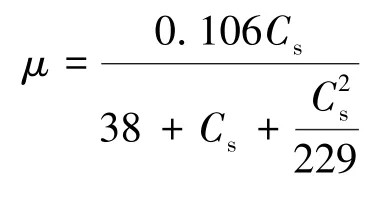
其相关性系数为0.94,最大比生长速率为0.106 h-1,Ki=229 mg/L。
Ki表示菌株生长过程受底物抑制作用的大小,Ki的值越大,底物对菌株的毒害作用越小。菌株KD1 的Ki与单基质降解菌Rhodococcussp.[31]相比略小,其抑制浓度Ki=387 mg/L;与Ochrobactrumsp.[10]的Ki=241 mg/L 和Acidovoraxsp.[20]的Ki=253 mg/L 相当;而高于焦化废水好氧池喹啉浓度(40 ~100 mg/L)。因此,菌株KD1 有较好的应用价值。
2.5 固定化载体的筛选
本文以玉米芯、凝胶小球、凝胶活性炭小球为载体,以不添加菌液为对照组,研究不同固定化作用下菌株对苯酚和喹啉的降解情况。通过单因素方差分析筛选效果较好的固定化方式,结果如图9 所示。

图9 不同固定化载体对苯酚和喹啉降解的影响Fig.9 Effect of different immobilized carriers on the degradation of phenol and quinoline
由图9 可见,不同时间下玉米芯对喹啉的降解与游离菌相比,均无显著性差异(P>0.05),说明简单的吸附固定法未能提高菌株KD1 对苯酚和喹啉的降解效果;与游离菌相比,凝胶小球在36 h 之后对喹啉的降解有显著性差异(P<0.05),说明包埋法能提高菌株对苯酚和喹啉的降解效果;与其他固定化载体相比,凝胶活性炭小球在12 h 后对喹啉的降解有显著性差异(P<0.05),说明通过凝胶和吸附法相结合的方式能显著提高菌株对苯酚和喹啉的降解。该固定方式下,36 h 内能完全降解400 mg/L 苯酚,同时使250 mg/L 喹啉降到50 mg/L 以下。
2.6 花生壳活性炭与传统活性炭固定化效果比较
花生壳活性炭是以花生壳为原料通过磷酸活化辐照法制备而成的。向含500 mg/L 苯酚和300 mg/L 喹啉的双基质培养基中加入花生壳活性炭、传统活性炭及通过包埋制备的凝胶小球,分析花生壳活性炭的性能及包埋下对双基质降解的影响,结果如图10 所示。
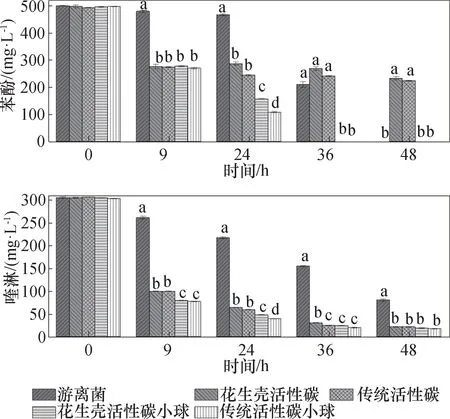
图10 花生壳活性炭与传统活性炭的性能比较Fig.10 Performance comparison between peanut shell activated carbon and traditional activated carbon
在培养前期,两种活性炭与两种凝胶小球对苯酚的去除无显著性差异(P>0.05),花生壳活性炭对苯酚和喹啉的吸附作用稍低于传统活性炭,但在统计上二者并无显著性差异,说明在培养前期凝胶小球以吸附为主,且制备的花生壳活性炭达到了传统活性炭的效果。与游离菌相比,两种活性炭凝胶小球在36 h 对苯酚和喹啉的去除均有显著性差异(P<0.05),36 h 将500 mg/L 苯酚完全去除,对300 mg/L 喹啉的去除也达到90% 以上,说明包埋作用均显著提高了菌株对双基质的降解效率。
3 结 论
针对单基质污染物降解菌在实际焦化废水应用的局限性大,本研究筛选出能同时降解苯酚和喹啉的菌株,考察了该菌株的适用环境条件,研究了该菌株对苯酚和喹啉的降解过程,并进一步采用生物活性炭固定化法处理,以提高在实际工艺对污染物的去除效果。结果表明:
(1) 从焦化废水处理系统二沉池污泥中驯化筛选出一株能同时耐受500 mg/L 苯酚和250 mg/L 喹啉的菌株KD1,经分子生物学鉴定为粪产碱杆菌(Alcaligenes faecalis)。
(2) 降解条件优化表明,菌株KD1 有较大范围的酸碱度适应能力,在接菌量10% 、初始pH 值7.0、温度35 ℃、振荡器转速150 r/min 时,对苯酚和喹啉的降解效率最高。
(3) 菌株能以苯酚为唯一碳源生长,以喹啉为唯一碳源和氮源生长。氮源能影响菌株对苯酚的降解,而共基质下菌株能实现苯酚和喹啉的协同降解。
(4) 菌株对低浓度的苯酚和喹啉的降解过程呈零级反应特征,其生长过程符合Haldane 底物抑制模型,在苯酚和喹啉为基质的生长最大比生长速率分别为0.270 h-1和0.106 h-1。
(5) 制备的新型固定化载体活性炭凝胶小球能显著提高菌株对苯酚和喹啉双基质的降解效果。该方法以废弃物花生壳为原料、采用磷酸活化辐照法制备活性炭,简便易操作,可以大大降低工艺成本,并符合绿色环保的经济理念,具有较强的推广应用价值。
