基于肠道菌群的黑果腺肋花楸多酚降压作用初探
2022-01-10陈炫宏盛桂华南希骏尹成鹏史迎坤周泉城
陈炫宏,盛桂华,南希骏,尹成鹏,史迎坤,张 军,周泉城*
(1 山东理工大学农业工程与食品科学学院食品科学系 山东淄博 255049 2 淄博市城乡规划发展中心 山东淄博 255025 3 淄博市铁山林场 山东淄博 255000)
全球因心血管疾病而死亡的人数日益增加[1],其中高血压是心血管疾病最主要的危险因素,严重威胁着人类健康[2-3]。大量研究证明,控制血压可有效降低心脑血管病的死亡率并减少脑心力衰竭、卒中和冠心病的发生、发展[4]。近年来的研究表明,肠道菌群的组成和功能与人类和动物健康息息相关[5]。有研究表明高血压的发生、发展与肠道菌群有关,通过调节肠道菌群构成可调节血压[6]。宿主与肠道菌群共同组成肠道的微生态环境来维系人类和动物的消化和免疫系统,如果这个系统被损坏就会导致各种疾病[7]。肠道菌群的异常、失调、肠道微生态的功能变化与高血压的发生存在着关联性[8]。多项高血压大鼠肠道菌群的研究表明,高血压组大鼠肠道菌群的混乱度、丰富度和多样性等与正常大鼠相比均会发生显著变化[9-10]。治疗高血压常以药物为主,然而药物治疗对人类和动物易产生毒副反应和耐药性,引起皮肤、肝脏、肾脏等器官的损害[11]。近年来,具有降压效果的食物、草本植物成为人们研究的重点[3]。有关AMP 调节高血压鲜有研究报道,这限制了黑果腺肋花楸的功能性开发及高值化应用。
为探明AMP 对饮食引起的高血压的调节机制,本文初步研究AMP 与肠道菌群的关系。
1 材料与方法
1.1 实验动物、主要材料与试剂
6~7 周龄雄性Wistar 大鼠,体重(200±20)g,由济南金丰实验动物有限公司提供,生产许可证号:SCXK(鲁)2014-0007。配套标准饲料与垫料由济南金丰实验动物有限公司提供。
黑果腺肋花楸,由淄博铁山林场提供;非洛地平缓释片,购自合肥立方制药股份有限公司;总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDLC)、高密度脂蛋白(HDL-C)、游离脂肪酸(FFA)、脂蛋白a(Lpa)试剂盒,购自上海酶联生物科技有限公司;没食子酸标准品、芦丁标准品、乙酸乙酯、D-果糖等其它常用试剂,购自上海爱纯生物科技有限公司。
1.2 主要设备与仪器
ZH-HX-Z 型无创尾动脉血压测量分析系统,安徽正华生物仪器设备有限公司;MUL tiskan 型酶标仪,北京澎昆博远科贸发展有限公司。
1.3 方法
1.3.1 AMP 样品制备
1.3.1.1 AMP 超声波辅助提取 黑果解冻后使用料理机打浆。准确称取5.0 g 黑果果浆倒入烧杯,按照料液比1∶5 倒入一定体积分数为50%的乙醇溶液,将烧杯密封,在超声波条件(设定温度40℃、超声时间40 min,超声功率500 W)下提取多酚类物质。提取完成后经抽滤除去固体杂质,之后使用旋转蒸发器,40 ℃下蒸发除去乙醇,将提取液避光冻存24 h 后使用真空冻干机进行干燥,待黑果质量不变后取出密封冷冻保存。
1.3.1.2 AMP 标准曲线绘制 多酚标准曲线的测定采用福林酚比色法,参考尹国利等[12]的方法略有修改。
精确配制0.1 mg/mL 的水和没食子酸标准液,取5 个25 mL 容量瓶,分别加入没食子酸标准溶液0.25,0.50,0.75,1.00,1.25 mL,定容到刻度。之后分别从配制好的没食子酸梯度标准液中取1 mL 于试管中,并取1 mL 蒸馏水于对照试管,接着分别向各试管里添加5 mL 10%的福林酚试剂,充分摇匀后使之反应6 min。之后再加入7.5%的碳酸钠溶液4 mL,充分摇匀。室温避光保存1 h。在波长765 nm 处测定其吸光度。用X 代表没食子酸质量浓度(mg/L),Y 代表吸光度,绘制标准曲线,计算标准回归方程。
1.3.1.3 AMP 含量测定 取冻干后的AMP 提取物5~7 mg(记录为m)于5 mL 容量瓶中,定容至刻度。之后采用1.3.1.2 节的方法,在波长765 nm 处测定其吸光度,分别记录,通过标准曲线得出黑果样品浓度(记录为c)。
1.3.1.4 AMP 样品制备 试验期间每日配置质量浓度为1.4 mg/mL 的AMP 溶液25 mL 用于大鼠灌胃。
具体操作为:称取质量为M(M 由下方公式1计算得出)mg 的冻干样品于25 mL 容量瓶中,并定容到刻度线,之后密封冷藏备用。

1.3.2 Wistar 大鼠高血压模型建立 结合文献[13-14],模拟人群高血压饮食形成过程建模,方法如下:对大鼠给予5% NaCl 高盐饮食和20%果糖高糖饮水。采用大鼠血压心率检测仪每天对大鼠血压进行测量,连续3 d 血压收缩压 (SBP) 大于140 mmHg 并稳定,表示建模成功。大鼠分组:正常组(Z,生理盐水)、模型组(M,生理盐水)、药物组(C,非洛地平缓释片,4.95 mg/kg);AMP 低剂量组(Hd,每日灌胃5 mL/kg)、AMP 中剂量组(Hz,每日灌胃7.5 mL/kg)、AMP 高剂量组(Hg,每日灌胃10 mL/kg);喂养试验持续3 周。
1.3.3 大鼠肠道菌群测定 各组经3 周灌胃试验后,采用眼眶取血法取出血液,室温静置1 h 自然凝固,平衡后离心(3 000 r/min,10 min)取上清液测定血脂指标 (TC、TG、LDL-C、HDL-C、LP(a)、FFA)。
1.3.4 大鼠肠道菌群测定 喂养试验结束,取大鼠肠道粪便贮于灭菌EP 管中,液氮保存。委托美吉生物科技有限公司进行检测,对高血压大鼠进行肠道菌群丰富度分析、菌群群落分析、Heatmap分析以及COG 数据库对比。
1.3.5 统计学分析 试验结果分析用SPSS 17.0、origin 2018 软件,差异性显著水平P<0.05。
2 结果与分析
2.1 AMP 标准曲线绘制
如图1所示,6 个浓度梯度的没食子酸标准液的标准曲线满足误差范围,其对应的回归方程y=0.0091x-0.0017,R2=0.9929,线性关系良好。
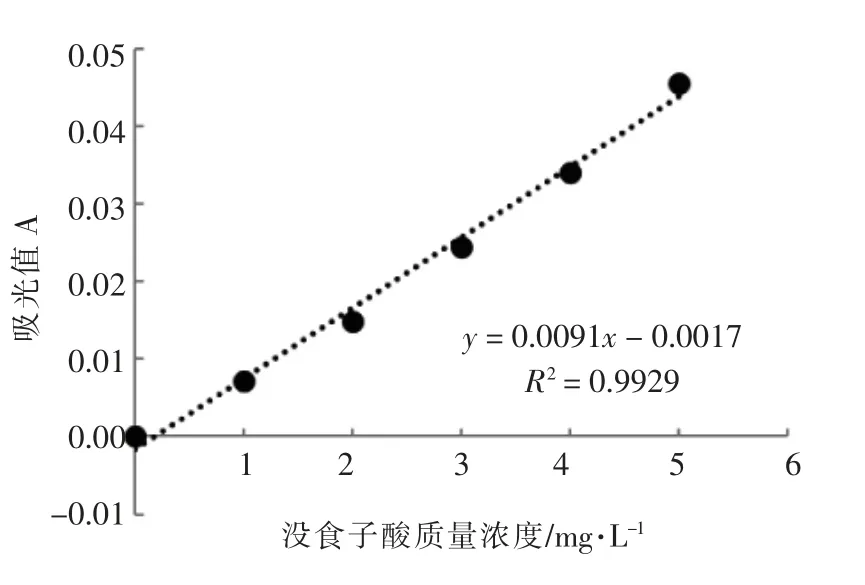
图1 多酚标准曲线Fig.1 Polyphenol standard curve
2.2 AMP 对高血压大鼠血压的影响
如图2所示,在高血压模型建立期间,正常组大鼠血压值稳定在正常值100~120 mmHg 之间,表明了其它无关试验条件不会对大鼠血压值造成显著影响,从而确保试验数据的严谨性;而其余组大鼠均出现显著的高血压(SBP>140 mmHg)症状并稳定,证明通过高盐高糖饮食诱导的Wistar 大鼠高血压模型建立成功。在非洛地平缓释片干预后,药物组大鼠血压值显著下降,相比于治疗前下降了17.8%;在AMP 灌胃后,高血压大鼠血压值均显著降低,其中AMP 中剂量组下降程度显著,达到11.6%,AMP 低剂量组与高剂量分别下降了8.2%和6.1%。说明AMP 中剂量组降压效果最好,表明AMP 的降压效果不是单纯的随着浓度的升高而升高。
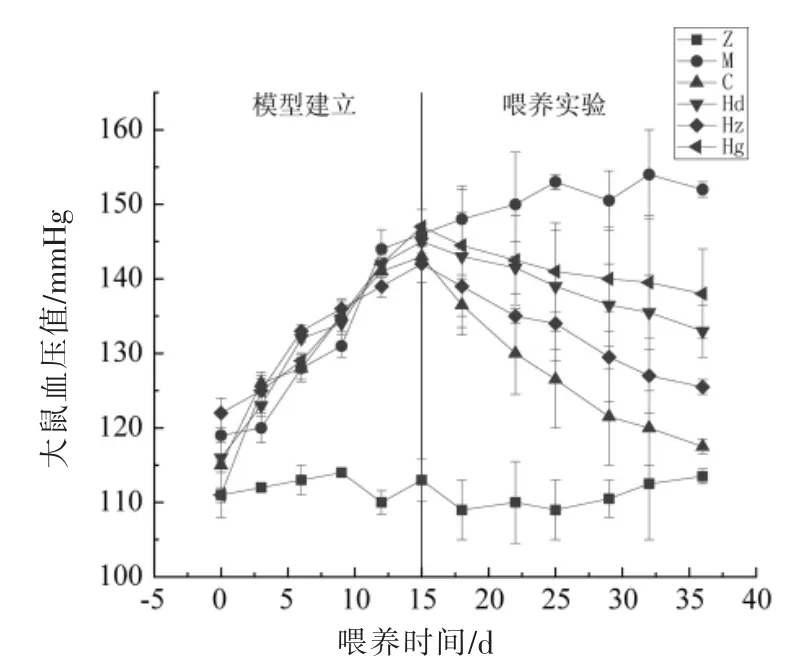
图2 大鼠建模开始至试验结束血压变化图Fig.2 Changes in blood pressure from the beginning of modeling to the end of the experiment
2.3 AMP 对高血压大鼠血成分分析
如表1所示,与正常组相比,模型组各血成分均不同程度降低。与正常组相比,药物组甘油三酯与胆固醇显著降低,高密度脂蛋白与游离脂肪酸显著升高,但均维持在一定范围,说明非洛地平对高血压大鼠血脂变化有积极作用,这与赖泽仁等[15]的研究结果一致。与正常组相比,AMP 中剂量组甘油三酯与胆固醇显著降低,高密度脂蛋白与游离脂肪酸显著升高,其余无显著差异,与药物组变化一致,表明AMP 中剂量组与非洛地平对血脂成分影响效果相似。AMP 低、高剂量组高密度脂蛋白、低密度脂蛋白、脂蛋白a 与游离脂肪酸显著降低,对高血压大鼠血脂变化无明显积极作用。
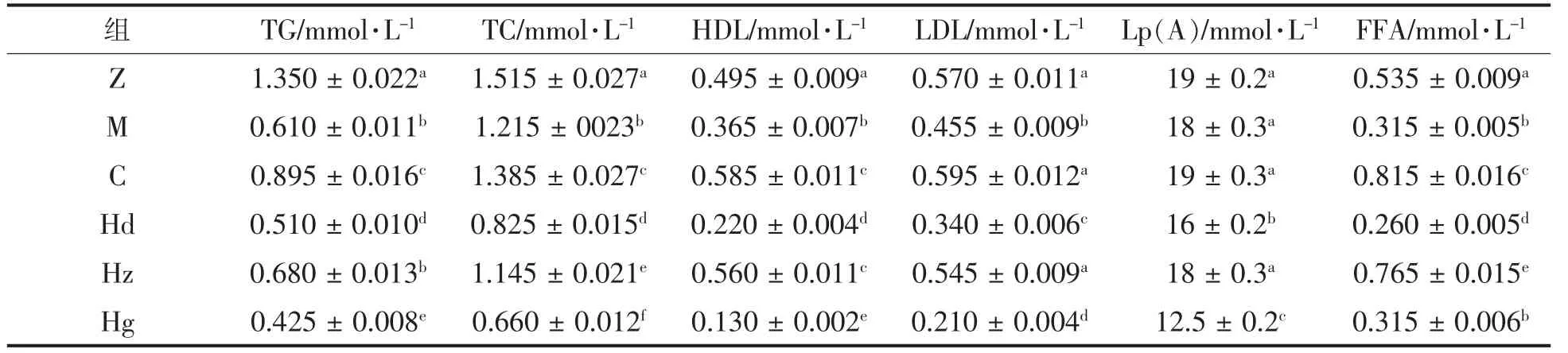
表1 多酚对高血压大鼠血成分Table 1 Blood components of polyphenols in hypertensive rats
因此,中剂量的AMP 与非洛地平对大鼠高血压调节具有更好的效果,而且AMP 对于大鼠高血压的作用效果并不是单纯随着浓度的升高而增加,与前文研究结果一致。
2.4 AMP 对高血压大鼠肠道菌群丰富度与均匀度的影响
2.4.1 AMP 对高血压大鼠肠道菌群Rank-Abundance 曲线分析 肠道菌群功能作用与其组成密切相关,不同菌种的组成与优势菌群的差异会导致菌群代谢产物的不同,从而对生物体产生各种影响[16]。等级丰度曲线反映菌群物种丰富度,OTU 水平等级跨度越大,菌群物种丰富度越高[17]。如图3可知,与正常组相比,模型组丰富度显著降低,表明高血压会对肠道菌群产生显著影响使其下降,这与Li 等[18]研究结果相似。药物组与正常组相比OTU 水平等级跨度大,呈显著性差异,说明药物对高血压大鼠肠道菌群丰度增加有显著影响。与正常组相比,AMP 中剂量组OTU 水平等级跨度无显著性差异,而低、高剂量组OTU 水平等级均呈现显著上升,说明物种丰富度显著升高。表明不同剂量的AMP会对大鼠肠道菌群OTU 水平产生显著影响。AMP各剂量组与药物组相比OTU 水平差异显著,这说明在菌群丰度方面,AMP 对肠道菌群影响显著低于非洛地平对肠道菌群影响。
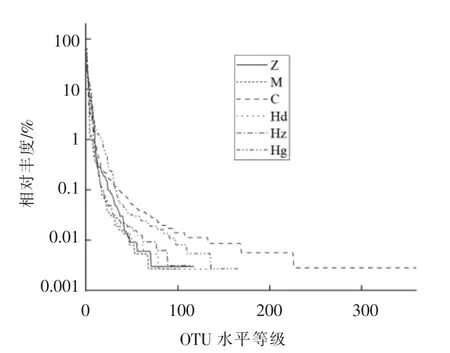
图3 多酚对高血压大鼠肠道菌群的等级丰度曲线Fig.3 The OTU level rank curve of polyphenols on intestinal flora in hypertensive rats
2.4.2 AMP 对高血压大鼠肠道菌群稀释曲线分析 据Sobs 稀释曲线可以用来比较测序数量不同的样本物种的丰富度,也可以用来说明样本的取样大小是否合理。Sobs 指标越高表示肠道菌群群落的细菌丰富度越高。如图4所示,Sobs 稀释曲线趋于平缓,说明测序数据达到饱和,能够覆盖大鼠肠道菌群群落的绝大部分物种。与正常组相比,模型组Sobs 稀释曲线显著降低,其原因是高血压造成大鼠肠道菌群丰富度降低,而药物组Sobs 稀释曲线显著增高,说明非洛地平对肠道菌群的丰富度具有显著影响。与正常组相比,AMP 低中剂量组Sobs 稀释曲线均无显著差异。与药物组相比,AMP 剂量组差异显著,这说明在菌群丰度方面,AMP 对肠道菌群影响显著低于非洛地平对肠道菌群影响。
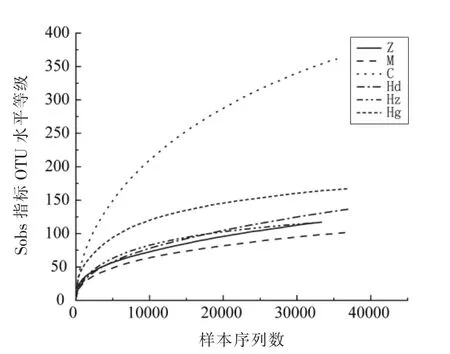
图4 多酚对高血压大鼠肠道菌群稀释曲线Fig.4 Effects of polyphenol on rarefaction curve of intestinal flora in hypertensive rats
2.4.3 AMP 对高血压大鼠肠道菌群香农-威纳曲线分析 香农-威纳指数反应群落均匀度,与群落均匀程度呈正比。由图5可见,与正常组相比,模型组香农-威纳指数显著降低,说明高血压会降低肠道菌群的多样性,从而降低肠道菌群均匀程度,破坏肠道微环境平衡。与正常组相比,药物组与AMP 中剂量组香农-威纳指数无显著性差异,这说明两者肠道菌群均匀程度均接近正常;AMP 低剂量显著降低,表明低剂量的AMP 对肠道菌群改善较小,不能达到恢复正常的功效;AMP 高剂量组显著增高,说明其肠道菌群各菌群均匀程度高。
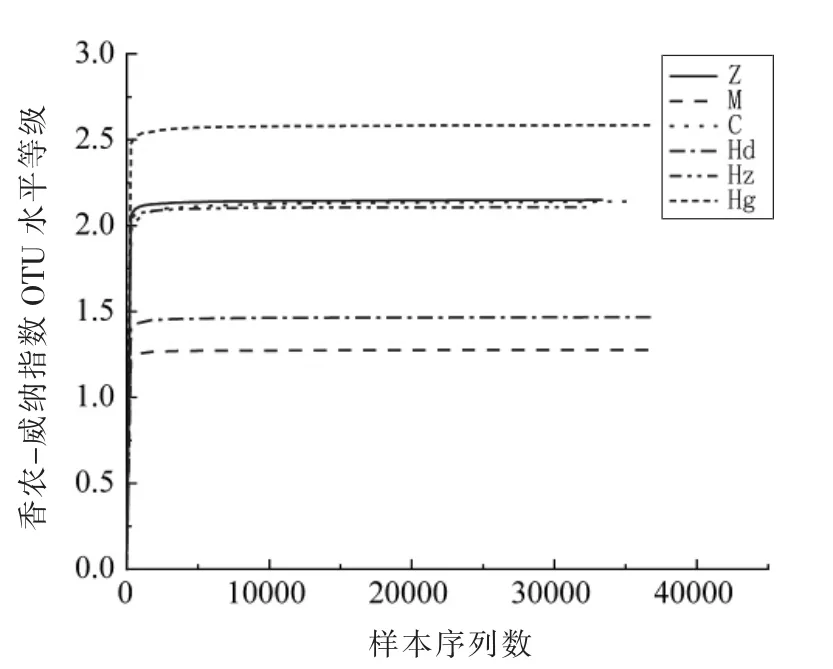
图5 多酚对高血压大鼠肠道菌群的香农-威纳曲线Fig.5 Shannon curve of polyphenols on intestinal flora in hypertensive rats
2.4.4 AMP 对高血压大鼠肠道菌群多样性指数表分析 多样性指数表反映不同组之间菌群丰富度的百分比差异。如表2所示,与正常组相比,模型组观测物种数降低了12.8%,香农-威纳指数降低了40.6%,表明高血压会对肠道菌群产生显著影响使两者下降。与正常组相比,药物组观测物种数升高了208.5%,香农-威纳指数无显著差异,说明药物对高血压大鼠肠道菌群丰度增加有显著影响,但并不影响肠道菌群均匀度。与正常组相比,AMP 中剂量组观测物种数与香农-威纳指数均无显著差异。AMP 低剂量组观测物种数升高了17.1%,香农-威纳指数降低了31.7%,说明物种丰富度显著升高,而物种均匀度显著降低,表明低剂量的AMP 对肠道菌群改善较小,不能达到恢复正常的功效。AMP 高剂量组观测物种数升高了42.7%,香农-威纳指数升高了20%,说明物种丰富度显著升高,且肠道菌群各菌群均匀程度高。AMP 观测物种数均显著低于药物组,这说明在菌群丰度方面,AMP 对肠道菌群的影响显著低于非洛地平对肠道菌群的影响。
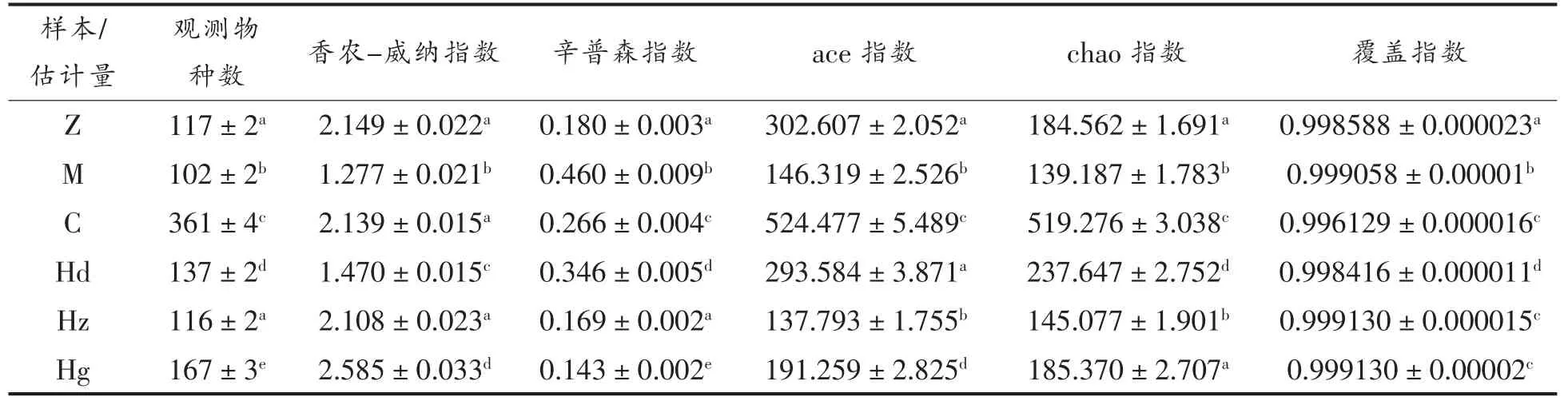
表2 多样性指数表Table 2 Diversity index table
综上所述,AMP 对肠道菌群影响显著低于非洛地平对肠道菌群影响。AMP 对高血压大鼠肠道菌群具有改善作用,具有使高血压大鼠肠道菌群丰富度与均匀程度维持在正常水平的能力,其中AMP 中剂量效果最好。
2.5 AMP 对高血压大鼠菌种数量的影响
Venn 图在启发我们理清涉及多个肠道菌群的信息量之间的关系上的重要作用[20],通过交集与非交集来反映相同与不同菌种数量,图6为选定分类学水平下,各分组中总的物种数目柱形图。
如图6所示,与正常组相比,模型组不同菌种数量接近正常组,而物种总数显著降低,高血压会对肠道菌群产生显著影响使物种总数下降。与正常组相比,药物组不同菌种数量与物种总数均显著升高,表面非洛地平使肠道菌群物种丰富度显著升高。与正常组相比,AMP 低中剂量组不同菌种数量与物种总数均接近正常组,而AMP 高剂量组不同菌种数量与物种总数均显著升高,表明AMP 低中剂量组菌群最接近正常,而高剂量组肠道菌群物种丰富度显著升高。AMP 各剂量组与药物组均差异显著,这说明AMP 对肠道菌群影响显著低于非洛地平对肠道菌群影响。
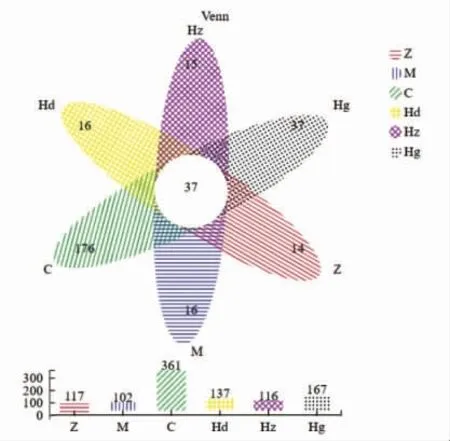
图6 多酚对高血压大鼠肠道菌群的Venn 曲线Fig.6 Venn curve of polyphenols on intestinal flora in hypertensive rats
研究结果表明,AMP 对肠道菌群影响显著低于非洛地平对肠道菌群影响。AMP 低中剂量组不同菌种数量与物种总数接近正常。说明AMP 对高血压大鼠肠道菌群具有改善作用,其中低中剂量效果最好。
2.6 “门”水平下AMP 对高血压大鼠肠道菌群群落分析
在“门”分类上,B 为拟杆菌门(Bacteroidetes,B),F 为厚壁菌门(Firmicutes,F)。目前已有研究表明F 和B 之比(F/B)可以反映肠道菌群紊乱程度[21],F/B 值越高紊乱程度越大。由图6可知,F/B的比值:正常组为3.25,模型组为0.66,药物组为5.89,AMP 低剂量组为1.41,AMP 中剂量组为3.30,AMP 高剂量组为5.84。
热图可以展现数据的差异性,可以直观了解各个菌种的分布情况或者差异情况[22]。如图7所示,在“门”水平下大鼠肠道各菌群分布。与正常组相比,模型组肠道菌群紊乱程度最低,其原因是由于通过高糖高盐饮食所引发的高血压会使肠道中菌群的丰富度降低,从而使高血压大鼠肠道菌群的紊乱程度相对降低。与正常组相比,药物组肠道菌群紊乱程度大,其原因可能是与非洛地平缓释片会引起恶心,胃肠道菌群紊乱失调有关[23]。与正常组相比,AMP 低剂量组紊乱程度显著降低,中剂量组无显著性差异,而高剂量组有显著性提高。结果表明中剂量的AMP 具有维持肠道菌群紊乱度的能力,而过高、过低浓度的AMP 会对肠道紊乱程度造成不良影响。原因是AMP 可降低有害菌群相对丰度,其降低能力随着浓度的升高而提升,但当浓度过大时,肠道菌群中一些劣势菌得到繁殖取代原有的优势菌,从而使得肠道菌群紊乱程度显著增大[24]。此外,试验组与药物组相比,AMP低、中剂量组差异显著,而高剂量组与药物组差异不显著,说明高剂量组肠道菌群紊乱程度与非洛地平紊乱程度接近。
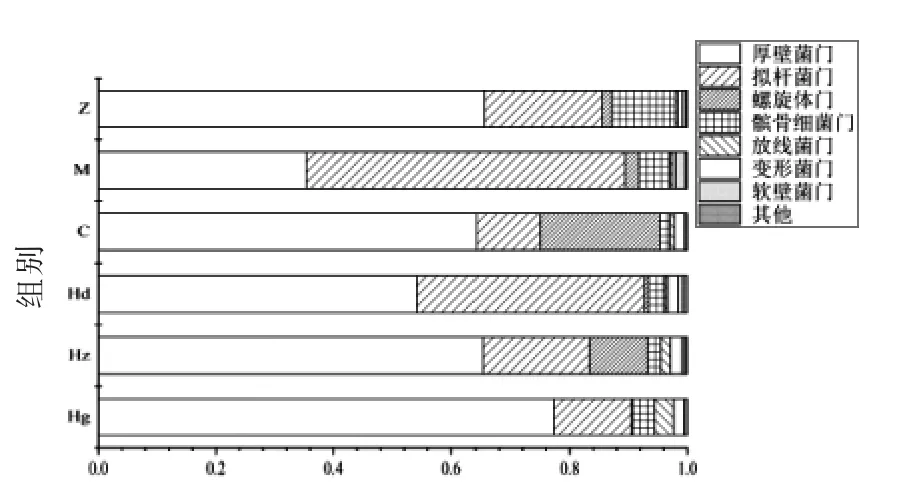
图7 “门”水平下AMP 对高血压大鼠肠道菌群群落影响Fig.7 Effects of polyphenols on intestinal flora of hypertensive rats at portal level
如图8所示,结合Heatmap 图分析来看,在“门”水平下大鼠肠道各菌群分布模型组与正常组差别最大,AMP 中剂量组与正常组最为接近。证明AMP 对高血压大鼠肠道菌群具有改善效果,且中剂量的AMP 改善效果最好。
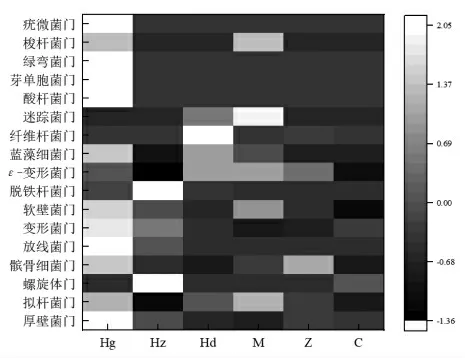
图8 “门”水平下多酚对大鼠肠道菌群热图Fig.8 Heatmap of phylum-level on effects of polyphenols on intestinal flora of hypertensive rats
以上结果表明AMP 对高血压大鼠肠道菌群紊乱具有改善作用,其中AMP 中剂量效果最好,同时也表明非洛地平与AMP 高剂量组会增加肠道菌群的紊乱程度,对其造成不良影响。
2.7 “科”水平下AMP 对高血压大鼠肠道菌群群落分析
如图9、图10所示,在“科”水平下,与正常组相比,模型组中毛螺旋菌科(Lachnospiraceae)降低了73.6%,普雷沃氏菌科(Prevotellaceae)升高了223.4%,存在肠道菌群紊乱现象。其中毛螺旋菌科为产甲酸、乳酸等菌科,普雷沃氏菌科主要产物是乙酸和琥珀酸,表明高血压大鼠肠道菌群中产乙酸(属短链脂肪酸)和琥珀酸细菌增加,而产甲酸、乳酸菌种减少。肠道菌群分析结果表明,肠道微生物影响血压的机制之一可能是通过其分泌物(如乙酸和琥珀酸等)影响大鼠血脂成分,进而对血压产生一定的影响,这与Felizardo 等[25]的研究结果相似。有研究表明,肠道微生物产生的一些代谢产物比如短链脂肪酸(主要为乙酸)能够调节宿主肠道屏障功能以及炎症状态等[26]。
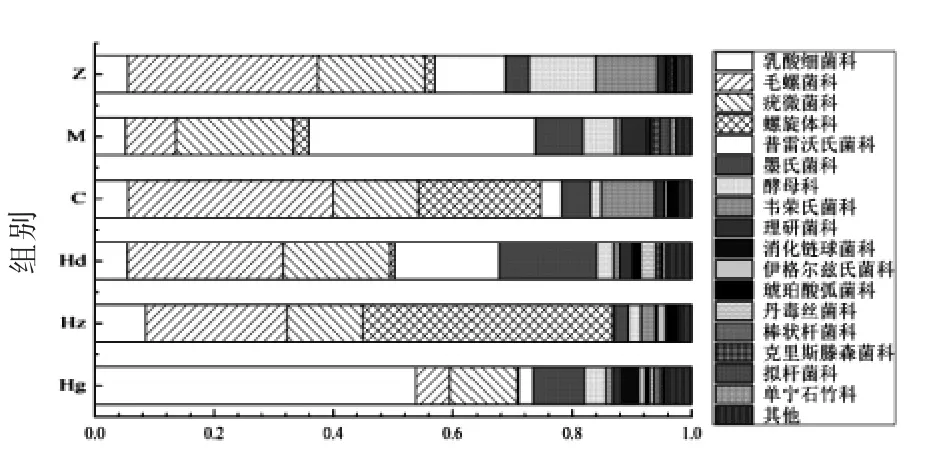
图9 “科”水平下多酚对高血压大鼠肠道菌群群落Fig.9 Effects of polyphenols on intestinal flora of hypertensive rats at family level

图10 “科”水平下AMP 对大鼠肠道菌群热图Fig.10 Heatmap of family-level on effects of polyphenols on intestinal flora of hypertensive rats
使用非洛地平缓释片和AMP 干预后,AMP低剂量组各菌占比接近正常组,药物组乳酸杆菌科(Lactobacillaceae)占比接近正常大鼠,但药物组中螺旋体科(Spirochaetaceae)比正常组升高了1 179.7%,此菌属于有害菌;AMP 高剂量组中乳酸杆菌科比正常组升高了908.9%,此菌属有益菌,但存在肠道菌群紊乱现象。AMP 中剂量组中乳酸杆菌科比正常组升高了59.2%,为产乳酸菌,属有益菌,与发酵代谢有关,益生菌可以调节肠道微生物的代谢活动以及肠道微生物的生态平衡,从而促进对高血压的治疗[27]。因此,结果表明AMP 调节血压效果机制可能与发酵代谢有关,促进对肠道菌群的改善,从而促进对高血压的治疗;同时非洛地平与高剂量AMP 可能在治疗高血压的过程中会对肠道菌群产生一定的副作用,而低中剂量AMP对菌群无明显副作用,并且中剂量AMP 对改善肠道菌群具有最佳的调节作用。
2.8 COG 数据库对比
COG 是由NCBI 创建并维护的蛋白数据库[28],首先通过PICRUSt 对OTU 丰度表进行标准化,然后通过每个OTU 对应的greengene id,获得OTU对应的COG 家族信息。根据COG 数据库的信息,可以从eggNOG 数据库中解析到各个COG 的描述信息,及其功能信息[29]。
由表3可知,AMP 中剂量组除细胞外结构,其它各项功能指标均显著高于正常组与模型组,如AMP 中剂量组能量的产生和转换菌种数量比正常组高89.1%,比模型组高200.4%;碳水化合物的运输和代谢菌种数量比正常组高123.1%,比模型组高303.1%;防御机制菌种数量比正常组高93.9%,比模型组高242.1%等。说明AMP 具有提高能量生产和转换效率,加强细胞血管控制,加快氨基酸、核苷酸、碳水化合物、辅酶、脂质运输与代谢的功效等。结果表明AMP 除能调节肠道菌群微环境外,还对高血压大鼠的肠道功能具有良好的改善作用,利于提高对高血压疾病的治疗效果,具体方面还需进一步研究。
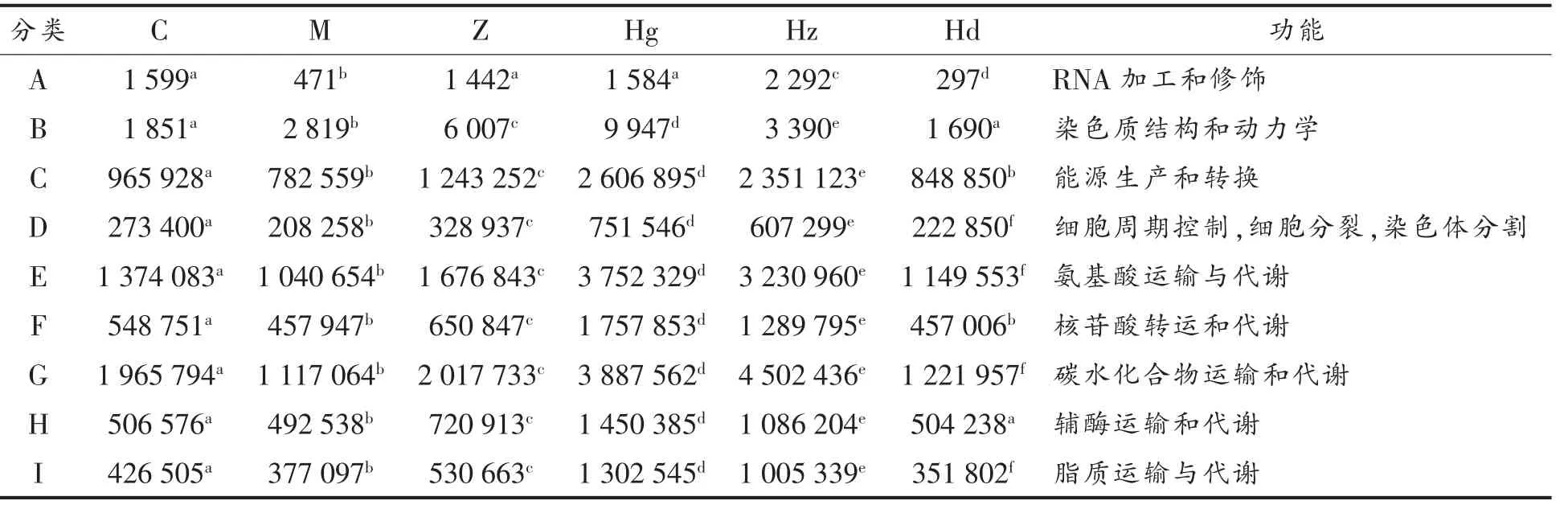
表3 COG 功能分类统计Table 3 COG function classification
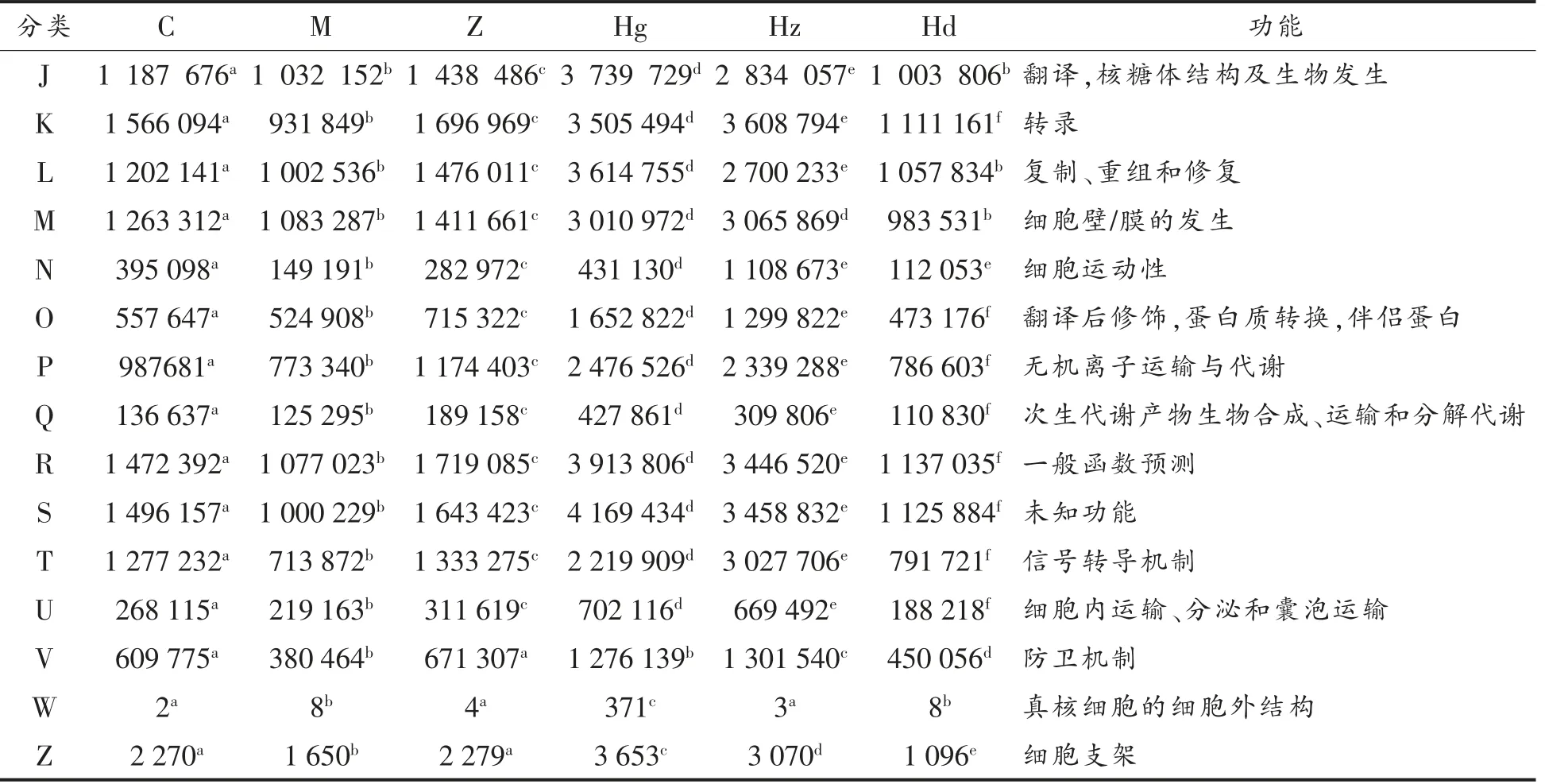
(续表3)
3 结论
研究结果表明,AMP 对高血压疾病具有一定的治疗效果,且AMP 的降压效果不是单纯的随着浓度的升高而升高。AMP 可调节由高血压引起的肠道微生物环境变化,有效降低大鼠肠道微生物中有害菌相对丰度,选择性的促进有益菌群(如乳酸菌)生长,并通过其调节肠道微环境,促进发酵代谢平衡,使菌群丰富度和多样性维持在正常范围以内,从而减少因肠道微生物紊乱而对大鼠血压造成的不良影响。此外,AMP 除能调节肠道菌群微环境外,还对高血压大鼠的肠道功能具有良好的改善作用,利于提高肠道对于碳水化合物的代谢、能量生产和转化等能力,从而提高对高血压疾病的治疗效果。在高血压大鼠试验中,各项试验结果表明AMP 中剂量(质量浓度为1.4 mg/kg,每日灌胃7.5 mL/kg)具有最佳的改善肠道菌群的能力。因此,AMP 可被当作治疗高血压的功能性因子,用于制备相关的功能性食品。
综上所述,众多研究表明肠道菌群紊乱会致使人体血压升高,肠道菌群与高血压相互间关系的研究还有待进一步展开。以AMP 改善肠道微生物是一个极具前景的高血压治疗途径,推进肠道微生物与当前药物治疗的有效结合可能是高血压治疗的新策略。可以预见,AMP 将作为治疗高血压的功能性因子,广泛应用于制备相关的功能性食品。
