CaCl2和NaCl诱导对大豆分离蛋白纳米纤维冷凝胶的影响
2022-01-10周航庆张建红
关 琛,李 萌,李 宁,周航庆,张建红,李 琳
(1 黑龙江八一农垦大学食品学院 黑龙江大庆 163100 2 东北农业大学食品学院 哈尔滨 150030)
大豆蛋白是一种重要的食品成分,具有营养价值高、功能性强、有益健康等优点,在食品中得到广泛的应用。近年来,很多学者报道了大豆蛋白[1-2]、乳清蛋白[3]等食品蛋白均可在远离等电点(通常是pH 2.0)的条件下加热,通过非共价结合(如静电、氢和疏水相互作用)自发形成有序的聚集体。这种聚集体通常是长度1~10 μm,直径1~10 nm 的纤维形态[4],具有较好的乳化性、高耐热性和理想的机械属性,以及更高的抗氧化活性等[5-7]。纤维状结构具有明显的轮廓长度和高纵横比,使得蛋白纳米纤维可以在低体积分数时形成空间填充网络,被认为是有效的凝胶剂[8]。由于远离等电点,蛋白质的净电荷较高,静电斥力增加,优先形成透明的细链凝胶。这种以可食用蛋白为基础的纳米凝胶具有足够的内部空间来包裹客体材料,具有高载药量、高多价生物偶联能力和生物相容性等显著特性,可被用作生物活性分子和药物的包封体,如咖啡因[9]、核黄素[10]等。
近年来,利用食品蛋白纳米纤维制备冷固性凝胶的趋势日益明显。冷凝胶通常在室温下形成,可作为热敏化合物载体[11]。与热固性凝胶相比,冷固性凝胶具有更高的凝胶强度和断裂性能,更好的保水性和透明度[12]。许多交联剂都可诱导淀粉样纤维形成冷凝胶,如单价或多价盐[13]、酶(转谷氨酰胺酶)[14]等。Veerman 等[13]首先用这种方法开发了Ca2+诱导的β-乳球蛋白纤维冷凝胶化,主要有两个步骤:1)在远离等电点和低离子强度的条件下加热蛋白质,目的是变性,并形成纳米纤维结构;2)调节pH 值至接近等电点后,通过添加单价或多价阳离子在低温下诱导凝胶化。盐诱导的纳米纤维凝胶化是由离子屏蔽效应引起的。静电能垒在盐的存在下被克服,并通过Derjaguin-Landau-Vervey-Overbeek(DLVO)相互作用(即范德华和双电层相互作用),使物理作用转化为持久的化学交联[15]。与热诱导凝胶法或常规冷定型凝胶法相比,该过程β-乳球蛋白凝胶网络的浓度低得多。Mohammadian 等[16]使用不同的二价阳离子(包括CaCl2、MnCl2和ZnCl2) 制得乳清蛋白纤维冷凝胶,其中Zn2+-冷凝胶具有更紧密的网络结构,在模拟胃条件下降解的程度也更大,这种水凝胶既可以作为矿物质的载体,也可以作为治疗胃腺瘤的药物和生物活性分子的载体。二价离子可以通过静电屏蔽、离子/疏水相互作用以及与蛋白分子的带负电荷的羧基交联来诱导聚集,建立蛋白质-阳离子-蛋白质桥。单价阳离子主要通过减少负电荷分子之间的排斥作用,形成蛋白质分子间的非共价缔合[17]。
目前,尚未见盐诱导SPI 纤维冷凝胶的研究报道。本研究通过添加CaCl2和NaCl,从自组装形成的纤维化SPI 溶液中制备冷固性凝胶,探究Ca-Cl2和NaCl 对SPI 纤维冷凝胶流变性质、凝胶硬度和持水性的影响,确定不同盐浓度下的最小凝胶浓度,为SPI 纤维冷凝胶的开发及利用提供理论基础。
1 材料与方法
1.1 材料与试剂
大豆低温脱脂豆粕,山东万得福集团实业有限公司;化学试剂均为分析纯。
1.2 仪器与设备
H1850R 型高速冷冻离心机,湖南湘仪离心机有限公司;ALPHA 1-4 LSC 型冷冻干燥机,德国Christ 公司;KJ2300 型凯氏定氮仪,瑞典Foss 公司;TA-XTplus 质构仪,英国Micro System 公司;HAAKE MARS 60 流变仪,德国Thermofisher 公司。
1.3 方法
1.3.1 大豆分离蛋白的制备 采用碱溶酸沉法自制。将低温脱脂豆粕粉碎,按料液比1:10 的比例加入去离子水,用1 mol/L NaOH 调节pH 值至8.0,室温下低速搅拌2 h 后8 000×g 离心30 min。取上清液用1 mol/L HCl 调节pH 值至4.5。4 ℃静置1 h 至蛋白质析出后,8 000×g 离心10 min 后取出蛋白沉淀,溶于去离子水,用1 mol/L NaOH调节pH 值至7.0。8 000×g 离心10 min,去除不溶物。蛋白液于4 ℃透析48 h,冻干后得到SPI。凯氏定氮法测得蛋白质质量分数为90.5%(N×6.25)。
1.3.2 SPI 纤维溶液的制备 将SPI 冻干粉溶解于去离子水中(80 g/L),室温搅拌2 h 后,调节pH值至2.0,4 ℃水化过夜。蛋白溶液经过10 000×g离心30 min 后,凯氏定氮法测定上清液的蛋白含量。用去离子水(预调pH 2.0)将蛋白上清液稀释到10~60 g/L。将蛋白溶液置于带密封盖的小瓶中,85 ℃水浴加热20 h。加热结束后,将蛋白质样品冰浴冷却10 min,并置于4 ℃保存。
1.3.3 SPI 冷凝胶的制备 根据Veerman 等[13]的方法,SPI 样品用1 mol/L 和0.1 mol/L NaOH 将pH 值调节至7。添加适量的CaCl2、NaCl 溶液至终浓度为10~100 mmol/L 和60~500 mmol/L,并将溶液充分混合,室温放置24 h 后测定。
1.3.4 流变学测量 采用控制应变模式,选择平行板 (直径35 mm,锥角15°,平行板间距1.0 mm),测定了储能模量(G′)随应变(扫描频率1 Hz;温度25 ℃;应变0.01%~1%)的函数。
1.3.5 凝胶硬度的测定 采用TPA 模式,探头使用P/10,触发力为5 g,压缩变形为样品高度的50%,间隔时间为3 s,测前速度为1.0 mm/s,测试速度为1.0 mm/s,测后速度为1.0 mm/s,检测温度为室温。重复3 次的平均值作为测定结果。
1.3.6 持水性(WHC)测定 取一定质量(M0)蛋白凝胶装入离心管中离心(8 000×g,30 min)。取出后用滤纸吸取多余水分称重(M1)。WHC (%) 定义为:
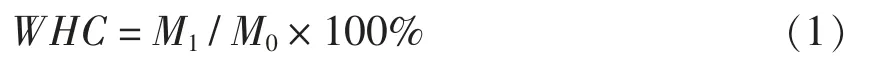
根据Urbonaite 等[18]的方法,样品在不同的离心力(100~1 000 g)下,离心10 min,测定持水性的变化。根据公式:

式中:A——施加0 和1 000 g 力之间可以离开系统的最大水量,%;B——凝胶中剩余的水量(等于100-A),%;gmin——水分渗出所需的最小离心力,g;k——水在受力下离开系统难易程度的系数。
通过对试验数据进行最小二乘最小拟合得到参数A、k 和gmin。
1.4 统计分析
所有试验重复3 次取均值,采用Origin 8.0软件作图。数据处理和分析采用SPSS 19.0 软件。
2 结果与讨论
2.1 盐诱导的SPI 纤维冷凝胶相图
如图1所示,未加盐的SPI 溶液只有在质量浓度大于60 g/L 时,在pH 2.0 和80 ℃下加热20 h 后,才能够形成凝胶。20~55 g/L SPI 纤维溶液冷却后,将pH 值调整为7.0。Mohammadian 等[16]和Gilbert 等[19]的研究表明,pH 值调节为7.0 时纳米纤维仍然存在,长度小于与pH 值为2.0 时的原始状态。CaCl2浓度较低时,盐离子的静电屏蔽作用能够促进蛋白质的聚集,仍无法交联形成网络结构。CaCl2浓度增加,Ca2+与蛋白质形成盐桥,导致交联形成凝胶网络结构。同时形成SPI 纤维冷凝胶所需的蛋白浓度随着离子强度从0 增加到30~50 mmol/L,最小质量浓度从60 g/L 逐渐降低到20 g/L。在一定的CaCl2浓度下,蛋白浓度的增加会导致形成不透明凝胶。这些结果表明,形成的凝胶网络结构或形态与蛋白质浓度和静电相互作用的变化密切相关。
在SPI 纤维溶液 (调至pH 7.0) 中加入60,90,150 和300 mmol/L NaCl,离子强度分别等于20,30,50 和100 mmol/L 的CaCl2。同样观察到形成冷凝胶所需的蛋白浓度随着NaCl 浓度的增加而下降。对于10 g/L SPI 纤维溶液,添加CaCl2和NaCl 都没有形成凝胶。以上结果表明,CaCl2和NaCl 都能够诱导SPI 纤维的冷凝胶化,降低形成凝胶所需的蛋白浓度。
2.2 动态黏弹性测量
通过动态振荡测量,研究了在不同蛋白质浓度和离子强度形成的SPI 凝胶的动态黏弹性。在所有的试验中,形成凝胶的储能模量G′大于黏性模量G′′(数据未显示),表明形成了更具弹性的凝胶。这些凝胶具有线性区域,即G′与应变无关。随着蛋白质浓度的增加,SPI 凝胶的线性区域中的G′增长(图2)。Ramos 等[20]的研究也表明,当将盐添加到热变性蛋白质溶液中时,蛋白质浓度对溶液的流变性质有很大影响。在低蛋白质浓度下,热变性蛋白质将倾向于形成黏性溶液,但超过临界蛋白质浓度就会获得冷凝胶。CaCl2浓度从0 增加到50 mmol/L,储能模量逐渐增加,而当离子强度进一步增加到100 mmol/L 时,储能模量逐渐减小,这可能是由于产生了纤维宏观聚集,导致凝胶物理性质的退化,如图1的相图所示。同样的,NaCl 浓度增加到300 mmol/L 时,储能模量达到最大。30 g/L SPI 纤维溶液加入30 mmol/L CaCl2制得的冷凝胶与60 g/L SPI 纤维凝胶的储能模量相当。结果表明,CaCl2和NaCl 的添加促进了凝胶网络的形成。
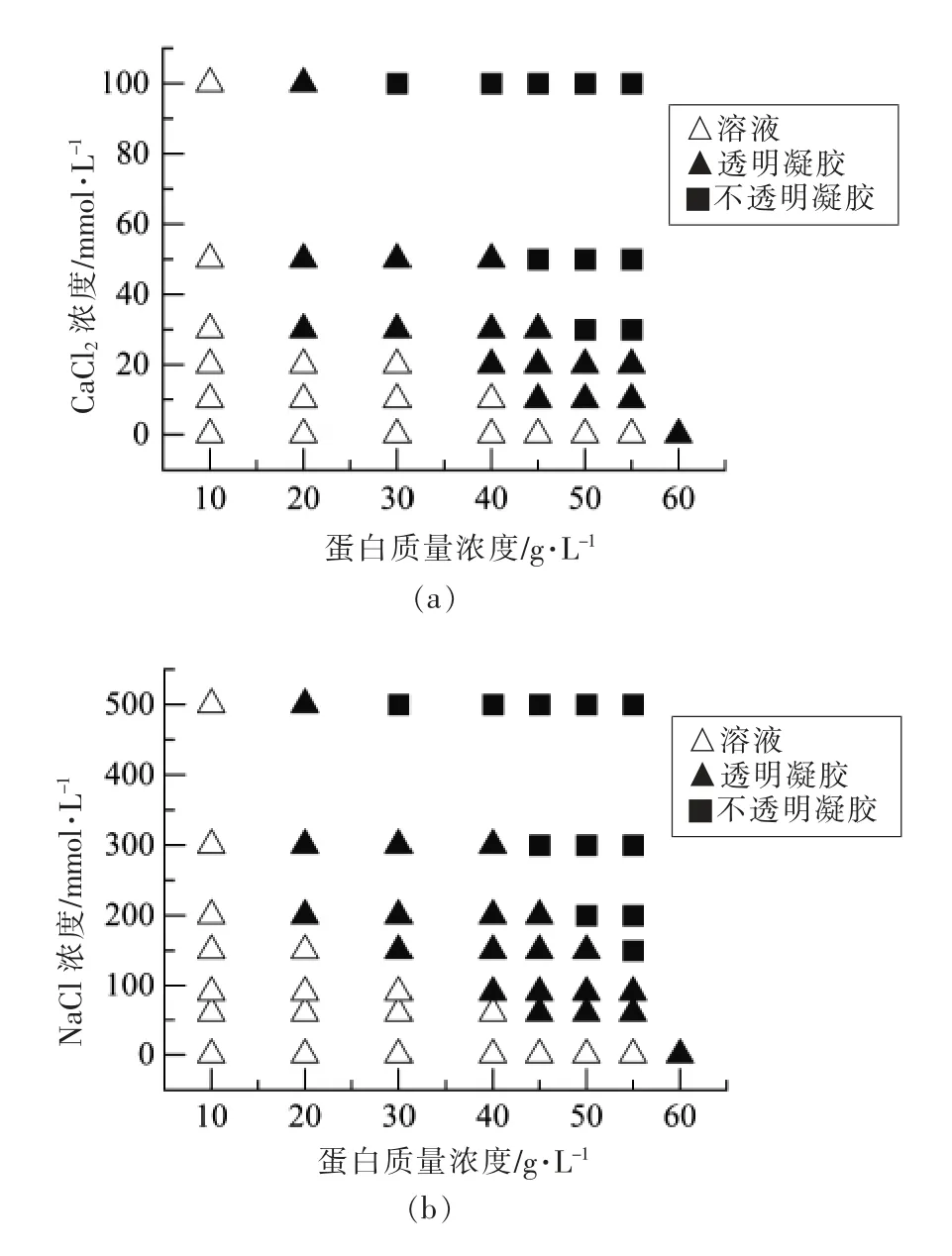
图1 添加不同浓度CaCl2(a)、NaCl(b)SPI 纤维冷凝胶的相图Fig.1 Phase diagram of SPI fibril cold-set gels with different concentrations of CaCl2(a) and NaCl (b)
凝胶理论Percolation 模型G′~(c-cp)t用于拟合凝胶弹性(G′)与蛋白质浓度的关系,其中cp和t 是临界渗流浓度和标度指数[21]。根据Erik 等[22]描述的方法,使用(G′)1/t对c 的曲线图,并将这些曲线图外推到(G′)1/t=0。对于该拟合过程,即无论t值如何,曲线必须与浓度轴相交于相同的值(即cp)。当假设的t 值接近实际值时,曲线图将是线性的,否则这些线将是曲线。根据这些曲线图,确定了cp的平均值。然后绘制lg G′ vs lg (c-cp),使用从估计t 值获得的不同cp值,确定平均t 值。不同离子强度下的平均cp值和t 值见表1。
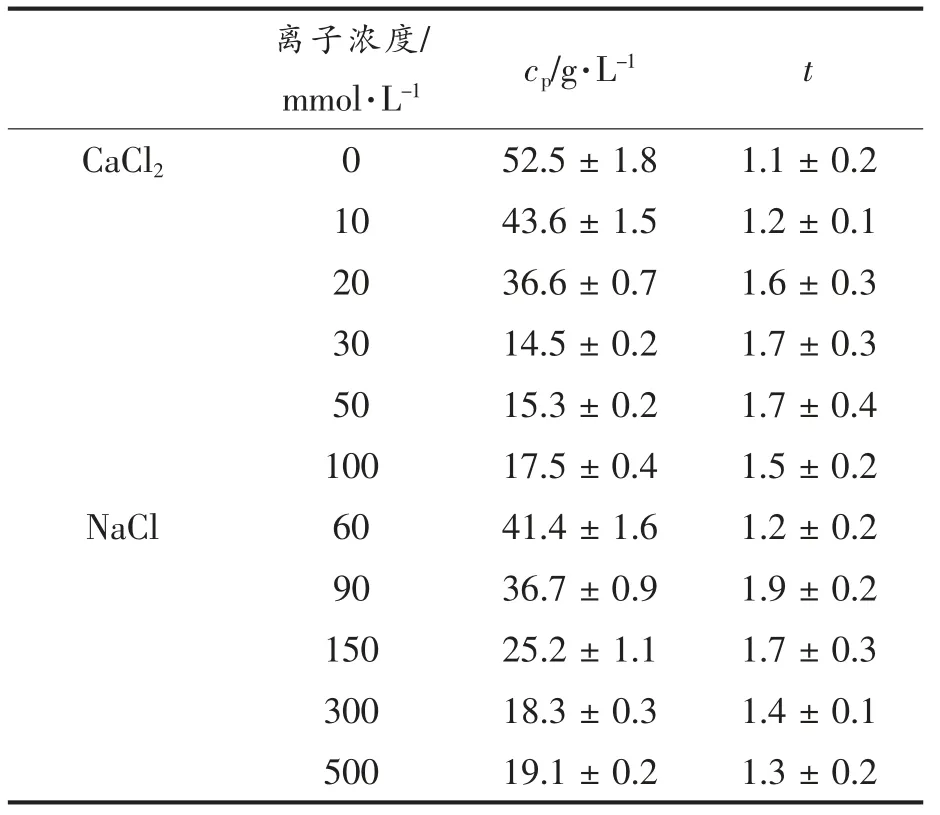
表1 不同离子浓度下形成的SPI 纤维冷凝胶cp 和t 计算值Table 1 Calculated values for cp and t of the formed SPI fibril cold-set gels at varying ionic strengths
所有样品的t 值都在1.1~1.9 之间,表现为各向同性渗流和均匀的网络[23]。CaCl2浓度增加到30 mmol/L 时,cp值最低,静电屏蔽效应和Ca2+在SPI 的带电基团或羧基之间形成的盐桥存在最佳的相互作用。当CaCl2浓度高于30 mmol/L 时,cp随离子强度的增加而增加,这可能是由于排斥力的增加和盐桥的形成导致了纤维聚集形成纤维束。不同的CaCl2浓度引起的凝胶机制的不同,可能是由于微观水平上网络构建过程不同[24]。
二价阳离子与蛋白质结合,从而降低了它们的净电荷密度,单价离子与蛋白质不是特异结合,而是通过静电屏蔽作用诱导蛋白质聚集体的凝胶化。加入NaCl 后样品的cp值均高于加入同等离子强度的CaCl2的样品,说明冷凝胶形成的条件下,由多价阳离子形成盐桥是形成凝胶网络的主要驱动力,而静电屏蔽并不是主要作用[20]。
2.3 凝胶硬度
根据流变性分析结果,选择CaCl2浓度为20,50,100 mmol/L 和NaCl 浓度分别为60,150,500 mmol/L 的纤维冷凝胶进行硬度测定。如图所示,蛋白浓度越大,蛋白质-蛋白质相互作用越强,纤维冷凝胶的硬度越大[25]。Ramos 等[20]的研究也表明,当将盐添加到热变性蛋白质溶液中时,蛋白质浓度对溶液的流变性质有很大影响;在低蛋白质浓度下,热变性蛋白质将倾向于形成黏性溶液,但超过临界蛋白质浓度,就会获得冷凝胶。CaCl2浓度为50 mmol/L 时,硬度最大,与流变分析结果一致。当CaCl2浓度小于50 mmol/L 时,屏蔽效应占主导地位,导致聚集率的增加,凝胶硬度增加。而在较高的CaCl2浓度下,盐桥的形成会导致聚集率的降低。Kharlamova 等[26]的研究也报道了在较高的离子强度下,凝胶硬度随盐浓度的增加而降低。这种降低是由于静电排斥的屏蔽促进了网络的局部致密化。添加CaCl2的冷凝胶的硬度高于添加NaCl的冷凝胶,说明二价阳离子比一价阳离子更有效地诱导凝胶化,因为它们能够特异性地与蛋白质结合。
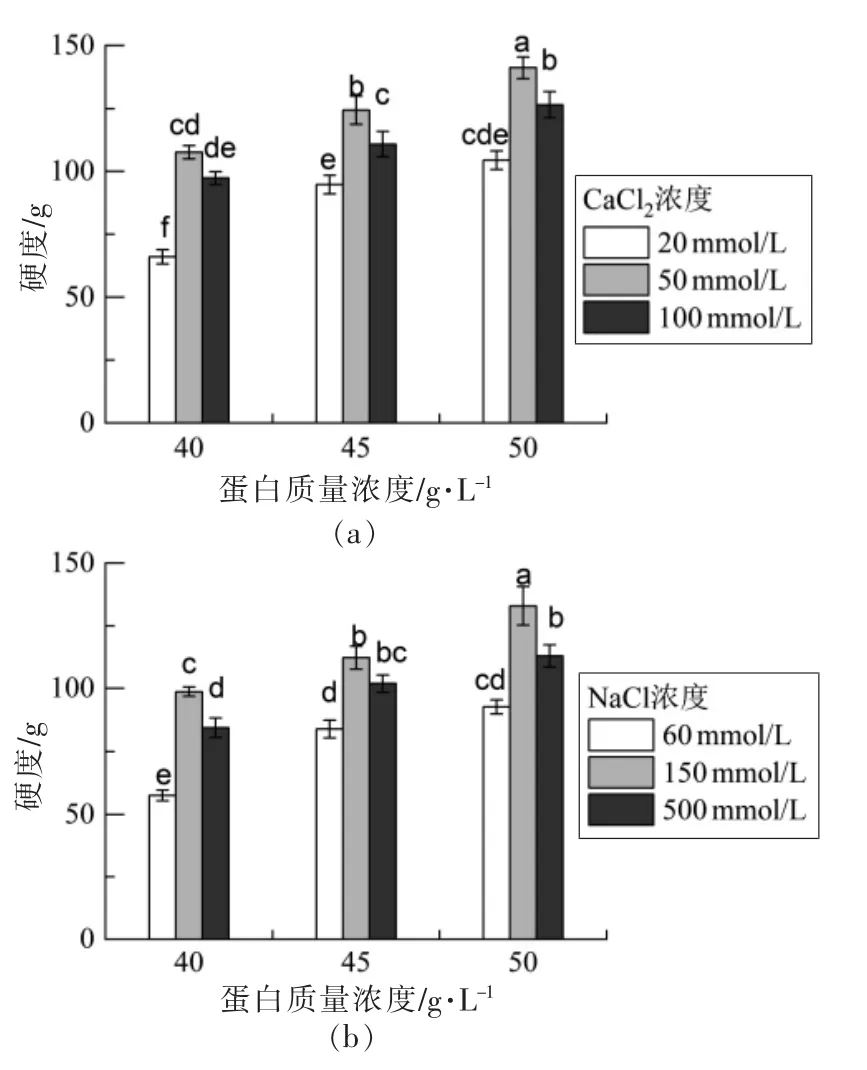
图3 添加CaCl2(a)、NaCl(b)SPI 纤维冷凝胶的硬度Fig.3 Hardness of SPI cold-set gels with CaCl2 (a)and NaCl (b) addition
2.4 持水性分析
蛋白凝胶的持水能力与其结构、网络孔径、聚合物特性和添加盐的类型有关。图4为不同盐浓度和蛋白浓度的SPI 纤维冷凝胶离心30 min 以去除水分的持水性结果。蛋白浓度越高,冷凝胶的持水性越强,这主要是因为形成的致密凝胶网络具有较强的毛细作用力。不同离子类型对凝胶样品的持水能力有显著影响(P<0.05)。同等离子强度下,添加CaCl2制备的SPI 纤维冷凝胶在离心力作用下的保水能力比NaCl 强,可能是由于二价阳离子的盐桥作用,形成了紧密的凝胶网络结构,能够截留更多的水。
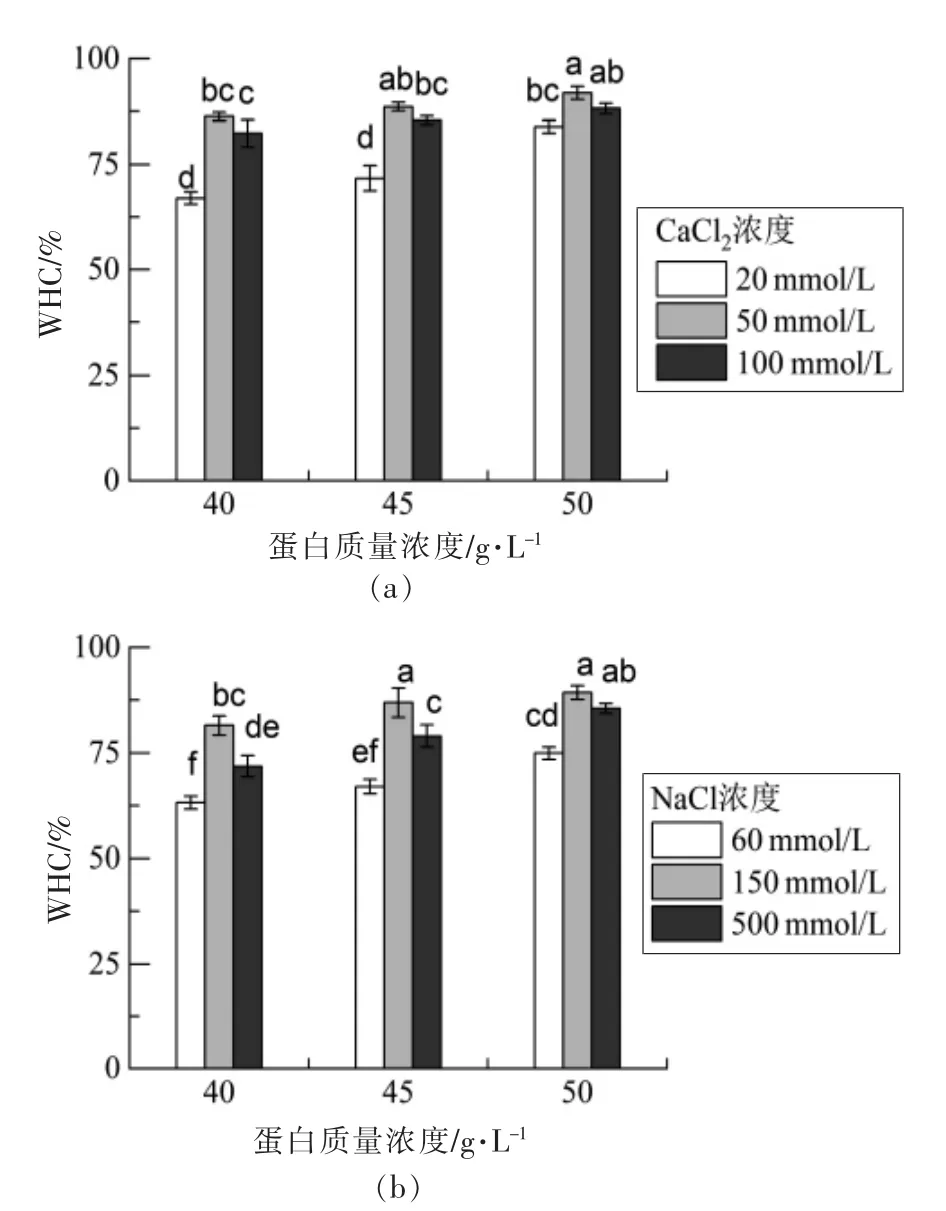
图4 添加CaCl2(a)、NaCl(b)SPI 纤维冷凝胶的持水性Fig.4 WHC of SPI cold-set gels with CaCl2 (a)and NaCl (b) addition
将蛋白质量浓度为40 g/L 的凝胶在不同的离心力(500~5 000 g)下离心10 min,测定持水性的变化,以反映施加的离心力和去除的水之间的平衡状态。曲线用方程(2)拟合,拟合参数如表2所示,不同类型的盐及其浓度对持水性有很大的影响。CaCl2和NaCl 浓度分别为50 和150 mmol/L时,总脱水量(A)最低。此外,较大的最小所需力(gmin)和较小的k 表明,凝胶网络变形较慢,水分在外力作用下更不容易从凝胶中去除。盐浓度过高时,加快了蛋白质的聚集速率,形成了结构粗糙、空隙较大的不透明凝胶,持水性下降。结合凝胶硬度结果表明,各向同性渗流和均匀的网络以及较硬的凝胶需要更多的能量来使网络变形,并且需要施加更高的外力来克服高毛细力以去除水分。Nieuwland 等[27]的研究表明卵白蛋白凝胶的凝胶硬度与保水性之间具有较强的正相关关系。Urbonaite 等[28]提出凝胶粗糙度和凝胶硬度的组合对凝胶持水性有协同作用。Mohammadian 等[16]也报道了Zn2+诱导的乳清蛋白纳米纤维水凝胶比Ca2+和Mn2+诱导的水凝胶更坚硬,在离心力下失去了更少的蛋白基质结合水。这与本文结果一致。
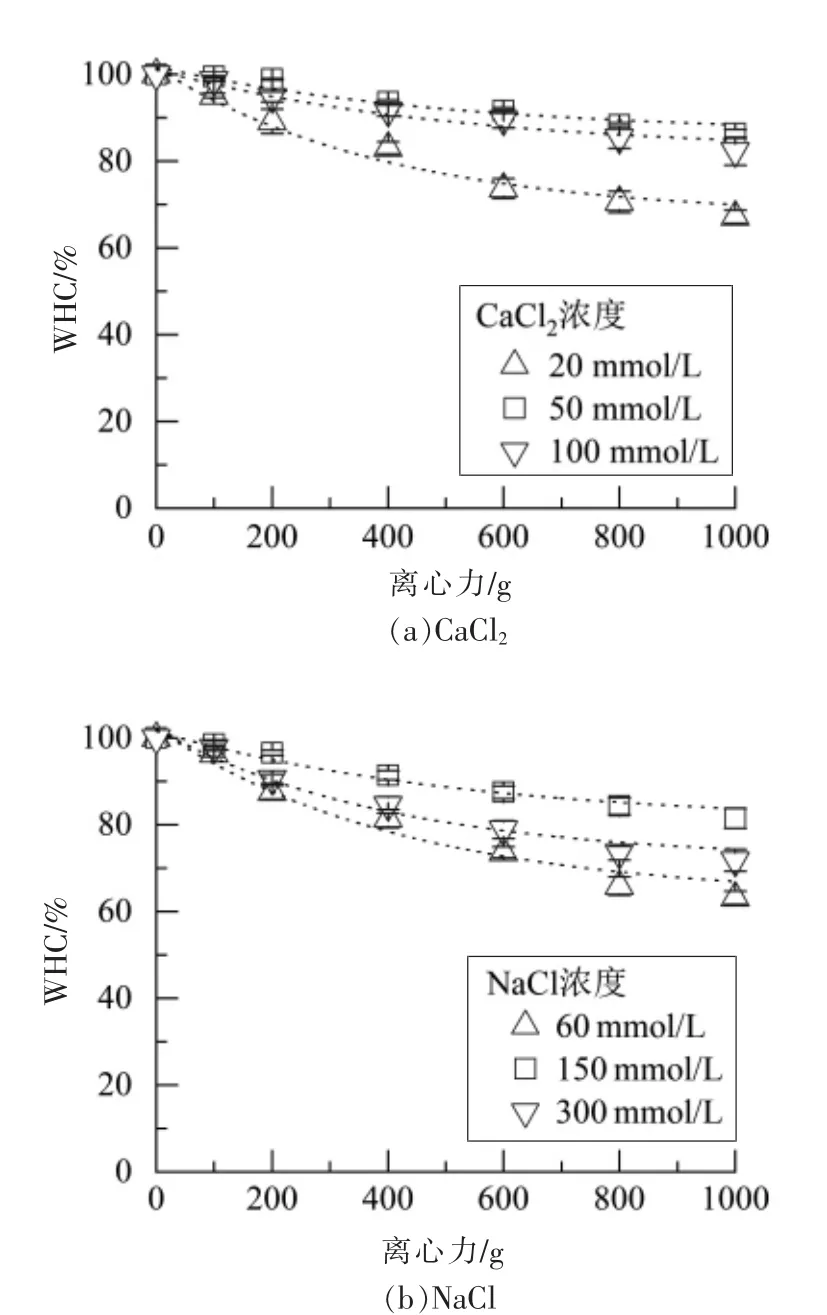
图5 不同离子对SPI 冷凝胶的持水性的影响Fig.5 Effect of different ions on WHC of SPI cold-set gels
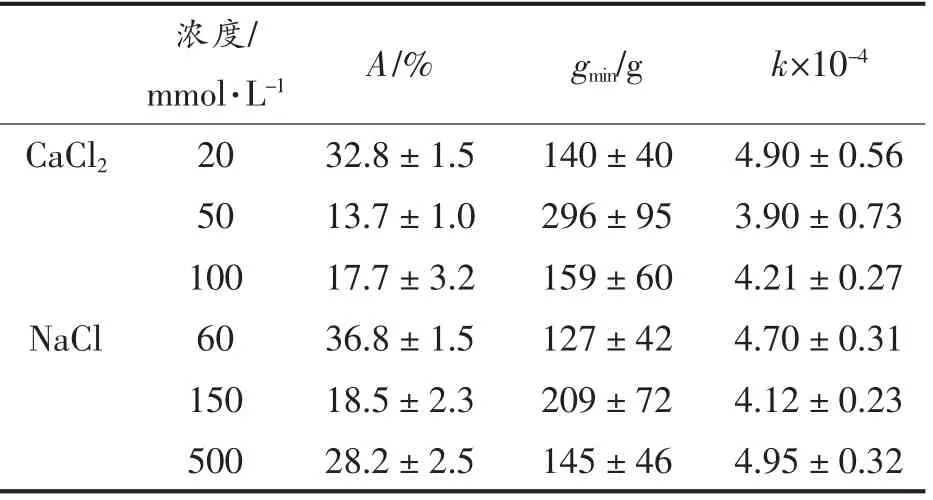
表2 持水性的拟合参数(%)Table 2 Fitting parameters of WHC (%)
3 结论
1) CaCl2和NaCl 都能够在环境温度下诱导SPI 纤维溶液形成冷凝胶。所需的cp的最低值比热凝胶低。流变学测量结果表明,随着离子强度的增加,临界渗滤浓度cp先降低后增加,标度指数t为1.1~1.9,对应于各向同性渗流和均匀的网络。
2) 随着离子强度的增加,CaCl2和NaCl 诱导的纤维冷凝胶的凝胶硬度和持水性均先增加后降低。
3) 同等离子强度下,NaCl 诱导凝胶的cp值均高于加入CaCl2的cp,说明二价阳离子形成的盐桥是形成凝胶网络的主要驱动力。
