大蒜素与乳清分离蛋白结合物的体外模拟消化特性
2022-01-10何荣海黄六容马海乐
姜 慧,邢 政,何荣海*,黄六容,马海乐
(1 江苏大学食品物理加工研究院 江苏镇江 212013 2 江苏大学食品与生物工程学院 江苏镇江 212013)
大蒜素是在蒜氨酸酶(Alliinase)的作用下生成的[1]。当大蒜破碎时,蒜氨酸酶会和蒜氨酸相遇发生反应,产生丙酮酸、氨以及包括大蒜素在内的8 种硫代亚磺酸酯[2]。大蒜素的化学性质很不稳定[3-5]。马海乐等[6]研究表明大蒜素的降解反应与温度、真空度和光照等因素均有密切关系,在温度低于80 ℃、真空和避光的条件下大蒜素较稳定。李文清等[7]研究发现温度升高,会使大蒜素水溶液的稳定性降低。在80 ℃下,大蒜素只需30 min 即可接近完全分解[8],而对于新切大蒜,大蒜素的半衰期仅为2.5 d[9]。
大蒜素的不稳定性大大降低了其利用价值。大蒜素的稳定性技术主要有制备大蒜素微胶囊、大蒜素脂质体以及大蒜素二硫键结合物等。陈建清等[10]利用β-环糊精包结络合法制备大蒜素微胶囊,产品性能良好,而β-环糊精原料价格较高。何荣海等[11-12]利用超声辅助提取大蒜辣素,提取率明显提高,且利用喷雾干燥法制备的大蒜素微胶囊,有效防止了大蒜素的破坏和损失,然而微胶囊中的大蒜素含量较低。大蒜素脂质体具有靶向性,能延长大蒜素的作用时间,而脂质体膜是动态膜,脂质体颗粒易自发聚集、沉淀,造成脂质体形态结构不稳定[13]。Jiang 等[14]制备大蒜素与乳清分离蛋白的二硫键结合物,在不同温度下贮藏后的结合物的稳定性远高于大蒜素。目前市场上大多数的蒜素产品的有效活性成分主要为大蒜素的降解产物[15],服用这些大蒜素产品后,血液和排泄物中也检测不到大蒜素。关于大蒜素在人体内的消化利用情况的报道较少,主要原因是大蒜素易挥发和降解,其降解产物有几十种,很难对其进行定量分析。目前大蒜素与蛋白的结合物在胃肠中的消化情况还未见报道。通过研究结合物的消化特性,可为更好探究及发挥其生理活性奠定基础,具有深远意义。
体外模拟消化模型与简单利用消化酶酶解相比,可以较好地模拟真实的胃肠道消化环境,预测结合物的消化特性,更好地检测样品在消化过程中发生的物理、化学变化[16]。本文利用体外模拟消化模型来探究消化过程中大蒜素的降解成分及含量的变化情况,以及大蒜素是否影响蛋白被水解程度、消化率等,以探究结合物的消化特性。
1 材料与方法
1.1 材料与试剂
胃蛋白酶10 000 U/g(来源于猪胃)、胰蛋白酶250 U/g(来源于猪胰腺),上海生工生物工程技术服务有限公司。
2,4,6-三硝基苯磺酸,美国Sigma 公司;其它化学试剂均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器与设备
7890A-5975C 气-质谱联用仪,美国安捷伦科技公司;Waters 600 高效液相色谱,美国沃特世科技公司;UDK149 凯氏定氮仪,意大利VELP 有限公司;Lite Sizer 500 激光粒度仪,奥地利Anton-Paar 公司;LYOQUEST-8 冻干机,日本Telstar公司。
1.3 试验方法
1.3.1 大蒜素的提取及乳清分离蛋白溶液的制备 新鲜大蒜去皮后用高速组织捣碎机捣碎,在25℃下酶解反应10 min。将蒸馏水与酶解液以1∶4(V/V)混合均匀,在35 ℃下提取1 h 后,于4 ℃、12 000 r/min 条件下离心10 min,取上清液。将上清液抽滤得到大蒜素水提取液[17]。
称取乳清分离蛋白粉,配制10 mg/mL 的乳清分离蛋白溶液,室温磁力搅拌2 h,于4 ℃下水合,备用[18-19]。
1.3.2 大蒜素与乳清分离蛋白结合物的制备 由于蛋白中的巯基能与大蒜素发生结合反应,因此蛋白的巯基剩余率可以表征蛋白与大蒜素的结合程度,巯基剩余率越小,结合率越高。结合物的制备参照Jiang 等[14]的方法,将蛋白进行超声预处理,提高其巯基含量,增强与大蒜素的结合能力,超声后的蛋白立即与新鲜提取的大蒜反应。测定反应结束后的剩余巯基含量,大蒜素与乳清分离蛋白(TS-WPI)结合物的结合率按照公式(1)、(2)计算。

式中:C0——反应前的蛋白巯基含量,μmol/g;C1——反应后的蛋白巯基含量,μmol/g;P——蛋白的巯基剩余率,%;R——反应的结合率,%。
1.3.3 WPI 及TS-WPI 结合物体外模拟消化样品的制备
1) 模拟口腔消化 参照Minekus 等[20]的方法,在此基础上加以修改。取20 mL 100 mg/mL WPI 及TS-WPI 结合物溶液置于消化杯中,37 ℃保温10 min 后加入相同体积的模拟口腔消化液(Simulated Salivary Fluid,SSF),其中包含口腔浓缩液16 mL,0.1 mL 0.3 mol/L 氯化钙溶液和3.9 mL 超纯水,然后调至pH 7.0,37 ℃,100 r/min 搅拌5 min 后进入胃消化阶段。
2) 模拟胃消化[21-22]先加入相同体积的模拟胃消化液(Simulated Gastric Fluid,SGF),其中包含25.6 mL 模拟胃浓缩液,0.02 mL 0.3 mol/L 氯化钙溶液,25 000 U/mL 胃蛋白酶溶液6.4 mL,2.38 mL 超纯水,用5.6 mL HCl 溶液调pH 值至3.0,于37 ℃、100 r/min 磁力搅拌下消化2 h,立即使用液氮灭酶,终止消化。收集上清液,冷冻干燥后备用。
3) 模拟肠消化[21-22]加入相同体积的模拟肠消化液(Simulated Intestinal Fluid,SIF),其中包含44 mL 模拟肠浓缩液,10 mL 160 mmol/L 猪胆盐溶液,0.16 mL 0.3 mol/L 氯化钙溶液,20 mL 800 U/mL 胰酶溶液,5.54 mL 超纯水,用0.3 mL NaOH 溶液将pH 值调至7.0,于37 ℃、100 r/min磁力搅拌下消化2 h,分别在不同消化时间(0,10,20,30,60,120 min)取出消化产物,立即使用液氮灭酶,终止消化。收集上清液,冷冻干燥后备用。
1.3.4 大蒜素提取液及结合物的体外消化产物测定
1) 固相微萃取条件[23]取5 mL 胃蛋白酶、胰蛋白酶消化120 min 的WPI 及TS-WPI 结合物的消化样品于萃取瓶中,于50 ℃、330 r/min 平衡5 min,调节固定杆位置,使萃取头距离样品液面上方0.5~1 cm,萃取20 min。萃取结束后先收萃取头,再取出萃取针。
2) 气相色谱条件 参照潘璨等[24]的方法,GC-MS 检测采用DB-wax 极性色谱柱,柱长60 m,内径0.25 mm,厚度0.25 μm,高纯氦气流量1.0 mL/min,不分流,进样口温度250 ℃,程序升温:40℃保持1 min,以5 ℃/min 的速率升至150 ℃,保持2 min,再以10 ℃/min 的速率升温至220 ℃,保持5 min。
3) 质谱条件[24-25]电离方式EI+,电子能量70 eV,电子源温度230 ℃,接口温度250 ℃,扫描质量数范围50~450 amu。数据收集用HP 化学工作站软件对照NIST08.L 库进行,成分先由谱库初步鉴定,再结合化学成分的保留时间、质谱、实际成分等定性。定量采用面积归一化法相对定量。
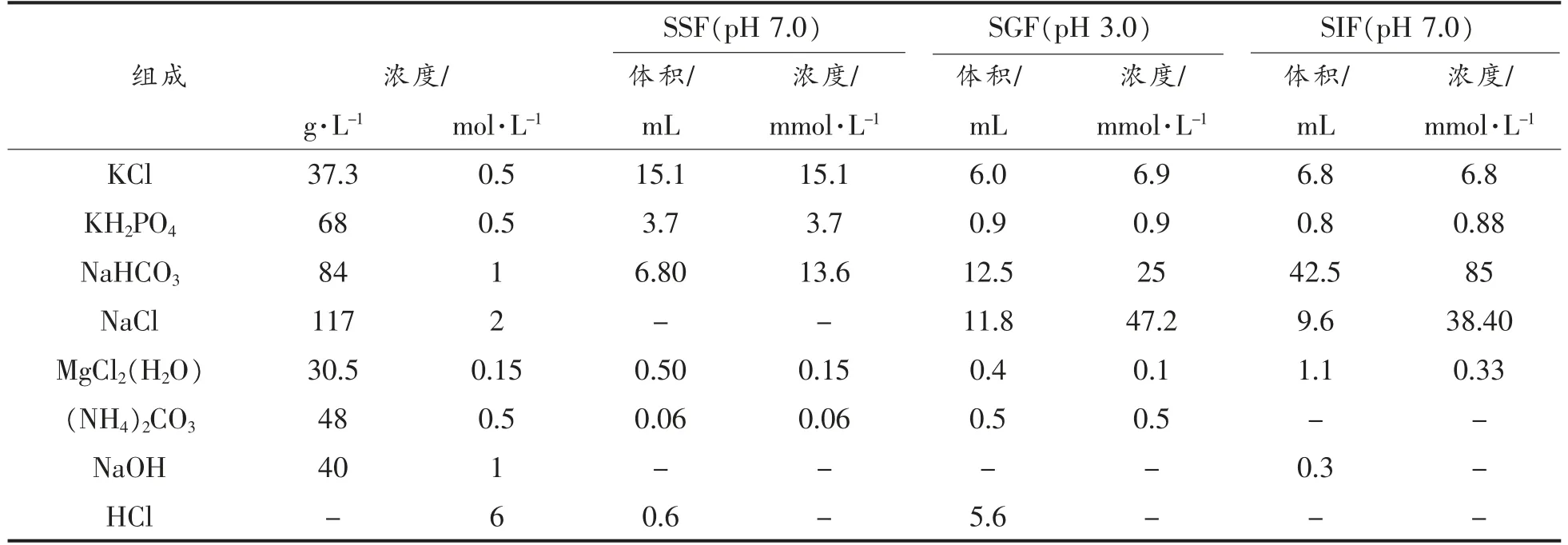
表1 模拟消化液原液的制备Table 1 Preparation of simulated digestive stock solution
1.3.5 模拟消化过程中自由氨基产量的测定 参照Adler-Nissen 等[26]的方法测定消化产物的自由氨基产量,并稍作修改。配制0~2 mmol/L L-亮氨酸溶液制作标准曲线,自由氨基的量根据L-亮氨酸含量的标准曲线 (y=128.9x-0.0011,R2=0.9997)来确定。
1.3.6 模拟消化过程中消化率的测定 体外消化率可用氮的释放量表示。采用TCA-NSI 法测定氮释放量。取15 mL 10%三氯乙酸(TCA)溶液加入不同消化时间的WPI 及TS-WPI 结合物的消化样品中,10 000 r/min 离心15 min 得到上清液,采用凯氏定氮法测定TCA 可溶性氮的含量[27]。消化过程氮释放量(NR)的计算公式:
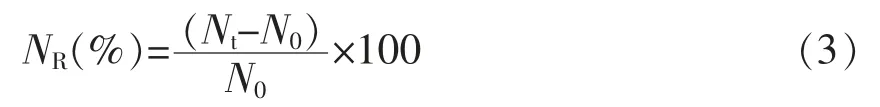
式中,NR——氮的释放量,%;Nt——消化t(min)时的TCA 可溶性氮,mg;N0——蛋白样品中的TCA 可溶性氮,mg。
1.3.7 模拟消化过程中粒径的测定 配制1 mg/mL WPI 及TS-WPI 结合物的体外消化产物溶液,采用激光粒度仪测量消化产物的粒径[28]。
1.3.8 体外消化样品分子质量分布 参照Yang等[29]的方法测定消化产物的分子质量。分别取胃蛋白酶、胰蛋白酶消化120 min 的WPI 及TS-WPI结合物的消化样品,0.22 μm 有机膜过滤,得到滤液,色谱柱:TSKgel 3000 SWXL 300×7.8 mm,流动相组成为乙腈∶超纯水∶三氟乙酸 (45∶55∶0.1,体积比),等梯度洗脱流速0.5 mL/min,检测波长220 nm,柱温30 ℃,进样体积10 μL。
根据标准液的平均洗脱量制备分子质量校准曲线:细胞色素C(12 500 u),抑酶肽(6 500 u),维生素B12(1 355 u),氧化型谷胱甘肽(612 u)和糖基甘氨酰甘氨酸(189 u)。以标准品分子质量的对数值lg (MW)为纵坐标,保留时间t 为横坐标,得到校准曲线,来计算WPI 及TS-WPI 结合物消化产物的分子质量。
1.4 数据处理与分析
所有试验重复3 次,数据结果以“平均值±标准差”表示。使用SPSS 17.0(美国IBM 公司)进行单因素方差分析,显著性水平P 设定值为0.05,使用Origin 8.6(美国OriginLab 公司)绘制图形。
2 结果与分析
2.1 大蒜素提取液的体外模拟消化产物分析
大蒜素提取液的模拟消化产物的总离子流图见图1。鉴定出的各组分成分及相对含量见表2。保留时间0.00~37.00 min 内,从未消化的大蒜素提取液中共检测出9 种挥发性成分,其中,含硫化物有3 种,分别为1,3-二噻烷、二烯丙基二硫和3-乙烯基-1,2-二硫环己-4-烯,占挥发性化合物总含量的40.09%。这3 种为大蒜素的降解产物,其中3-乙烯基-1,2-二硫环己-4-烯为主要成分,占含硫化合物的92.72%。其余挥发性组分为正棕榈酸、冠醚类和邻苯二甲酸二异丁酯等。
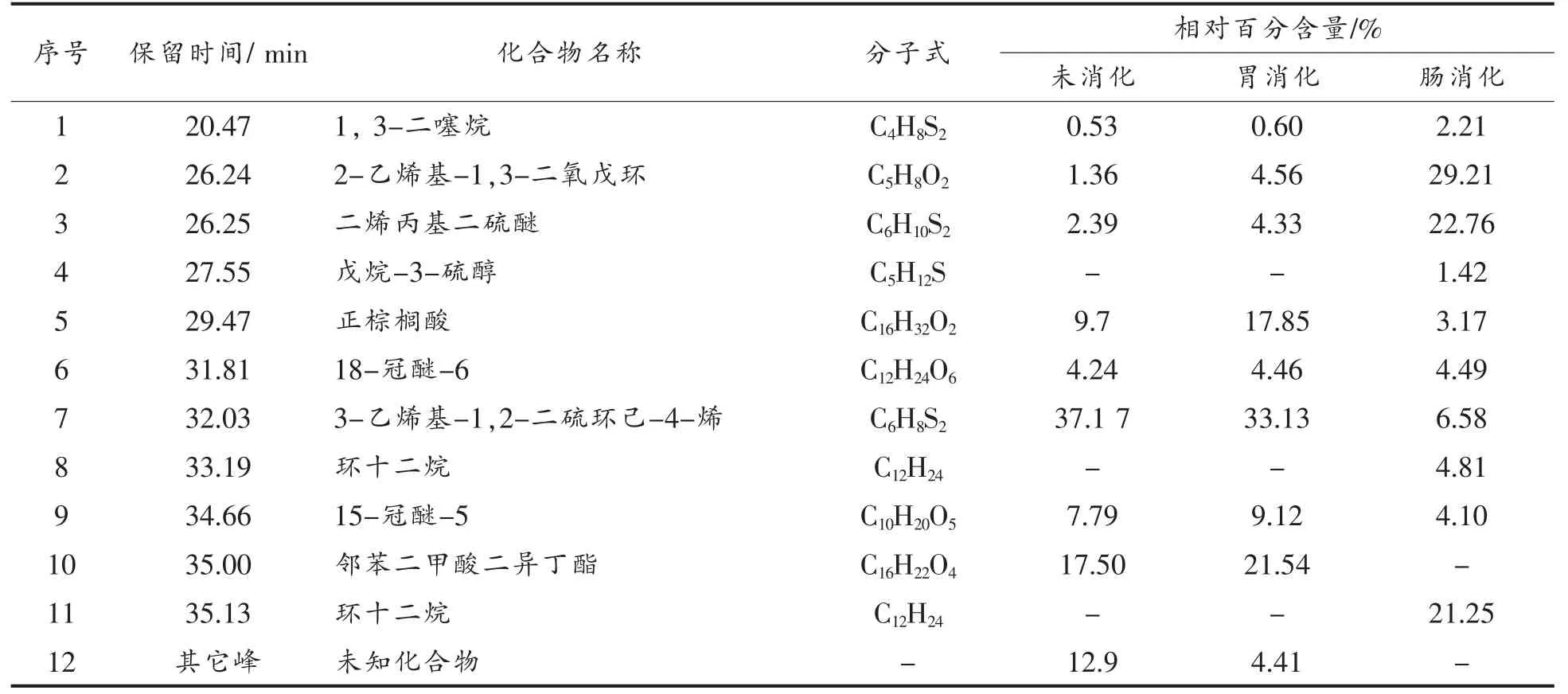
表2 大蒜素提取液体外消化产物的挥发性成分Table 2 Allicin extracts volatile constituents of digested products outside the liquid
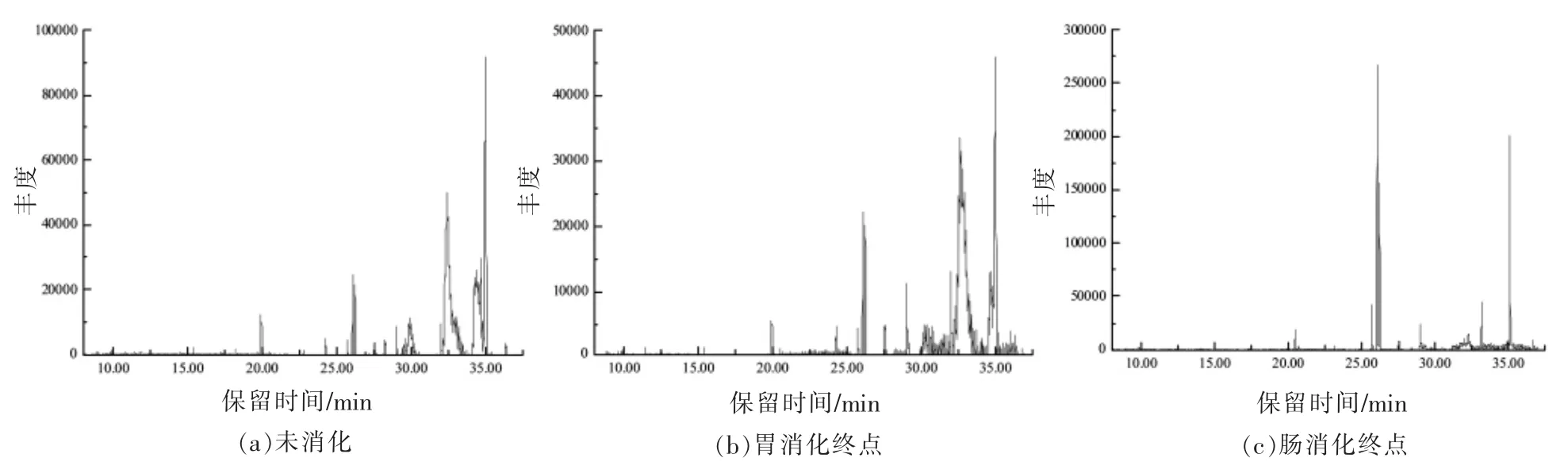
图1 大蒜素提取液的体外消化产物的总离子流图Fig.1 Total ion chromatogram of in vitro digestion products of allicin extraction solution
大蒜素提取液经模拟胃消化后,1,3-二噻烷和二烯丙基二硫含量均提高,3-乙烯基-1,2-二硫环己-4-烯含量降低不明显,仍为含量最高的化合物,3 种含硫化合物共占挥发性总含量的38.06%,较未消化前含量降低。肠消化终点,挥发性成分的种类和含量发生变化,含硫化合物的含量降低,占挥发性成分总含量的31.55%,二烯丙基二硫醚含量增加 (P<0.05),占含硫化合物的72.14%,说明经肠消化,大蒜素降解产物的主要成分由3-乙烯基-1,2-二硫环己-4-烯变为二烯丙基二硫醚。正棕榈酸和邻苯二甲酸二异丁酯含量都表现为下降。
2.2 TS-WPI 结合物的体外模拟消化产物的分析
TS-WPI 结合物的模拟胃、肠消化产物的总离子流图如图2所示。鉴定出的各组分成分及相对含量见表3。在保留时间0.00~37.00 min 内,从未消化结合物中共检测出11 种挥发性成分,其中,含硫化合物共5 种,分别为亚丙基硫2.49%、1,3-二噻烷1.16%、二烯丙基二硫19.77%、戊烷-3-硫醇14.84%和3-乙烯基-1,2-二硫环己-4-烯23.02%,占挥发性化合物总含量的61.28%。其中3-乙烯基-1,2-二硫环己-4-烯为主要成分,与大蒜素提取液中相同,而二烯丙基二硫醚含量比大蒜素提取液中含量高。结合物经模拟胃消化后,二烯丙基二硫、3-乙烯基-1,2-二硫环己-4-烯含量有所降低,出现戊酸异丙酯类物质。3 种含硫化合物共占总挥发性含量的43.81%。肠消化终点,含硫化合物含量降低,占挥发性化合物总含量的42.77%,而二烯丙基二硫醚含量(35.88%)增加(P<0.05),为含硫化合物的主要成分,并出现环十二烷、邻苯二甲酸二异丁酯等物质。
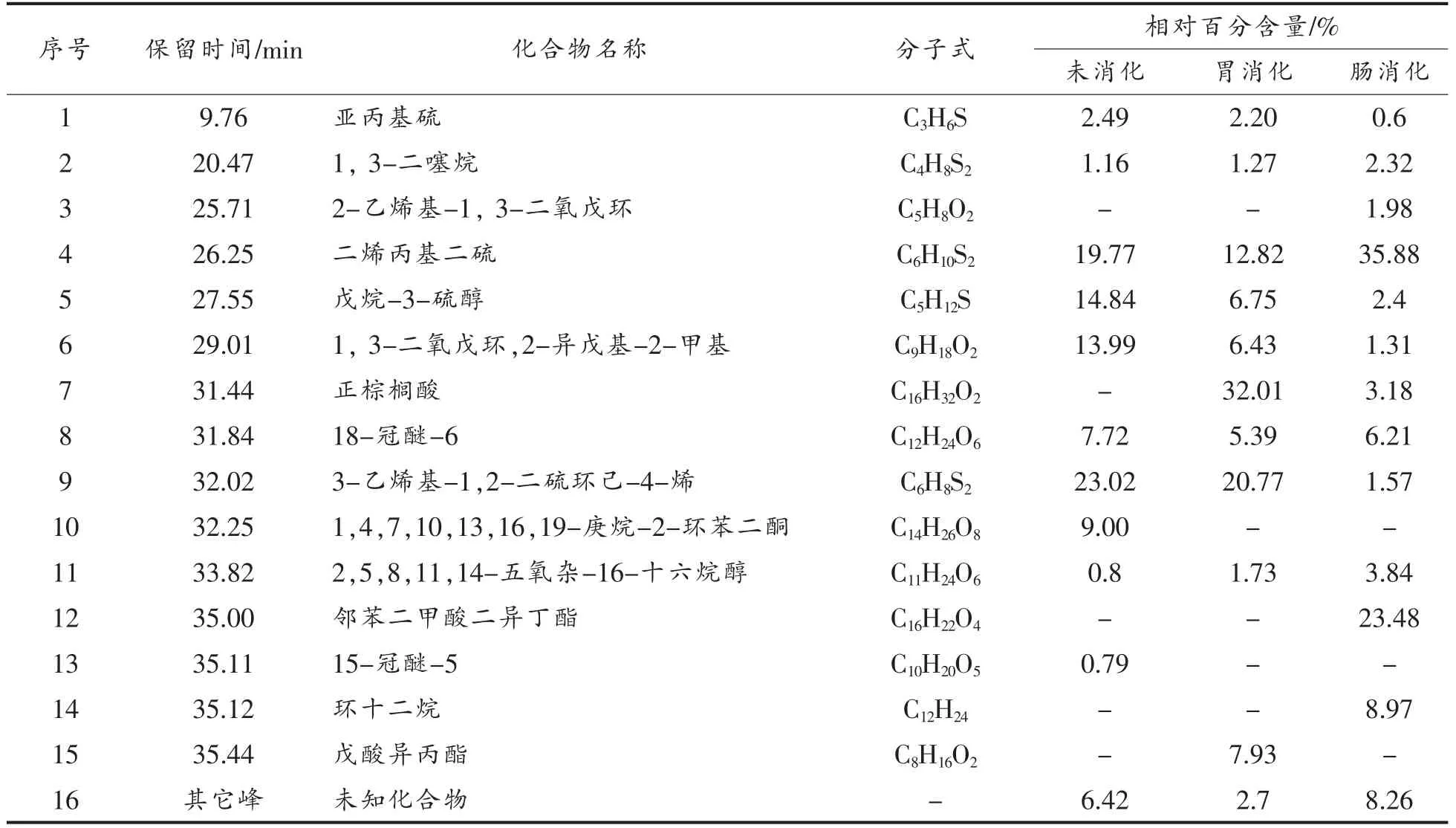
表3 超声预处理的TS-WPI 结合物(61%结合率)体外消化产物的挥发性成分Table 3 Ultrasonic pretreated TS-WPI conjugate (61% binding rate) volatile components of in vitro digestion products

图2 超声预处理的TS-WPI 结合物(61%结合率)体外消化产物的总离子流图Fig.2 Total ion chromatogram of ultrasonically pretreated TS-WPI conjugate (61% binding rate) in vitro digestion products
综上,模拟消化试验表明,大蒜素提取液与结合物在胃、肠消化后挥发性成分中的含硫化合物含量均降低,在肠消化阶段消化产物的挥发性成分更为复杂。大蒜素与蛋白结合后,胃、肠消化产物的含硫化合物组分与大蒜素提取液的消化产物相同,3-乙烯基-1,2-二硫环己-4-烯主要在模拟胃消化阶段被释放,而二烯丙基二硫醚主要在模拟肠消化时被释放。由此可知大蒜素与蛋白结合后不会影响大蒜素消化产物的生理活性的发挥。
2.3 结合率对WPI 及TS-WPI 结合物体外消化过程中自由氨基产量的影响
结合率对WPI 及TS-WPI 结合物消化过程中自由氨基产量的影响如图3所示。在胃消化阶段,所有样品的自由氨基的量都呈缓慢上升趋势。在胃消化终点,自由氨基物质的量在0.08~0.10 mol,自由氨基的释放量可以体现蛋白质的水解情况,因此WPI 及TS-WPI 结合物在胃消化阶段的水解度都很低。王娟等[30]分别用胃蛋白酶和胰蛋白酶酶解乳清蛋白,测得其水解度分别为8.00%和61.02%。这是由于乳清蛋白中含有β-乳球蛋白(β-Lg),β-Lg 中β-折叠结构会埋藏氨基酸残基间的靶肽键,导致胃蛋白酶不易与结合位点结合,使β-Lg 在胃酸性环境中对胃蛋白酶具有抗性,从而降低了胃蛋白酶的水解度。WPI 与TS-WPI 结合物的水解度无显著性差异,表明大蒜素结合蛋白后没有改变其在胃消化时的水解情况。

图3 结合率对WPI 及TS-WPI 结合物体外消化过程中自由氨基含量的影响Fig.3 Effect of binding rate on free amino content of WPI and TS-WPI conjugates during in vitro digestion
在肠消化的前20 min,自由氨基的释放量显著提高,表明样品刚进入肠道后水解度急剧增加。随着消化时间的增加,自由氨基的量逐渐趋于稳定。在肠消化终点,不同结合率的结合物的自由氨基的量没有显著性差异,都小于超声预处理的蛋白的自由氨基的量,表明超声使蛋白在模拟肠消化时的水解度增加,而蛋白结合大蒜素后的水解度并无显著性变化。综上,结合物都在胃蛋白酶阶段不易水解,在胰蛋白酶阶段更易水解,大蒜素不影响蛋白在模拟胃肠消化时的水解度。
2.4 结合率对WPI 及TS-WPI 结合物体外消化率的影响
结合率对WPI 及TS-WPI 体外消化率的影响如图4所示。WPI 及TS-WPI 结合物的在胃、肠阶段的体外消化率都呈现上升趋势。在胃消化阶段,超声后的蛋白消化率较高,与结合物相比具有显著性差异,原因可能是超声产生的空化作用使WPI 的结构伸展,从而与消化酶的结合位点增多,使消化率得到提高。所有样品的消化率在16.00%~22.28%范围内,消化率偏低,且大蒜素不会影响WPI 在模拟胃消化时的消化率。Mahé 等[31]研究证明,在人胃中检测到的大部分乳清蛋白仍为完整蛋白质,这也说明乳清蛋白在胃中较不容易被消化。
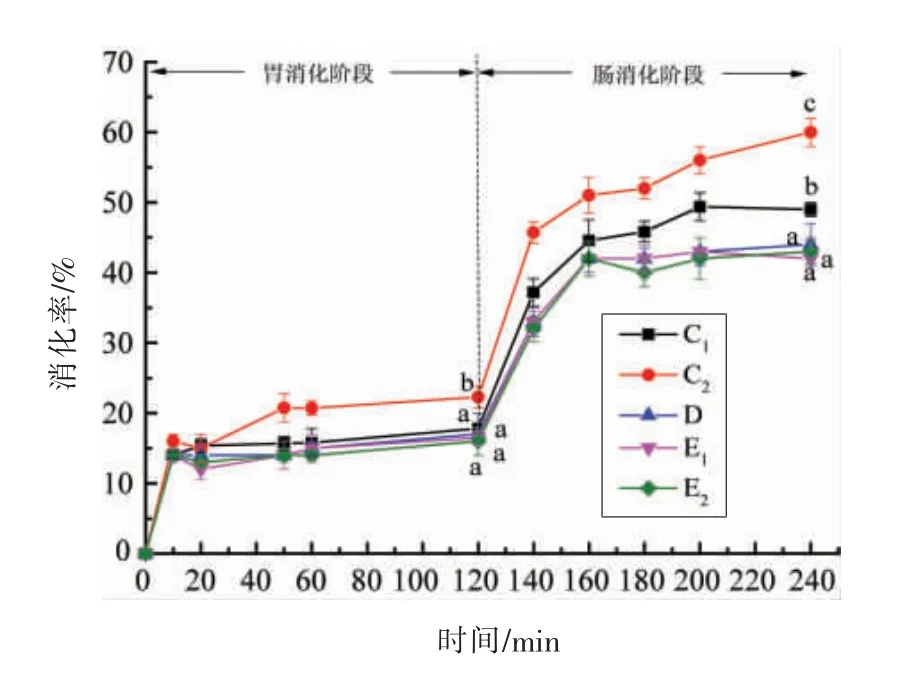
图4 结合率对WPI 及TS-WPI 结合物体外消化率的影响Fig.4 Effect of binding rate on in vitro digestibility of WPI and TS-WPI conjugates
在肠消化阶段,消化率大小依次为超声的WPI(超声)>WPI(未超声)>61%结合率的结合物>38%结合率结合物(超声)>61%结合率结合物(超声),所有样品的消化率都在40%以上。其原因是样品消化率与水解度有关,样品水解为一种预消化的肽段形式,更容易被机体消化利用。蛋白超声后变得更易被消化,而TS-WPI 结合物的消化率较WPI 低(P<0.05),不同结合率的结合物的消化率没有显著性差异。原因一方面可能是蛋白与大蒜素结合后空间结构发生变化,导致酶与底物的活性位点改变;另一方面可能与样品的溶解度有关,大蒜素结合蛋白后溶解度降低,消化率略微降低[32]。总体来说,结合物与蛋白相比变得较不易被消化,结合物在模拟肠消化阶段更易被消化。
2.5 结合率对WPI 及TS-WPI 结合物体外消化产物粒径的影响
WPI 及TS-WPI 结合物在模拟胃、肠消化过程中的粒径大小如图5所示。消化前,超声后的蛋白平均粒径最小,为1 302 nm。结合物的平均粒径均大于蛋白,61%结合率的结合物的平均粒径最大为2 510 nm,平均粒径的大小可间接反映溶液中粒子间的相互作用情况,大蒜素结合蛋白后,粒子间的相互作用较强烈。随着消化时间的增加,样品的粒径均为下降趋势,在肠消化阶段粒径的减小更明显。在肠消化终点,WPI、超声的WPI、61%结合率的结合物、38%和61%结合率的结合物(超声) 的肠消化产物平均粒径为400.29,448.29,690.30,478.74,687.90 nm。大蒜素结合蛋白后,结合物的消化产物的平均粒径均比蛋白消化产物的平均粒径大(P<0.05)。这可能是结合物消化产物表面的亲水性基团较蛋白少,影响结合物颗粒的水化膜,使颗粒聚集所致。
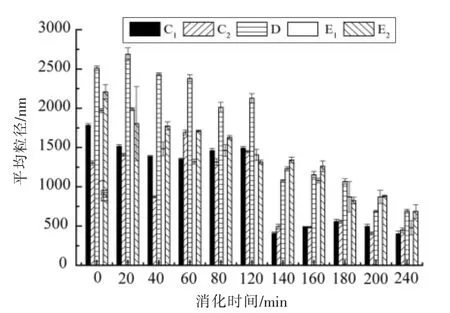
图5 结合率对WPI 及TS-WPI 结合物体外消化产物粒径的影响Fig.5 Effect of binding rate on particle size of WPI and TS-WPI conjugates in vitro digestion products
结合率对WPI 及TS-WPI 体外消化产物多分散指数的影响见表4。多分散指数(PDI)可以反映粒子粒径的均一性。PDI<0.05 为单分散体系,PDI<0.08 为近单分散体系,PDI 在0.08~0.7 范围属于适中分散度的体系。PDI>0.7 是尺寸分布非常宽的体系。由表4可知,胃、肠消化产物为适中分散度的体系,随着消化时间的增加,PDI 值逐渐减小。胃、肠消化后PDI 值分别在0.25~0.36 和0.19~0.27 之间,表明肠消化时颗粒分布更为集中,更加均匀。结合率越高,TS-WPI 结合物的PDI 值越大(P<0.05),颗粒分布范围越广。

表4 结合率对WPI 及TS-WPI 结合物体外消化产物多分散指数的影响Table 4 Effect of binding rate on polydispersity intelligence index of in vitro digestion products of WPI and TS-WPI conjugates
2.6 结合率对WPI 及TS-WPI 结合物体外消化产物分子质量分布影响
溶液颗粒粒径的大小易受分子结构舒展状态、粒子间相互作用及聚集状态等因素的影响。为更好地研究结合物在体内被消化程度,测定结合物的分子质量。WPI 及不同结合率的TS-WPI 结合物的模拟消化产物的分子质量色谱图见图6,分子质量分布情况见表5。由表5可知,经胃消化后,样品的分子质量范围主要分布在20~100 ku之间,这部分的峰面积占总面积的70%左右。对于分子质量大于100 ku 的组分,胃消化产物含量与消化前相比明显减少,蛋白由1.97%降到0.04%。61%结合率的结合物(超声)由0.23%降到0。结合物分子质量大于100 ku 的组分都比蛋白或超声后的蛋白低,并有显著性差异(P<0.05)。对于小于20 ku 的组分,WPI、超声后WPI 和超声预处理后的结合物经模拟胃消化后,在此分子质量范围的含量分别增加27.06%,22.53%,18.22%,结合物比蛋白的含量高(P<0.05),表明大蒜素与蛋白的结合物的小分子质量组分更多。
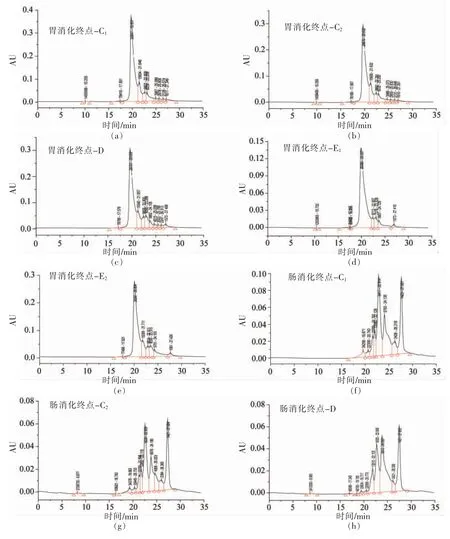
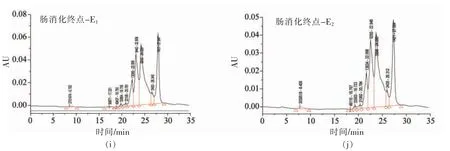
图6 WPI 及TS-WPI 结合物体外消化产物的分子质量色谱图Fig.6 Molecular weight chromatogram of in vitro digestion products of WPI and TS-WPI conjugates

表5 结合率对WPI 及TS-WPI 结合物体外消化产物分子质量分布的影响Table 5 Effect of binding rate on molecular weight distribution of in vitro digestion products of WPI and TS-WPI conjugates
在肠消化终点,分子质量分布范围向小分子质量靠近。分子质量大于50 ku 的组分最高,仅占0.78%,10 ku 以下的组分占80%左右,大于5 ku的组分含量比WPI 少,小于5 ku 的组分含量都比WPI 多(P<0.05),不同结合率的结合物的分子质量分布没有显著性差异。经模拟胃肠消化后蛋白和大分子多肽被分解为分子质量更小的多肽,TSWPI 结合物在胃、肠消化时小分子质量组分更多,更易被吸收利用。
3 结论
体外模拟胃、肠消化试验表明,大蒜素提取液与结合物经胃、肠消化后,含硫化合物的含量降低,其中在模拟肠消化阶段的挥发性成分更为复杂。结合物的消化产物在模拟胃、肠消化时的含硫化合物的组成成分与大蒜素提取液的消化产物相同,表明大蒜素结合蛋白后稳定性增加的同时,大蒜素生理活性的发挥也可能不受影响。乳清蛋白和结合物都在胰蛋白酶消化阶段更容易水解,大蒜素不影响蛋白在模拟胃、肠消化时的水解度。大蒜素结合蛋白后,结合物的消化产物的粒径分布范围较广。蛋白及结合物经模拟胃、消肠化后分子质量分布范围向小分子质量靠近,结合物与蛋白相比更容易被吸收利用。
