基于微生物群体感应的固定化黑曲霉生产柠檬酸
2022-01-10卢宗梅
卢宗梅
(中粮生物化学(安徽)股份有限公司,安徽蚌埠233316)
近几十年来,依赖于自动控制、材料和机械等学科的发展,发酵装备与控制系统取得了长足进步,深层液态发酵成为了柠檬酸等生物化工产品最主要的生产方式。但是液态深层发酵也存在着一些天然缺陷:黑曲霉易受流体剪切压力影响,环境的耐受性差,重复利用率低,即便采用连续发酵方式,也极易出现衰退、凋亡;同时,麸曲制备需要大量的人力资源和能源,这也成为了目前柠檬酸发酵难以有突破性发展的主要瓶颈之一[1-2]。因此,建立一种黑曲霉细胞高密度聚集、环境耐受性强和可连续重复利用的新型发酵工艺成为解决柠檬酸产业困境的关键,也是行业共同关注的热点和焦点[3]。
与传统游离发酵相比,固定化发酵因其具备明显的优势,在生物化工产品的生产上得到了越来越广泛的关注和应用[4-5]。固定化发酵可以不间断地进行,减少了每批次种子液的培养时间,大大节省了生产时间和成本。同时,固定化生长的细胞会促进代谢的进行,使细胞的活性显著增强,明显缩短生产周期,提升产量,提高时空效率[6]。传统的固定化方法主要采用凝胶包埋技术(如卡拉胶、海藻酸钙)、自絮凝技术以及近年来流行的新型吸附介质秸秆渣等[7],达到固定化细胞的目的。该方法利用凝胶等可塑性强的载体对微生物细胞进行束缚,将其生长空间限定在一定范围,对细胞的活性基本没有影响[8]。凝胶成型方便且具有固定化密度高等优点,因此该方法应用得较为广泛[9-11]。但是,在高溶氧、高剪切力的环境下,凝胶载体力学强度差、易破碎,无法长时间保持固定化发酵的状态,从而限制了其在柠檬酸发酵以及其他工业上的应用。基于微生物群体感应开发的生物膜固定化技术是一种新型的吸附法[12]。罗虎等[13]通过此法将酵母快速富集并产生大量生物膜,实现了高浓度酒精发酵。
本文中,针对黑曲霉无法形成适于发酵的生物膜问题,笔者提出了基于微生物群体感应的生物膜催化体系,对介质的各种物理性质进行系统的优化,筛选出合适的固定化介质,使黑曲霉可以吸附在上面,形成合适的生物膜。同时,针对传统发酵中添加的营养成分可能对固定化发酵不利的问题,重点研究氮源、磷源和麸皮水解液对固定化发酵的影响,并分析固定化发酵工艺的可行性,以期达到开发连续高效低成本的新型柠檬酸生产工艺的目的。
1 材料和方法
1.1 菌株
黑曲霉831,从ATCC12846菌株中诱变筛选得到,保藏于笔者所在实验室。
1.2 培养基及培养条件
PDA培养基:称取大约200 g土豆,削皮,切成1 cm3大小的小块,加入600 mL水,煮沸30 min,然后用4层纱布过滤,得到的土豆汁定容至1 L,再加入20 g/L的葡萄糖和15 g/L的琼脂粉,115 ℃灭菌20 min。
黑曲霉发酵合成培养基(g/L):葡萄糖100, (NH4)2SO42、NaNO31、 KH2PO40.5、MgSO4·7H2O 0.3;用水或麸皮水解液定容至1 L。
麸皮水解液:称取15 g/L的麸皮,加入800 mL水,煮沸1 h后,用4层纱布过滤得滤液,用水再定容至1 L。
黑曲霉发酵木薯培养基:称取160 g 木薯粉和40 g玉米粉,加入800 mL麸皮水解液,200 μL液化酶(酶活20 000 U/g),搅拌均匀,然后加热至86 ℃,保温2 h后,4 000 r/min离心10 min取上清液,最后定容至1 L。
固定化介质预处理:将载体用1 mol/L的NaOH浸泡1 h,用纯水洗净后,在1 mol/L盐酸中浸泡1 h,之后用纯水冲洗至pH为中性,再放入65 ℃烘箱中烘干至恒质量。将剪成不同大小的载体适量加入培养基中,115 ℃下共同灭菌20 min,冷却待用。
黑曲霉活化:用接种环挑取些许孢子至PDA平板上,划线使其分布均匀。36 ℃培养箱中培养4 d,用适量的水将孢子刮下,制得孢子悬液,待用。
单批次发酵:500 mL三角瓶装液量100 mL,以1%(体积分数)的接种量将孢子悬液接种于培养基中,36 ℃、300 r/min摇床中培养,每隔一段时间取样2 mL至离心管中,12 000 r/min离心5 min,将上清液与沉淀分离,测定上清的还原糖含量、柠檬酸含量以及菌的干质量。
固定化连续发酵:第一批的培养方法与单批次发酵相同。当培养基中糖质量浓度低于5 g/L时,将培养基倒出,然后补入新的培养基进行第二批发酵。之后的批次同该操作。
1.3 分析方法
1.3.1 还原糖、总糖及柠檬酸的测定
总糖含量的测定:取适量的样品加入50 mL离心管中,然后加入5 mL浓H2SO4和5 mL纯水,沸水浴10 min,使总糖完全水解。置于冰水中冷却后,加一滴酚酞指示剂,用6 mol/L的NaOH中和至微红色,最后定容至50 mL。之后按照3,5-二硝基水杨酸(DNS)法测定水解后的还原糖含量,即总糖含量。
标准曲线的绘制:配制质量浓度为0~1.0 g/L的一系列糖标准溶液,各浓度分别取0.5 mL加入15 mL离心管中,然后在每个离心管中加入0.5 mL DNS溶液,将离心管置于沸水浴中反应5 min后,置于冰水中冷却,之后每个离心管中加入8 mL纯水,混匀后测定波长540 nm下的吸光值A540,以0 g/L为对照。以标准溶液的浓度为纵坐标,吸光值A540为横坐标绘制标准曲线。
样品测量方法:样品适当稀释之后,测量方法同上。不同的糖对应不同的标准曲线。
柠檬酸的测定:采用1100系列高效液相色谱(安捷伦公司)对柠檬酸含量进行测定,配制质量浓度为0~10 g/L的一系列柠檬酸标准液,吸取1 mL,用0.22 μm的滤膜过滤后装入液相小瓶中待测。分析条件如下:RID示差检测器;流动相为5 mmol/L H2SO4;Bio-Rad的Aminex HPX-87H有机酸柱,流速为0.6 mL/min;进样量20 μL,柱温55 ℃,停止时间20 min。测定不同浓度样品的峰面积,以标准溶液的浓度为纵坐标,对应的峰面积为横坐标绘制标准曲线。样品测定时,将上清液进行适当稀释后吸取1 mL,用0.22 μm的滤膜过滤后装入液相小瓶中待测。测得的峰面积代入标准曲线算出浓度。
1.3.2 菌体干质量的测定
培养基中的菌丝干质量:将所取样离心后的沉淀用纯水洗2次后,置于100 ℃烘箱中,24 h后烘干至恒质量,称量并记下离心管的质量。之后再用6 mol/L NaOH将离心管中的菌丝去除干净,再次在100 ℃烘箱中烘至恒质量后,称量并记下空离心管的质量。用之前的质量减去空离心管的质量即为培养基中游离菌丝干质量。
载体上固定化的菌丝干质量:将瓶中的所有载体用纯水冲洗3次后,置于100 ℃烘箱中,24 h后烘干至恒质量,称量并记下载体的质量。之后再用6 mol/L NaOH将载体上的菌丝去除干净,再次在100 ℃烘箱中烘至恒质量后,称量并记下空载体的质量。用之前的质量减去空载体的质量即为固定化细胞干质量。
1.3.3 扫描电子显微镜(SEM)观察生物膜
将固定化发酵后的载体取出,用PBS缓冲液冲洗3遍吸附的菌丝。-80 ℃冰箱放置过夜后置于冻干机(Labconco公司)中冻干。再将载体通过导电胶粘在点镜台上,20 mA、30 s进行喷金。然后用TM3000扫描电子显微镜(Hitachi公司)观察分析,放大倍数在50、100和200倍左右。
2 结果与讨论
2.1 固定化介质的优化
2.1.1 固定化介质的疏水性对黑曲霉固定化发酵的影响
为了获得最适宜的黑曲霉固定化发酵介质,首先考察介质表面疏水性对黑曲霉固定化发酵的影响,以柠檬酸高产菌株黑曲霉 831为出发菌株,通过固定化发酵以及游离发酵来对比考察3种不同疏水性的载体PUF、PPF和PAF201(疏水性从大到小依次为PUF、PAF201、PPF)效果,结果如图1和表1所示。
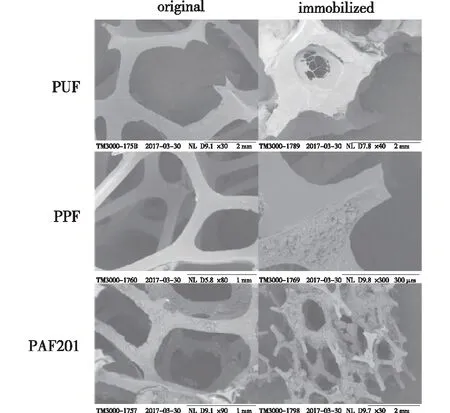
图1 3种原始载体以及它们固定化发酵后的扫描电镜图像Fig.1 SEM images of Aspergillus niger 831 cultured with three different support carriers
由图1和表1可知:与游离发酵相比,只有PAF201在固定化发酵过程中表现出更好的效果,PAF201固定化黑曲霉的柠檬酸产量为80.5 g/L,产率达到了82.9%,而游离发酵仅有61.2%,相比而言,固定化的产率提升了35.4%。PPF固定化的发酵结果与游离发酵的结果基本相同,而PUF的固定化效果比游离发酵的效果差。

表1 不同载体的发酵结果
此外,3种载体固定的黑曲霉干质量有着显著的差异。在PUF的固定化体系中,有21.5 g/L细胞固定在了载体上,而游离细胞仅为1.38 g/L,这表明几乎所有的菌丝都被吸附在载体上。但是大量菌丝在发酵过程中堵塞了载体孔径,而且菌丝紧紧地包裹着载体,并且互相交联缠绕,形成了一个白色紧密的块状物,这会导致载体中间大部分的菌丝都因缺乏营养和氧气而死亡。与PUF相反,黑曲霉在PPF上的吸附量很少,游离细胞的干质量与游离发酵的细胞干质量几乎相同,可见只有少数菌丝被吸附在载体上,不能形成成熟的生物膜。因此,与PUF和PPF相比,PAF201更适合黑曲霉的固定化发酵。
由图1还可知,黑曲霉在不同载体上形成了不同的生物膜。对PAF201而言,适量的细胞被固定在载体上,形成成熟的生物膜,菌丝从生物膜中伸出。由于菌丝在载体上的分布较为松散,因此它们不会堵塞毛孔,阻止养分的传递。死菌丝可以从载体上脱落进入培养基,而活性细胞则继续吸附在载体上。这样的细胞动态平衡有助于保持载体上细胞的发酵活性,维持固定化系统的发酵性能[14]。
适合的吸附载体是黑曲霉固定化发酵的关键因素。黑曲霉孢子壁具有很强的疏水力,它会促使发酵过程中的孢子团聚以及载体吸附等过程[15]。PAF201、PPF和PUF具有不同的疏水力,它们在固定化发酵中表现出不同的效果。因为PUF载体具有强疏水性,所以在遇到同样是强疏水的黑曲霉孢子时,可通过强疏水相互作用吸附在一起,并在载体上进行生长。因为PPF具有很弱的疏水力,孢子与载体表面无法产生足够的疏水作用,因此无法形成生物膜。PAF201具有合适的疏水性,可以适当地吸附黑曲霉的孢子,所以PAF201固定化体系可以显著提高黑曲霉的发酵效率。
2.1.2 载体孔径大小以及载体添加量对固定化发酵的影响
由于在固定化时,黑曲霉会在载体孔径内吸附生长,因此,孔径的空间大小也会影响固定化发酵的效果。因此考察不同孔径(0.2、0.6和1.5 mm)的PAF201载体对黑曲霉固定化发酵的影响,结果如图2所示。由图2可知:载体孔径的增加导致固定的细胞干质量大幅减少和游离细胞干质量增加。在孔径0.2 mm的载体上,由于孔径过小,菌丝很容易长满孔径中的空间,这限制了内层菌丝获得外部营养的能力。1.5 mm孔径载体上的固定化黑曲霉干质量明显低于0.6 mm的载体,因为在较大的孔隙的载体上结合的生物膜很容易被旋转以及涡流等产生的剪切力给消除。因此,孔径1.5 mm的载体几乎无法固定黑曲霉,其发酵性能与游离细胞发酵相似;而0.6 mm孔径的PAF201可以固定适量的黑曲霉,形成稳定的生物膜,柠檬酸产量最高。
为了确定最佳载体添加量,研究了添加0.5、1.0和3.0 g/L的PAF201对黑曲霉固定化的影响,结果如图3所示。由图3可知:在培养基中添加1.0 g/L载体时,固定化的效果最好;随着载体数量的增加,载体上的菌丝量开始增加,游离细胞干质量减少。同时可以发现,添加3.0 g/L载体后菌丝已经将载体的孔径封住了,这可能是由于载体自身具有的最大吸附能力造成的[16]。当载体数量过多,几乎所有菌丝都被吸附在PAF201上,使固定化的细胞无法与游离的细胞形成动态平衡。因此,在黑曲霉固定化发酵中,载体PAF201的最适添加量为1.0 g/L。
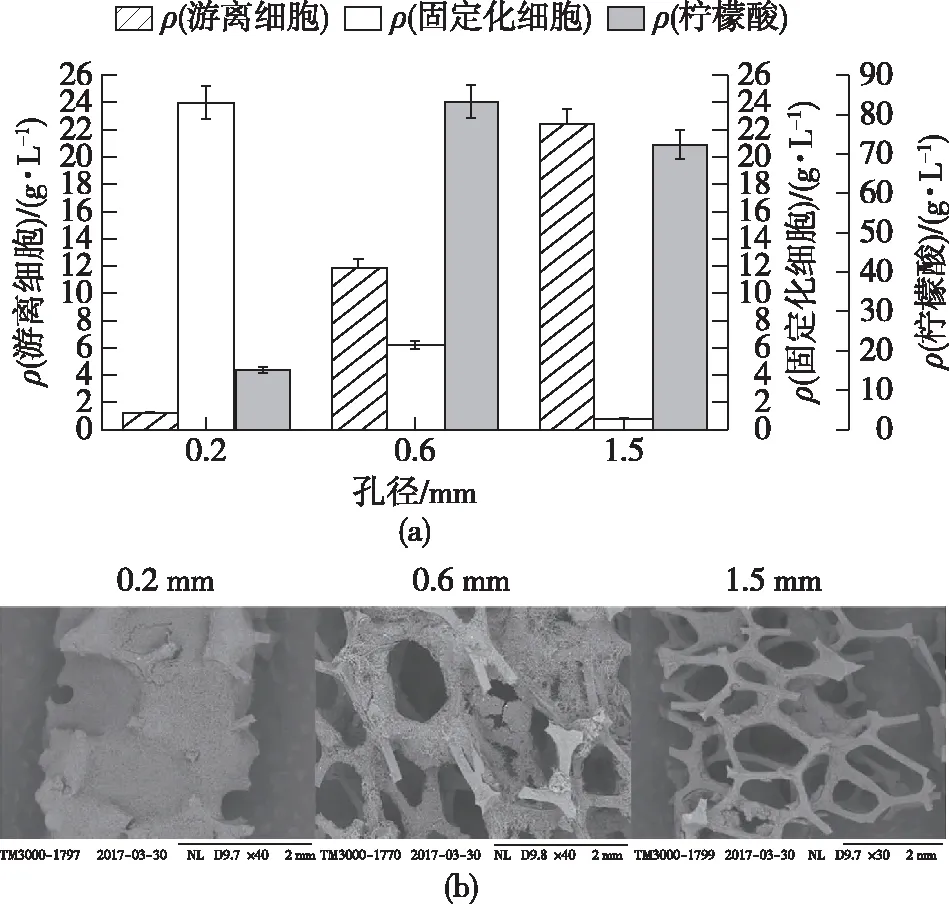
图2 不同载体孔径大小对固定化效果的影响Fig.2 Effects of different carrier pore sizes on immobilization
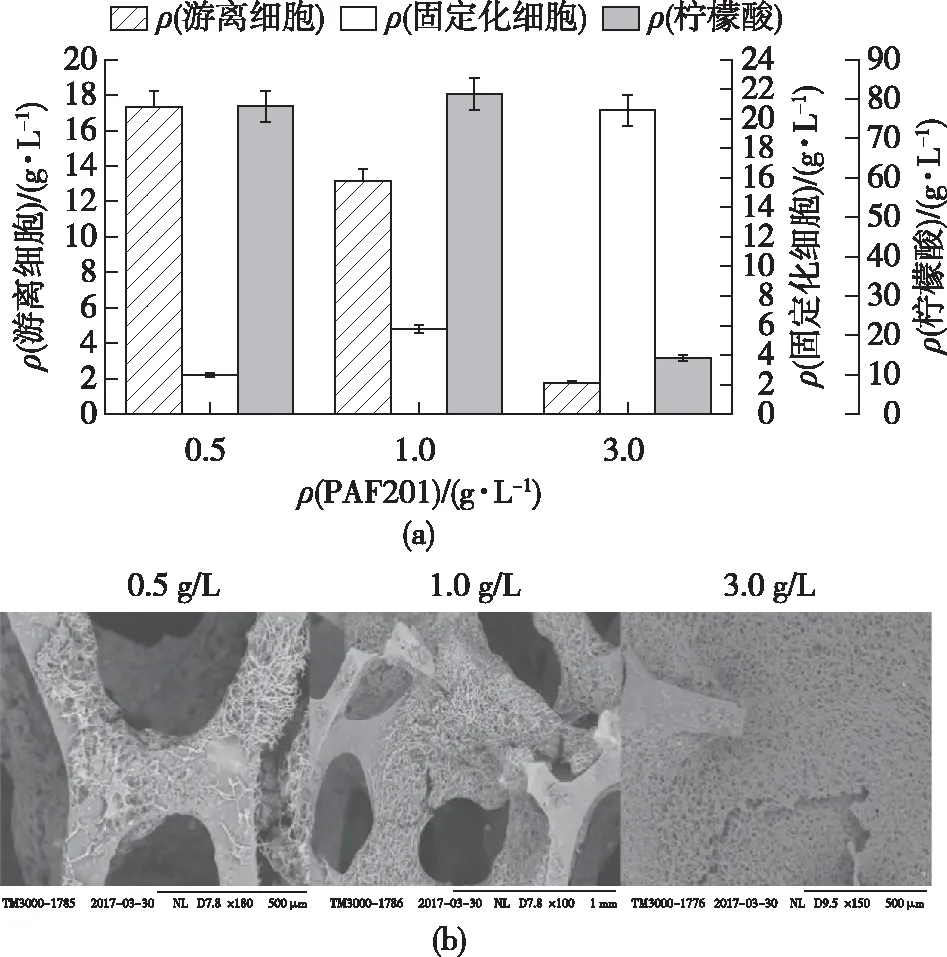
图3 载体添加量对固定化效果的影响Fig.3 Effects of different carrier adding amount on the immobilization
2.2 氮源、磷源以及麸皮水解液对固定化的影响
2.2.1 (NH4)2SO4添加量对固定化发酵的影响
在柠檬酸发酵途径中,NH4+不仅可以激活磷酸果糖激酶,还能解除柠檬酸和ATP对该酶的底物抑制作用,促进黑曲霉快速消耗葡萄糖并用于三羧酸循环(TCA)中积累柠檬酸。同时,NH4+作为一种重要的无机氮源,是黑曲霉生长的必需营养[17]。但是在固定化过程中,发酵前期菌体如果生长过快,就会导致载体孔径的堵塞,因此,合适的氮源添加量对固定化发酵来说是相当重要的。不同(NH4)2SO4浓度对黑曲霉固定化发酵的影响如图4所示。
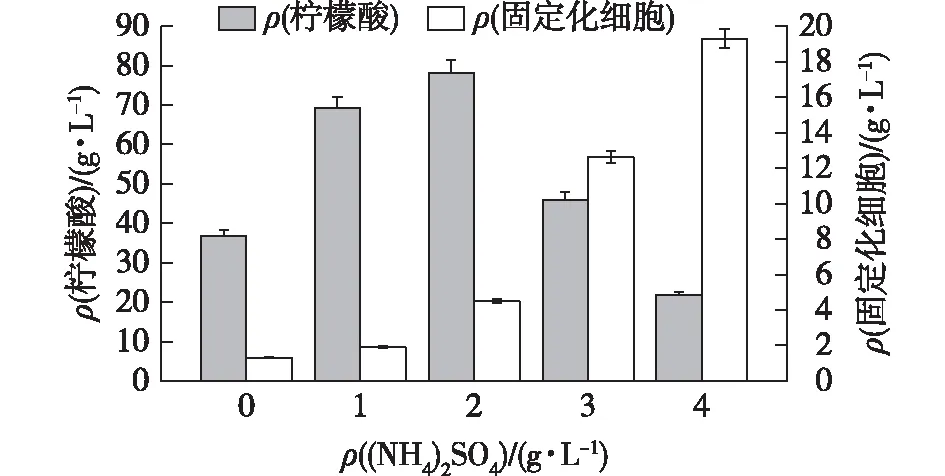
图4 不同(NH4)2SO4浓度对黑曲霉固定化发酵的影响Fig.4 Effects of different (NH4)2SO4 concentrations on immobilization
由图4可知:(NH4)2SO4为0 g/L时,固定化黑曲霉的柠檬酸产量较低,同时载体上固定的菌量也很少。由于(NH4)2SO4是培养基中的唯一氮源,在缺少氮源的情况下,黑曲霉的生长受到抑制,柠檬酸积累较低。当(NH4)2SO4的添加量逐渐增加时,黑曲霉的生长恢复正常,NH4+对糖酵解途径(EMP)起促进作用,加快葡萄糖的消耗,柠檬酸的产量有了显著的提升,载体固定的菌量也逐渐增多。(NH4)2SO4大于3 g/L,柠檬酸产量又明显下降,固定化的菌量突然增多,逐渐将载体包裹堵塞,传氧传质受到阻碍,载体中的菌开始大量死亡。这说明固定化黑曲霉对NH4+更加敏感,过多或过少的氮源都会对固定化发酵产生明显的抑制。同时,添加2 g/L的(NH4)2SO4时,黑曲霉831的固定化发酵效果是最佳最稳定的。
2.2.2 KH2PO4添加量对黑曲霉固定化的影响
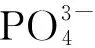

图5 不同KH2PO4浓度对黑曲霉固定化发酵的影响Fig.5 Effects of different KH2PO4 concentrations on immobilization
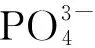

图7 固定化黑曲霉在不同发酵时期的扫描电镜图Fig.7 SEM images of Aspergillus niger cultured at different fermentation stages with PAF201
2.3 麸皮水解液(WBE)对黑曲霉固定化发酵的影响
麸皮在黑曲霉乃至丝状真菌工业发酵中都起到至关重要的作用。但是在PAF201存在的环境下,直接加入固体麸皮会对固定化环境造成不良的影响,因此,笔者研究麸皮水解液是否可以代替固体麸皮,结果如图6所示。由图6可知:在未添加麸皮水解液的发酵条件下,固定化黑曲霉生长缓慢,在96 h的时候只消耗了38 g/L的糖,柠檬酸产量只有10 g/L左右。载体上的黑曲霉虽然不多,但是全部聚集在一起,可能因为在缺少麸皮水解液的情况下,黑曲霉的生长环境不适宜黑曲霉发生群体效应。而在添加了麸皮水解液的培养基中,在96 h的时候残糖只有2.4 g/L,柠檬酸产量达到81.7 g/L。该结果证明了麸皮水解液对固定化黑曲霉的发酵起到促进作用。
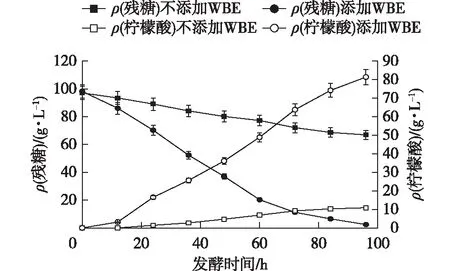
图6 麸皮水解液对固定化黑曲霉发酵的影响Fig.6 Effects of wheat bran extract (WBE) on immobilization
2.4 发酵过程中黑曲霉生物膜的形态变化
通过SEM分析不同发酵时序下的固定化载体,研究对固定化发酵的微尺度机制。图7为固定化发酵过程中不同时间点生物膜的形态。由图7可知:在发酵12 h时,形成了早期生物膜,这时载体表面可以检测到许多萌发孢子,这些孢子开始萌发和分泌黏附物质,导致细胞开始聚集。在发酵24 h时,早期的生物膜开始出现顶端延伸和菌丝分支,在此阶段,黑曲霉开始产生胞外基质,以增强生长的菌落与基质之间的黏附。发酵72 h时,载体表面已经形成了成熟的生物膜,在此阶段,由于细胞的动态平衡,生物膜的厚度基本保持不变。成熟的生物膜可以提供良好的条件,使其在固定化连续发酵中维持一个高效稳定的发酵环境。
2.5 固定化黑曲霉在木薯粉培养基中的连续发酵性能
目前工业上柠檬酸发酵大多使用木薯粉作为原料,因此笔者验证PAF201固定化黑曲霉发酵木薯粉的效果。图8显示了固定化连续发酵8个批次的发酵结果。由图8可知:在第1和第2批次中,发酵周期分别约为96和85 h,比之后的批次略长(72 h)。这是由于黑曲霉在固定化前期需要花费一定的时间在载体上形成生物膜。在第3批次之后,固定化的发酵周期只有72 h,比游离发酵的时间缩短了约24 h。此外,柠檬酸始终保持在160 g/L左右,而且8个批次下来,柠檬酸产量一直保持稳定。
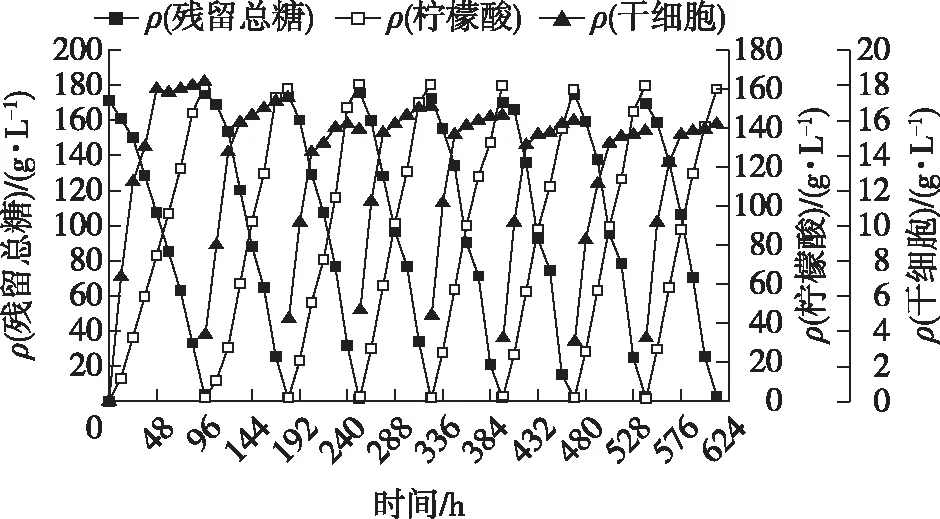
图8 固定化黑曲霉利用木薯粉连续发酵柠檬酸的发酵效果Fig.8 Citric acid production by Aspergillus niger in immobilized repeated fed-batch culture using cassava medium
为了比较固定化和游离发酵的柠檬酸生产强度,笔者同时进行游离细胞的连续发酵,结果如图9所示。由图9可知,随着时间的推移,游离连续发酵的生产强度不断下降。固定化发酵的柠檬酸生产强度(2.26 g/(L·h))几乎是游离发酵的1.6倍(1.41 g/(L·h))。此外,在3~8批次的固定化过程中,柠檬酸的生产强度没有明显的下降。这表明,PAF201固定化系统在黑曲霉发酵中的稳定性较好。在8批次发酵中,柠檬酸产量最高可以达到162.7 g/L,产率达到89.9%。表2显示了使用PAF201作为载体的柠檬酸生产效率与使用其他载体之间的比较。与文献[18-22]结果相比,PAF201固定化系统可以明显提高柠檬酸的产量,并且比其他吸附固定化系统更有效且稳定。
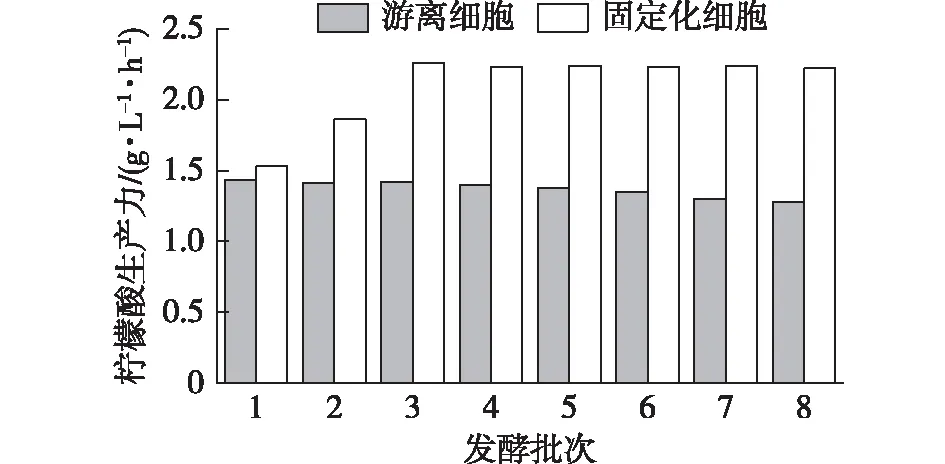
图9 固定化连续发酵与游离连续发酵之间稳定性的差异Fig.9 Comparison of citric acid productivity in repeated fed-batch fermentation with free-cell cultivation and immobilized fermentation
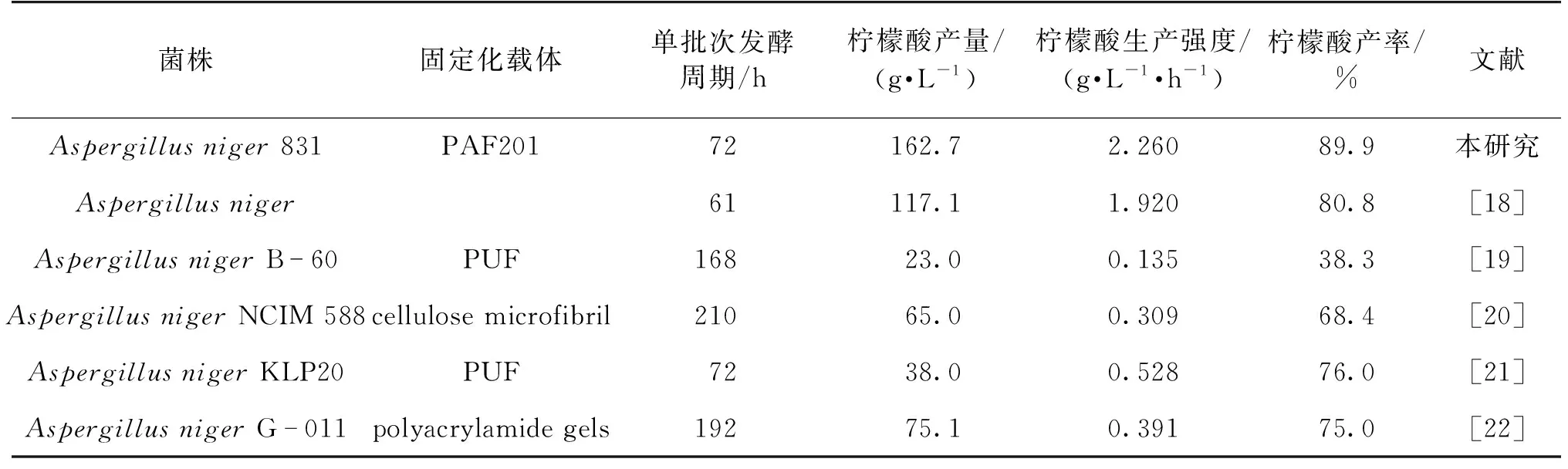
表2 本研究与其他固定化黑曲霉发酵产柠檬酸水平的比较
3 结论
载体优化实验表明,孔径0.6 mm、添加量1.0 g/L的PAF201最适合黑曲霉的固定化发酵,在以葡萄糖为底物的发酵中,发酵周期明显减少,产量最高达到80.5 g/L,产率达到了82.9%,比游离发酵提高了35.4%。
2 g/L的(NH4)2SO4和0.5 g/L的KH2PO4是最适宜的添加量。同时,添加麸皮水解液可以稳定黑曲霉的固定化环境,改善了黑曲霉的固定化效果。
以工业常用的木薯粉培养基为底物,进行8批次总计超过600 h的固定化黑曲霉连续发酵。结果表明,发酵周期比游离发酵缩短了24 h ,柠檬酸产量最高达到了162.7 g/L,生产强度达到了2.26 g/(L·h),是游离发酵的1.6倍。8批次连续发酵中,发酵性能没有明显下降,整个固定化发酵体系稳定高效。
由此可见,利用微生物群体感应的发酵体系具有较强的工业应用价值。
