微生物细胞工厂生产化学品的研究进展
——以几种典型小分子和大分子化学品为例
2022-01-10郑煜堃孙青陈振于慧敏
郑煜堃,孙青,陈振,于慧敏
(清华大学化学工程系,教育部工业生物催化重点实验室,北京 100084)
引 言
随着“绿色发展”理念越来越深入人心,以高效、低耗、清洁、低碳为典型特征的绿色生物制造技术日益受到世界各国政府、研究机构和企业界的高度重视[1]。发展以生物质为基础原材料的生物制造产业链及以工业生物催化为核心的绿色低碳生物经济是推动“绿色发展”、实现“碳中和”目标不可或缺的条件。微生物细胞工厂是绿色生物制造的核心对象之一。采用微生物细胞工厂高效合成各种大宗及高值化学品已经不仅成为学术界的研究热点,也日益成为合成生物学领域产业界的开发重点。而随着生物技术的不断发展,越来越多的化学品可以通过细胞工厂进行绿色高效的清洁生产。
在经典的基因工程、代谢工程和酶工程学科的支撑基础上,近年来,合成生物学、大数据与人工智能等新技术快速发展起来并逐渐交叉融合,使得针对各种微生物细胞工厂进行设计优化的使能技术也越来越丰富且高效。为此,本文首先简述微生物细胞工厂构建及改造过程中的使能技术及其新发展;另一方面则重点阐述微生物细胞工厂合成有机酸、有机醇、有机胺等几类典型小分子产物以及多糖、聚酯等几种典型大分子产物的研究进展;在此基础上,进一步对未来微生物细胞工厂生产化学品的总体发展趋势和前景进行展望。
1 构建高效微生物细胞工厂的主要使能技术及其新发展
微生物细胞工厂合成目标产物的产量、得率等性能直接决定着产品的生物制造成本,设计调配合理路线以高效合成高值化学品是其成功应用的关键。当利用微生物作为目标化学品的生产机器时,常需要在细胞内引入外源途径,并结合复杂的代谢调控,重分配代谢流,使更多的能量及生物量流入所需产品的合成途径。经典的基因工程、代谢工程以及酶工程等学科的发展是微生物细胞工厂构建及改造过程中的重要支撑。其中,启动子工程是调节基因表达强度的核心,代谢流分析指导代谢改造的方向,酶的理性设计和定向进化则是酶分子活性改造的重要手段。如图1所示。
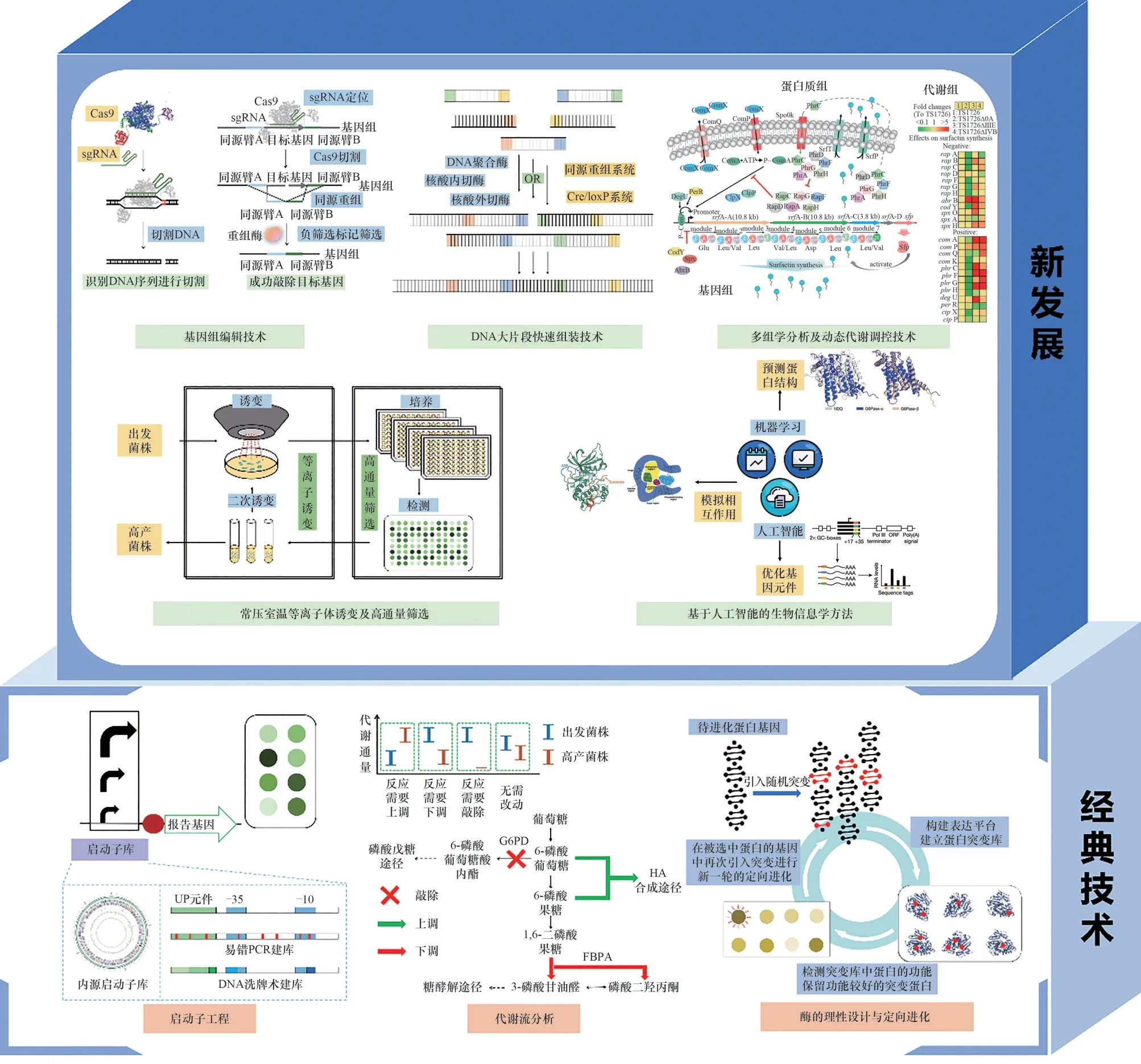
图1 构建高效微生物细胞工厂的使能技术[2-6]Fig.1 Enabling technology for building efficient microbial cell factories[2-6]
近年来,基因组编辑技术对于菌株的代谢途径改造至关重要。成簇规律间隔短回文重复序列及其关联蛋白(clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins,CRISPR/Cas)系 统是近年发展起来的一种重要基因组定向编辑手段,其中的单链向导RNA(single-guide RNA,sgRNA)可以特异性定位目标DNA序列,可用于调控基因表达强度、敲除基因、定点突变等[7]。目前CRISPR/Cas技术已成功应用于大肠杆菌、谷氨酸棒杆菌、酿酒酵母等模式生物[8]以及红球菌[3]、嗜盐单胞菌[9]等多种非模式生物,可用于生产脂肪酸、维生素、氨基酸、聚羟基烷酸酯(PHA)等多种化学品,是最主要的基因组编辑手段之一[10]。如利用CRISPR系统在嗜盐单胞菌Halomonas中进行三羧酸循环改造,设计生产新型PHA[11]。此外,通过CRISPR系统可以进行大规模敲除实现基因组精简,减少细胞代谢负担;或者在不改变基因型的情况下,利用CRISPR系统编辑RNA,实现表现型的改变[12]。
DNA组装技术是构建DNA元件的常用技术,例如利用同源片段进行的Gibson无缝拼接技术,就为多片段基因组合提供了便利[5]。未来,随着DNA大片段、多拷贝快速组装技术的进一步发展,微生物细胞工厂改造的效率将进一步显著提升。
为了模拟自然进化中的变异和选择,通过施加外界环境压力以筛选获得理想的优良性状[13],常压室温等离子体诱变[4]等诱变育种方法耦合微流控高通量筛选技术[14]的使用越来越广泛。新型诱变育种策略在微生物细胞工厂改造中取得了更多成果,尤为适合遗传背景不明确及目标性状复杂的菌株的改进工作,如结冷胶的生产中,通过诱变育种耦合高通量筛选技术,获得了摇瓶产量达41.6 2g/L的高产菌株[15]。已有研究成功结合理性设计与实验室适应性进化构建出可以甲醇为唯一碳源生长的大肠杆菌,为微生物利用有机碳一原料作出了重要突破贡献[16]。
随着下一代测序技术、多组学分析手段的发展,微生物代谢模型覆盖的种类及准确度不断完善。基因组尺度的代谢模型(genome-scale models,GSMs)及模拟算法可用于预测最优途径及潜在的改造目标,可加快高效细胞工厂的构建[17],如利用基因组代谢网络模型指导透明质酸生产优化,将产量提升到28.7g/L[6,18]。在此基础上,多组学分析将基因组、转录组、蛋白组、代谢组、脂质组等多组学数据进行联合分析,能够更加深入理解各因子之间的相互联系和作用,有利于挖掘候选关键因子。
此外,随着环境进行响应的动态代谢调控也是提高细胞生产能力的重要技术。其中反义RNA[19]、小RNA[20]、CRISPR-dCas9[21]等就常被用于同时调控细胞的多个基因表达水平,可有效地微调基因表达活性。如利用小RNA调节大肠杆菌相关基因,使1,4-丁二胺的产量提高到42.3g/L[22]。而基因元件的标准化、模块化将减少基因操作的难度,为底盘构建及改造工作提供重要便利。人工智能和机器学习系统可按照“设计-构建-测试-学习(designbuild-test-learn)”的循环流程,通过从大型实验数据集学习系统的行为模式,以预测复杂的细胞代谢,预测蛋白的结构[23],模拟分子间相互作用,优化启动子等基因元件[24]。
此外,进行大规模的发酵生产时,还需要进行发酵体系放大及生产线建设,对于发酵过程及发酵工艺的优化、反应器设计改造等过程工程策略是实现真正投产时的关注重点。
接下来,本文将从微生物细胞工厂生产典型有机小分子和多糖及聚酯类生物大分子两个方面入手,来分类阐述研究进展并举例具体说明在不同类型产品的生产中,需要关注和优化的主要问题。
2 微生物细胞工厂合成有机醇/酸/胺类小分子大宗化学品
微生物细胞工厂已经被广泛应用于生物小分子的合成,如氨基酸、有机酸、有机醇和有机胺等。本节选取几种典型的小分子有机醇、酸、胺产品为例进行介绍,以期为更多更广泛的有机小分子合成作示例。各种不同重组菌株的改造策略及代表性菌株的生产性能如图2和表1所示。
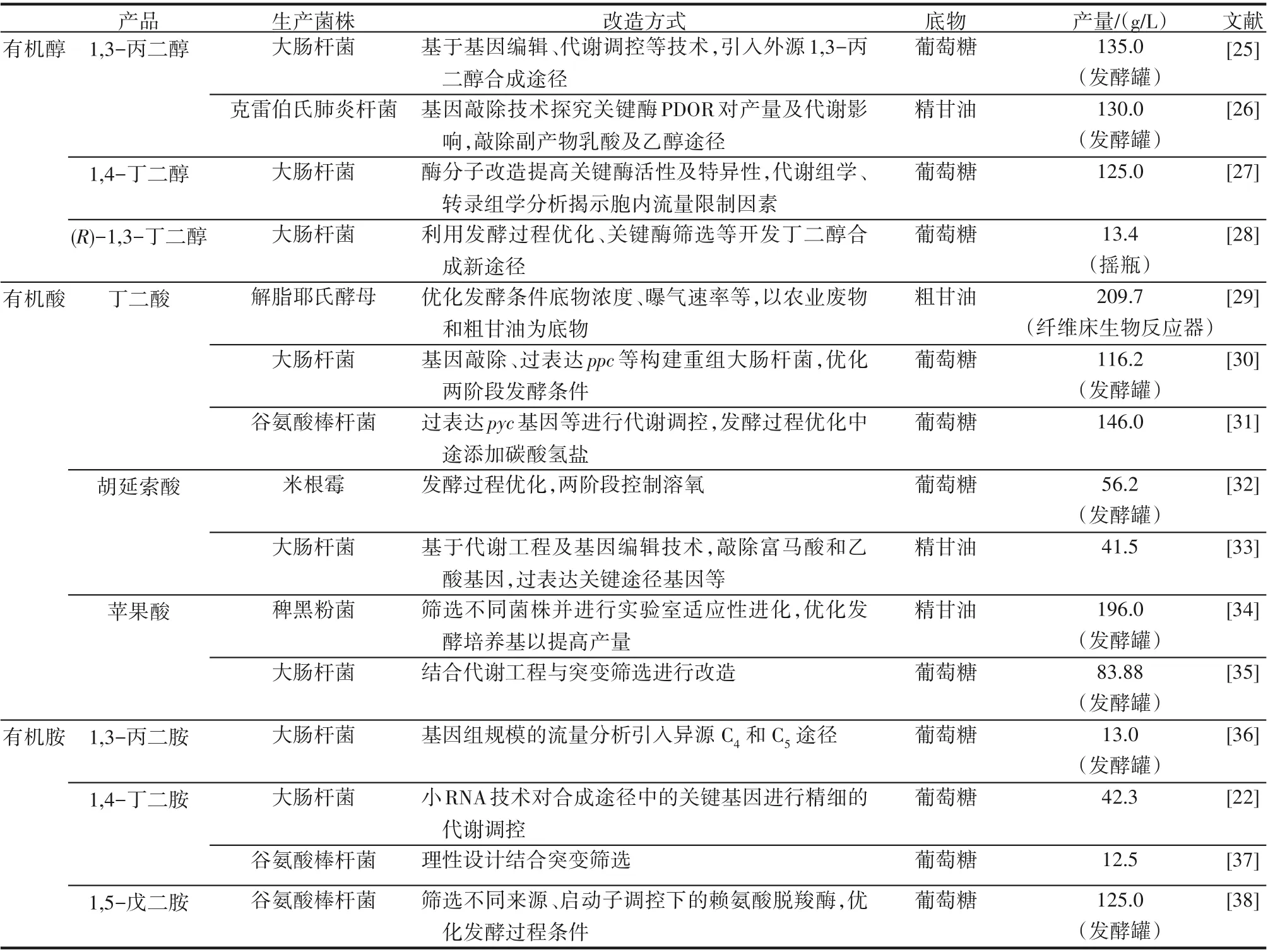
表1 代表性小分子大宗化学品的菌株生产性能比较Table1 Production performance comparison for representative micromolecular bulk products via cell factories

图2 微生物细胞工厂合成重要小分子大宗化学品代谢途径图Fig.2 Metabolic pathways for important micromolecular bulk products via cell factories
2.1 有机醇
有机醇特别是二元醇是一类极为重要的化学品,可广泛用于合成聚酯、聚氨酯、聚醚多元醇等高性能材料,近年来生物法生产1,3-丙二醇(1,3-PDO)、1,4-丁二醇(1,4-BDO)、1,3-丁二醇(1,3-BDO)[39]等取得了重要进展,已经实现了工业化生产。
1,3-丙二醇(1,3-PDO)作为一种重要的C3平台化合物,其最主要的用途是与对苯二甲酸缩聚生成对苯二甲酸丙二醇酯(PTT)。目前1,3-丙二醇的工业生产80%以上是采用生物法,杜邦公司利用重组大肠杆菌,基于DNA组装及基因编辑技术,引入酿酒酵母的甘油合成途径和克雷伯氏菌的1,3-丙二醇合成途径,利用高通量技术筛选脱水酶基因突变文库,并基于代谢网络模型改造底盘细胞的葡萄糖转运模块、能量代谢模块等,使得1,3-丙二醇的产量达135g/L,得率为1.0 9mol/mol[25]。笔者所在课题组开发的甘油法技术路线通过对天然的1,3-丙二醇生产菌株如克雷伯氏菌等进行代谢改造,利用Red重组系统和CRISPR系统敲除副产物乳酸、乙醇、丁二酸积累途径,1,3-丙二醇的产量可超过100g/L,得率超过0.6mol/mol,目前已实现了万吨级工业化生产[26]。笔者所在课题组还以高丝氨酸[40]或3-羟基丙酸[41]为中间代谢物设计了1,3-丙二醇的新合成途径,可以实现一个微生物细胞工厂利用甘油、葡萄糖、蔗糖、木糖等多种原料生产1,3-丙二醇。
1,4-丁二醇(1,4-BDO)是一种重要化工原料,主要用于生产四氢呋喃(THF)、聚对苯二甲酸丁二醇酯(PBT)、聚氨酯(PU)等,在汽车电子、纺织等重要行业有重要用途[27],目前实现生物法投产1,4-BDO。自然界不存在1,4-BDO的直接生物合成途径,Genomatica公司利用基于人工智能的生物信息学技术计算并筛选了超过1000种的1,4-BDO合成路径,最终对两种潜在路径进行了实验验证[39],经过改造的大肠杆菌可以利用葡萄糖生产1,4-BDO,产量可达18g/L[42]。为了进一步提高大肠杆菌底盘菌的还原力和能量再生途径,通过酶分子的理性设计和定向进化提高了关键酶的活性并解除了1,4-BDO的反馈抑制作用,通过基因编辑减少副产物丙酮酸和4-羟基丁酸等积累,使得1,4-BDO产量可提升至125g/L,得率可达0.4g/g葡萄糖,达到理论得率的80%[27]。
1,3-丁二醇(1,3-BDO)常用作化妆品行业的保湿剂和溶剂,作为醇酸树脂的原料与苯酐、顺丁烯二酸酐等单体可制成不饱和聚酯树脂,还可作为青霉烯和碳青霉烯β-内酰胺类抗生素的关键手性中间体。笔者所在课题组结合启动子工程筛选不同来源的辅酶A依赖型乙醛脱氢酶[43],构建了一株可高产(R)-1,3-BDO的大肠杆菌,产量达13.4g/L[28]。
2.2 有机酸
有机酸是另一类重要的化学品。丁二酸作为一种重要的四碳酸平台化合物,是生物可降解塑料聚丁二酸丁二醇酯(PBS)合成的重要单体,且近年来因聚氨酯生产中趋向于采用丁二酸替代己二酸,推动了其市场规模不断发展扩大。琥珀酸放线杆菌[44]可以利用木糖、葡萄糖、玉米浆、农作物秸秆废料等高效生产丁二酸,基于基因编辑、蛋白质改造技术等通过对其进行改造可应用于工业化生产。以大肠杆菌为细胞工厂,通过代谢网络模型预测和基因编辑技术,并结合多轮突变筛选获得了高产丁二酸的高产菌株[45],目前已用于万吨级丁二酸生产线的生产。
苹果酸和延胡索酸作为四碳有机酸与生物法制备丁二酸路径类似。通过代谢组分析,需要敲除大肠杆菌中的三个延胡索酸酶基因并过表达磷酸烯醇丙酮酸羧化酶基因或乙醛酸分流操纵子增加回补途径的通量,所得菌株通过补料分批培养,可利用甘油产生41.5g/L延胡索酸,达到最大理论产量的70%和0.5 1g/(L·h)的总生产率[33]。
2.3 有机胺
有机胺为另一类重要小分子化学品,尤其是二胺类可与二元酸合成聚酰胺,用于尼龙的生产,广泛用于纺织、医疗、工业产品等。1,4-丁二胺是合成尼龙46的重要原料。生物法合成1,4-丁二胺主要集中于在大肠杆菌和谷氨酸棒杆菌中,利用鸟氨酸途径合成1,4-丁二胺[46]。通过小RNA技术对丁二胺合成途径中的关键基因argF、glnA进行精细的动态代谢调控,工程化的大肠杆菌最高1,4-丁二胺产量可达42.3g/L[22]。
1,5-戊二胺主要用于合成生物基尼龙56、尼龙54等,由于对应的尼龙产品具有良好的力学、耐热、耐磨、回弹性能,具有广阔的市场应用前景。目前凯赛生物、宁夏伊品利用全细胞催化法催化赖氨酸脱羧生产戊二胺已实现产业化。近年来,开发谷氨酸棒杆菌以实现利用葡萄糖一步发酵直接生产戊二胺受到广泛关注。通过在谷氨酸棒杆菌中利用基因编辑技术理性设计优化赖氨酸的合成途径[47]、过表达戊二胺的分泌蛋白基因等[48],目前报道的戊二胺最高产量可达125g/L,且纯化后与癸二酸共聚合成生物基聚酰胺PA510,与化学基PA510性能相当,具有重要的应用前景[38]。
3 微生物细胞工厂合成多糖及聚酯类大分子化学品
能够以糖、氨基酸、脂肪酸等为基础聚合合成大分子产物是微生物细胞工厂不可替代的重要功能。这些大分子化学品种类丰富,且功能多样、应用广泛。如胞外多糖、糖胺聚糖、聚酯、聚氨基酸、多肽、酶等,已经被广泛应用于食品加工、医疗药品、生物材料、化妆品乃至石油开采等产业。
与小分子产品不同的是,大分子化学品的微生物合成不仅要在细胞层面考虑代谢工程途径优化、产物转运强化、基因组编辑改造、产物合成动态代谢调控及组学规模代谢网络调控等策略,还经常需要考虑分子量控制问题以及发酵过程中因大分子产物导致的发酵液黏度增大、传质效率低从而难以实现高密度培养及高产率生产等问题,因此,基于发酵过程优化、新装备设计、改造以及基于大数据分析的数字化、模型化自动控制等过程强化新方法等研究也受到高度重视。
下文将以胞外多糖、糖胺聚糖以及聚羟基烷酸酯(PHA)等几种大分子的细胞工厂改造及过程强化策略为典型代表,对微生物细胞工厂合成大分子化学品的研究策略及进展进行阐述。
胞外多糖(exopoly saccharides,EPS)具有复杂的化学结构,其通常由杂聚的高分子量的多糖(10~30kDa)组成,以共价结合或松散结合的方式分布在细胞表面[49]。由原核生物产生的胞外多糖具有良好的水溶性、增稠性、稳定性等独特性质[50],在食品、制药和其他行业中得到了广泛的应用。糖胺聚糖(glycosaminoglycan)也被称为黏多糖,是由己糖醛酸和氨基己糖构成的二糖单元组成的一类线性、可硫酸化、带负电荷的特殊多糖。不同糖胺聚糖的差别体现在二糖单元中己糖的种类、糖苷键的类型和侧链的硫酸化程度[51]。糖胺聚糖广泛存在于自然界中,是动物体内结缔组织和细胞间质中的特有成分,被广泛应用于化妆品、医疗、食品等领域中。胞内聚酯是生物体合成的天然储能物质,如PHA[52]。PHA具有良好的生物可降解性、生物相容性、热加工性能等,有望取代现有的难降解高分子材料[53]。PHA材料广泛应用于薄膜、泡沫、纤维、医用植入物、药物传递载体、组织再生用医疗支架等[54]。
根据微生物合成上述大分子产物的机制不同,需要分别采用天然宿主和异源宿主改造策略,来进行高性能细胞工厂的构建。如图3所示。

图3 细胞工厂合成大分子化学品的研究策略Fig.3 High-yield strategies for production of macromolecular chemicals via cell factories
从底盘菌株出发,胞外多糖中的黄原胶、结冷胶和葡聚糖[49]在自然界中分别由油菜黄单胞菌Xanthomonas campestris[55]、少动鞘氨醇单胞菌Sphingomonas paucimobilis[56]和肠膜明串珠菌Leuconostoc mesenteroides生产。胞外多糖的合成通常需要12~17kb的基因序列,如黄原胶合成基因簇包括11个基因[55],结冷胶的基因簇包含多达18个基因。由于合成基因簇较大,目前还难以实现异源表达,所以黄原胶和结冷胶的生产主要限制在天然生产菌株之中。与此不同,葡聚糖是一种同聚糖,其合成只需要一个糖基转移酶[57],所以它不仅可以由原始菌株生产,还可以由其他的合适宿主,如乳酸菌LactobacillusSpp.、融合魏斯氏菌Weissella confusa等进行异源合成。糖胺聚糖的合成与葡聚糖较为类似,通常由一个合成酶或一个合成酶加若干个转运酶即可合成并分泌到胞外,所以其可以在不同的宿主中进行异源合成。典型的糖胺聚糖包括透明质酸(HA)、硫酸软骨素和肝素等,除HA外,动物组织提取法仍然是其主要生产方法。HA的生产最早是在兽疫链球菌Streptococcus zooepidemicus中进行,经诱变育种和发酵条件优化后,可以达到10g/L以上的产量和2MDa的分子质量,并已经投入工业生产。但兽疫链球菌不属于FDA(美国食品药品监督管理局)所认定的公认安全(generally recognized as safe,GRAS)菌株,可能具有安全隐患。所以采用GRAS菌株进行HA生产的研究受到普遍关注,包括枯草芽孢杆菌Bacillus subtilis、乳酸菌Lactococcus lactis、谷氨酸棒杆菌Corynebacterium glutamicum等。PHA与胞外多糖等产品不同,它是以胞内颗粒的方式存在。PHA合成途径所涉及的基因通常只有几个,所以其天然生产菌株(如产碱杆菌Alcaligenes eutrophus、气单胞菌Aeromonas hydrophila、假单胞菌Pseudomonas putida等)和异源宿主(如大肠杆菌Escherichia coli)都可以发展成为高效的细胞工厂。近年来,可以显著降低发酵成本的嗜盐单胞菌Halomonassp.合成PHA的研究也成为热点之一[58],且其产业化和产品化进程都在加速推进。
总之,不管是天然菌株还是异源宿主所构建的细胞工厂,其性能持续提升一直是产业化的重要需求。一般而言,对菌体自身生长的优化、对副产物相关途径的阻断或弱化、对产物合成以及辅助合成途径的强化以及对核心酶分子的优选与设计改造等,都是普适性的重组改造策略。
此外,由于不同分子量的大分子产物通常具有不同的用途,所以微生物细胞工厂生产大分子化学品的研究需要同时考虑高产和分子量控制两个方面。进一步地,可以分别从细胞层面改造和过程强化两个角度入手,进行微生物合成大分子化学品工艺的全局优化。
如表2所示,通过对PHA合成酶理性设计和改造可以提高酶活,并改变PHA单体分子结构从而生产新产品[59-62]。通过CRISPR编辑技术,在非模式菌种进行细胞代谢改造,将嗜盐单胞菌Halomonassp.中的PHA产量提高到60.4g/L[58]。利用ARTP诱变育种可以使难以进行基因改造的少动鞘氨醇单胞菌Sphingomonas paucimobilis中结冷胶的产量提高到41.6 2g/L[15,63-64]。而基于基因组规模代谢网络模型指导下的全局改造与动态代谢调控,使得谷氨酸棒杆菌Corynebacterium glutamicum中的HA产量提高到28.7g/L[6,18]。

表2 细胞工厂生产大分子产品的代表性改造策略Table2 Representative reconstruction methods for production of macromolecular products via cell factories
由于目前对油菜黄单胞菌等非模式微生物进行基因组编辑比较困难,针对大分子胞外多糖产物的高产菌株改造经常采用常规的诱变育种方法[63]、引入透明颤菌血红蛋白(VHb)提高细胞对氧的获取利用能力等辅助策略[15,64]或者添加代谢抑制剂弱化糖酵解过程[65]等间接手段调控代谢流。
进一步以HA为例简要陈述大分子产物的分子量调控策略。通常,HA产物的分子量由发酵的产量、生产菌株的种类、透明质酸合成酶/透明质酸酶以及发酵工艺过程等因素共同决定。一般来说,当HA产量提高时,HA的平均分子量则会下降。例如,在枯草芽孢杆菌中表达透明质酸酶可以获得19.4g/L的HA产量,分子质量为6600Da[76]。在谷氨酸棒杆菌合成HA过程中,外源添加透明质酸酶,HA产量可提高至74.1g/L,分子质量为53kDa[66]。还可以通过调节生产时的温度,来改变HA分子质量[77]。
除此之外,对大分子产物分子量、产量及生产成本进行有效调控的另一个策略就是进行发酵过程强化。比如,过高浓度的胞外多糖在发酵过程中会出现培养基黏度增大,导致搅拌、溶氧、传递等受阻,普通的发酵罐搅拌桨和发酵方法难以克服高浓度胞外多糖产生的负面影响[78-79]。研究发现,对于发酵罐搅拌桨等设备的改良可以大大提高胞外多糖的产量[71]。固定化细胞反应器、无细胞体系催化生产、微反应器等新设备和新工艺也已经用于黄原胶和葡聚糖的生产研究[74-75,80]。除了设备,发酵培养基和培养条件也很重要。利用响应面分析和神经网络预测改良培养基成分、磷酸盐限制、连续流加发酵、两阶段发酵等策略,都可以提高胞外多糖及PHA等大分子产物的产量[58,72,81-85]。
类似地,PHA发酵中也会存在溶氧和黏度问题,笔者实验室通过在大肠杆菌细胞工厂中表达透明颤菌血红蛋白解决了相关问题[69]。再有,PHA的分离纯化也是PHA生产中的重要环节,经常需要通过细胞离心、破碎、分离提取等多个环节才能得到产品,步骤烦琐,成本也较高。使用CRISPR基因编辑方法调控嗜盐单胞菌的细胞分裂生长基因,使菌体变大变长,发酵结束后自然沉降[68,86];又或笔者实验室在大肠杆菌基因组中引入λ噬菌体裂解基因使菌体自发裂解[69-70],都可以减少分离纯化的成本。
4 未来微生物细胞工厂生产化学品展望
随着目前合成生物学研究的跨越式发展,各种基因操作困难工业微生物的基因组编辑、动态代谢调控、广谱诱变与超高通量筛选、基于人工智能的酶分子模拟等新工具被不断成功开发出来。未来的微生物细胞工厂,还将可以高效生产植物天然产物、抗生素、淀粉等各种目标产品,并实现重要资源的回收利用。如图4所示。

图4 不同微生物细胞工厂合成不同分子量化学品的未来展望Fig.4 Overview of future chemicals production with different molecular mass by different microbial cell factories
其中,微生物细胞工厂合成高活性植物天然产物是目前的研究热点之一。例如,利用重组大肠杆菌细胞工厂合成紫杉二烯[87]、重组酵母细胞工厂生产青蒿酸[88]和人参皂苷[89]等,都已经打通合成路线或即将达到产业化水平。
抗生素是由细菌或真菌生产的一大类医药化学品[90]。近年来,由于微生物抗药性问题越来越严重,具备抗菌功能的多肽、糖脂、脂肽等新分子的微生物合成研究也越来越多[2,91]。最新研究发现,新型脂肽类特纳环霉素能够杀死耐黏菌素的鲍曼不动杆菌[92]。而中科院天津工业生物技术研究所利用二氧化碳生产淀粉更是近期生物制造产业里程碑式的进展[93]。随着技术能力的发展,AlphaFold等人工智能工具帮助人们更快更方便地了解蛋白质结构[23],使得构建生产各种天然产物的细胞工厂的进度大大加快。
为了实现碳中和,利用更加广泛的营养源,包括秸秆处理物等纤维素木质素处理液、厨余垃圾等低劣生物质,进行化学品的生产也将是细胞工厂研究的一个重点[94-97]。而多个细胞工厂协作的多菌系统在生产天然产物如白藜芦醇[98]、类黄酮[99]等的过程中也起到了重要作用[100]。
随着越来越多的新功能元件被挖掘或创造出来,原本无法作为底物的物质也能进行利用。PET(聚对苯二甲酸乙二醇酯)水解酶的发现[101],使得对塑料的生物降解成为可能,塑料生物降解产物的高值化利用也将成为未来细胞工厂的重要应用场景。如利用生产PET水解酶的大肠杆菌对PET进行降解,通过假单胞菌以降解产物为底物生产PHA等生物可降解塑料[102],将实现塑料降解和再合成的统一,助力我国循环经济发展和双碳战略实施。
而对于过程工程优化,随着大数据分析和模拟优化计算能力的日益提高,分子层面的酶设计改造、细胞层面的代谢途径优化和高通量育种以及过程工艺层面的新型生物反应器设计开发、发酵过程优化与自动控制、产物分离提取过程优化等策略将加速交叉融合,实现微生物细胞工厂生产化学品的一体化全局设计与统筹优化[71-72,74-75,80-82]。
可以预见,在不久的将来,更多的大宗和精细化学品生产将通过微生物细胞工厂来实现并创造巨大的价值。微生物法合成化学品这一绿色生物制造新策略将对于我国实现碳减排中长期目标,践行科学发展、可持续发展国策作出重要贡献。
