铁锰铈-海藻酸钠吸附剂的制备及铅吸附去除
2022-01-10张洛红周梦圆程雪荣杨浩然
赵 鑫,张洛红,王 瑜,周梦圆,程雪荣,杨浩然
(1.西安工程大学 环境与化学工程学院,陕西 西安 710048;2.福州大学 物理与信息工程学院,福建 福州 350108 )
0 引 言
铅是环境中毒性最高的重金属污染物之一[1]。目前从水溶液中去除铅离子(Pb2+)的方法,主要有化学沉淀[2]、吸附[3]、生物处理[4]、反渗透[5]和电渗析[6]等方法[7]。其中吸附法因其效率高,成本低且易于再生,被广泛应用于重金属离子的去除。因此,研究用于去除Pb2+的高性能吸附剂具有重要意义[8]。
目前,包括纳米氧化铁[9]、氧化锰[10]和氧化铈[11]的金属氧化物被认为在去除废水中重金属领域具有广阔前景,一种新型的Fe-Mn-Ce三元金属氧化物,对重金属有较高的吸附能力。该吸附剂由无定形的金属氧化物组成,其高比表面积提高了吸附能力。然而,随着金属氧化物颗粒直径的减小和表面能的增加,导致其稳定性差[12],弱的机械强度以及吸附剂的聚集也限制了其广泛应用[13]。因此,Fe-Mn-Ce三元金属氧化物应该固定化以克服这些限制。而海藻酸钠(SA)作为一种生物聚合物,含有大量的—COOH与—OH等活性官能团可与二价及以上的金属离子(钙离子等)在水溶液中通过离子交换反应聚合形成具有三维网状结构的海藻酸盐水凝胶颗粒,形成凝胶后海藻酸钠的热稳定性、抗碱性得到进一步提高,被认为是一种良好的吸附材料[14-16]。
陶虎春等以海藻酸钠水凝胶为骨架,结合壳聚糖和磁性Fe304,开发出一种新型的磁性壳聚糖/海藻酸钠复合凝胶球(MCSB),分析其在水溶液中对Cu2+的吸附作用[17]。张晓蕾等采用共沉淀法制备了具有壳-核结构的磁性吸附剂Fe3O4/MnO2,对其性质进行了系统表征,并对Pb2+的吸附去除能力进行了初步研究[18]。因此,制备出继承金属氧化物和海藻酸钠优良特性的吸附剂具有重要意义。
本文采用共沉淀法[19]和凝胶法[20]合成了一种新型的颗粒状吸附剂(Fe-Mn-Ce-SA凝胶球),其既结合了海藻酸钠和金属氧化物的优良吸附特性,又克服了金属氧化物在吸附过程中容易团聚、不易回收的问题。通过研究pH、离子浓度、温度等因素分析其对水溶液中Pb2+去除的影响,并用Langmuir、Freundlich、准一级动力学和准二级动力学模型对其吸附性能进行评估。
1 实 验
1.1 试剂与仪器
1.1.1 试剂 氯化铁(FeCl3·6H2O,天津市津南区咸水沽工业园区);硫酸亚铁(FeSO4·7H2O,天津市津南区咸水沽工业园区);高锰酸钾(KMnO4,天津市津南区咸水沽工业园区);氢氧化钠(NaOH,天津市津南区咸水沽工业园区);硫酸铈(Ce(SO4)2·4H2O,上海山蒲化工有限公司);硝酸(HNO3,四川西陇科学有限公司);海藻酸钠(SA,国药集团化学试剂有限公司);硝酸铅(Pb(NO3)2,天津市大茂化学试剂厂);氯化钙(CaCl2,天津市申泰化学试剂有限公司);去离子水。
1.1.2 仪器 UV-1800 PC型紫外-可见分光光度计(上海美谱达仪器有限公司);ESJ120-4型电子天平(梅特勒-托利多仪器(上海)有限公司);JJ-4型六联同步电动搅拌器(深圳市中润水工业技术发展有限公司);SHZ-C水域恒温振荡器(上海博讯医疗生物仪器股份有限公司);MD-20X电热鼓风干燥箱(上海-恒科学仪器有限公司);DELTA320型pH计(上海仪电科学仪器股份有限公司);FlexSEM1000型扫描电镜(日本日立公司)。
1.2 Fe-Mn-Ce-SA凝胶球制备与表征、硫酸铈
将高锰酸钾、氢氧化钠溶液逐滴加入氯化铁、硫酸铈和硫酸亚铁溶液中,此操作在快速搅拌条件下进行。滴加操作完成后,持续搅拌至溶液完全混合均匀,再静置陈化数小时使金属氧化物完全反应。使用抽滤机对固体物反复清洗,直至滤液呈中性。抽滤完成后,将抽滤物放入鼓风干燥箱若干小时至完全烘干,研磨过筛制得铁锰铈金属氧化物粉末,备用。
称取一定量的铁锰铈金属氧化物粉末,加入质量分数为3%的海藻酸钠基质中,将混合液搅拌4 h。使用外径1.25 mm、内径0.8 mm针管在氯化钙溶液中进行交联。交联结束后,使用去离子水冲洗,风干48 h后制得所需的Fe-Mn-Ce-SA凝胶球备用。采用SEM观察金属氧化物及Fe-Mn-Ce-SA凝胶球形貌。
1.3 铅吸附实验
所有吸附实验均在250 mL的锥形瓶中进行。在100 mL的含铅溶液体系中,以0.1 mol/L的NaNO3为平衡电解质,投加0.05 g的Fe-Mn-Ce-SA凝胶球,在(25±1) ℃、120 r/min条件下吸附24 h。反应前调节pH为5。吸附完成后用过滤膜过滤样品,然后采用紫外-可见分光光度计测定吸光度,分析吸附后铅溶液浓度变化。
1.3.1 pH对吸附的影响 使用0.1 mol/L氢氧化钠和硝酸调节初始pH在2~6之间,使用100 mL质量浓度为100 mg/L的铅溶液,投加0.05 g Fe-Mn-Ce-SA凝胶球,在(25±1) ℃,120 r/min条件下吸附24 h,吸附平衡后测定Pb2+质量浓度。
1.3.2 离子浓度对吸附的影响 考察pH为2~6及离子浓度对Pb2+吸附影响。使用0.1 moL/L氢氧化钠和硝酸调节初始pH在2~6之间,使用100 mL质量浓度为100 mg/L的铅溶液,投加0.05 g Fe-Mn-Ce-SA凝胶球,调节不同浓度(0,0.1,0.01,0.001 mol/L)的硝酸钠溶液,在(25±1) ℃,120 r/min条件下反应24 h。吸附平衡后测定Pb2+的质量浓度。
1.3.3 温度对吸附的影响 取100 mL铅溶液,pH=5,质量浓度梯度设置为5、10、20、30、40、50、60、70、80、90、100 mg/L。以0.1 mol/L硝酸钠为平衡电解质,投加0.05 g Fe-Mn-Ce-SA凝胶球,在体系反应温度为(25±1)、(35±1)、(45±1) ℃条件下反应24 h。吸附平衡后测定Pb2+质量浓度。
1.3.4 平衡吸附实验 取100 mL铅溶液,pH=5,质量浓度梯度设置为5、10、20、30、40、50、60、70、80、90、100 mg/L。以0.1 mol/L硝酸钠为平衡电解质,投加0.05 g Fe-Mn-Ce-SA凝胶球,分别在(25±1) ℃,120 r/min条件下反应24 h。吸附平衡后测定Pb2+质量浓度。
1.3.5 动力学吸附实验 使用100 mL质量浓度为100 mg/L的铅溶液,称取0.05 g Fe-Mn-Ce-SA凝胶球在两组锥形瓶中,以0.1 mol/L硝酸钠为平衡电解质,调节pH=5。混合均匀后在(25±1) ℃,120 r/min条件下,振荡3、6、10、15、30、60、120、240、480、660、960、1 440 min后,测量Pb2+质量浓度。
2 结果与讨论
2.1 金属氧化物及Fe-Mn-Ce-SA凝胶球表征
铁锰铈金属氧化物、Fe-Mn-Ce-SA凝胶球的扫描电镜和Fe-Mn-Ce-SA凝胶球的外观如图1所示。

(a) Fe-Mn-Ce SEM图
从图1(a)可以看出,铁锰铈三元金属氧化物的表面粗糙不均匀,结构单一,由大小不规则的颗粒物团聚而成。从图1(b)可以看出,得到的Fe-Mn-Ce-SA凝胶球内原本褶皱的表面存在不规则、无定形态的三元金属氧化物,说明三元金属氧化物已成功被海藻酸钠包覆。吸附剂内部较多的褶皱和孔隙为含铅废水与吸附剂内部的铁锰铈金属氧化物接触提供了通道。发达的孔隙结构为金属氧化物提供了丰富的吸附点位,避免了三元金属氧化物的团聚。从图1(c)可以看出,凝胶球为灰褐色圆球形,具有一定弹性且表面光滑。因此,从凝胶球的表面特征验证得到Fe-Mn-Ce-SA凝胶球成功地包覆了铁锰铈三元金属氧化物。
2.2 Fe-Mn-Ce-SA凝胶球对铅的吸附等温线
吸附剂的平衡吸附量Q和去除率R[21]分别由式(1)和(2)计算,即
(1)
(2)
式中:Q为吸附达到平衡的吸附量,mg/g;Ci为初始Pb2+质量浓度,mg/L;Ce为平衡Pb2+质量浓度,mg/L;V为铅溶液的体积,L;m为干燥吸附剂的质量,g。
Fe-Mn-Ce-SA凝胶球对Pb2+的吸附曲线如图2所示。

图 2 Fe-Mn-Ce-SA凝胶球对Pb2+的吸附曲线
由图2可知,Fe-Mn-Ce-SA凝胶球的最大饱和吸附量为180.64 mg/g。随着Pb2+质量浓度的增加,Fe-Mn-Ce-SA凝胶球对其吸附量也逐渐增加直至饱和。Fe-Mn-Ce-SA凝胶球对铅的吸附拟合相关系数R2=0.999 89。这一变化规律表明Fe-Mn-Ce-SA凝胶球与Pb2+具有较强的亲和力。
吸附剂吸附等温分别采用Langmuir和Freundlich模型进行拟合。
2.2.1 Langmuir吸附等温模型
(3)
式中:Qmax为整个吸附反应过程中所能达到的最大的吸附量,mg/g;kl为常数,L/mg。
2.2.2 Freundlich吸附等温模型
(4)
式中:kF为常数。
Fe-Mn-Ce-SA凝胶球对Pb2+的Langmuir、Freundlich吸附等温模型拟合如图3、4所示。

图 3 Fe-Mn-Ce-SA凝胶球对Pb2+的Langmuir吸附等温模型拟合
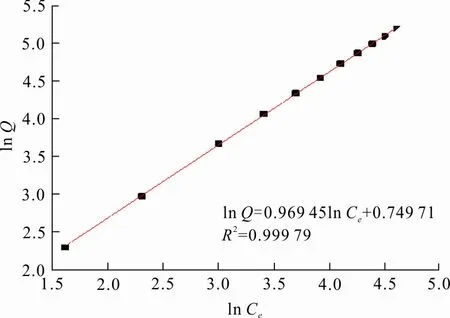
图 4 Fe-Mn-Ce-SA凝胶球对Pb2+的Freundlich吸附等温模型拟合
从图3、4可以看出,Freundlich和Langmuir模型的线性相关系数分别为0.999 79和0.967 3。Langmuir模型假定吸附材料表面的吸附位点分布均匀,只发生单分子层吸附,是理想状态下的物理吸附过程,与实际吸附过程不符;而Freundlich模型通常假定吸附剂表面性质差异大,吸附位点分布不均匀,多发生多分子层吸附,包括化学吸附和物理吸附2个过程。由数值大小可知,Freundlich比Langmuir模型线性相关高,故Fe-Mn-Ce-SA凝胶球对Pb2+的吸附热力学行为更加符合Freundlich吸附等温模型。因此,Fe-Mn-Ce-SA凝胶球对Pb2+的吸附为多分子层吸附,其中既有化学吸附过程,也有物理吸附过程。
2.3 Fe-Mn-Ce-SA凝胶球对铅的吸附动力学
Fe-Mn-Ce-SA凝胶球动力学吸附曲线如图5所示。

图 5 Fe-Mn-Ce-SA凝胶球的吸附动力学曲线
从图5可以看出,Fe-Mn-Ce-SA凝胶球的吸附量随着吸附时长的增加而增大。在0~240 min时,凝胶球的吸附速率较大;在240~660 min时,凝胶球的吸附速率逐渐减慢。当吸附时间达到660 min时,凝胶球对Pb2+的吸附基本已经达到了吸附平衡。这主要是因为在反应开始的前240 min,吸附剂含有充裕的活性点位,此时溶液中的Pb2+与吸附剂中Pb2+的浓度差较大,有利于溶液中的Pb2+扩散至吸附剂,并与之形成络合物,因此在初始阶段吸附速率比较快;随着吸附反应的进行,吸附剂内吸附点位逐渐被Pb2+占据,进入饱和状态,吸附速率也随之降低,直至最终达到吸附平衡状态。实验过程中,Fe-Mn-Ce-SA凝胶球对Pb2+的最大饱和吸附量为182.071 mg/g。
吸附动力学通常会选用准一级动力学模型和准二级动力学模型。
1) 准一级动力学模型:
(5)
Qt=(Q2k1t)(1+Qk1t)
式中:Qt为吸附反应时间为t(min)时的吸附量,mg/g;k1为准一级动力学的相关速率常数,min-1。
2) 准二级动力学模型:
(6)
h=k2Q2
式中:h为吸附反应的初始吸附速率,mg·g-1·min-1;k2为准二级动力学速率常数,g·mg-1·min-1。准一级动力学方程和准二级动力学方程拟合方程及结果如图6、7所示。
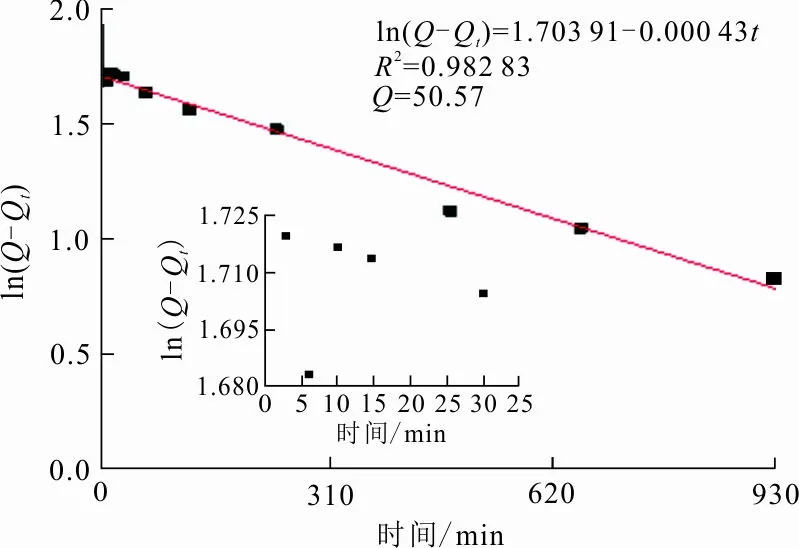
图 6 Fe-Mn-Ce-SA凝胶球准一级吸附动力学模型拟合
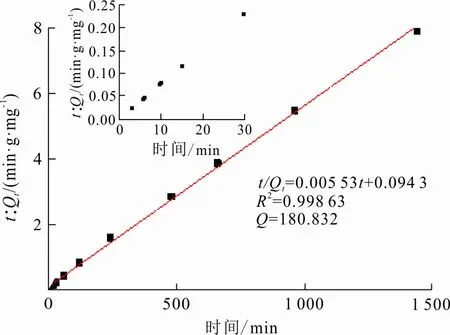
图 7 Fe-Mn-Ce-SA凝胶球准二级吸附动力学模型拟合
从准一级吸附动力学模型线性拟合和准二级吸附动力学模型线性拟合结果可知,吸附剂对铅的吸附量分别为50.57 mg/g和180.832 mg/g。相较于实际测量得到的吸附量值,准二级吸附动力学线性拟合的平衡吸附量值比准一级吸附动力学线性拟合的值更加接近,且准二级吸附动力学模型的相关系数R2=0.998 63较准一级吸附动力学模型的相关系数R2=0.982 83高。故吸附材料对铅的吸附动力学更符合准二级吸附动力学模型。
2.4 pH及离子浓度对吸附能力的影响
在pH<6时,铅的主要形态为Pb2+,此时Pb2+的沉淀可以忽略不计,且在酸性条件下海藻酸钠不会溶解,造成吸附剂破裂。因此,在pH为2~6范围内研究了pH对Pb2+在Fe-Mn-Ce-SA凝胶球上吸附的影响。pH及离子浓度对Fe-Mn-Ce-SA凝胶球去除铅的影响如图8所示。
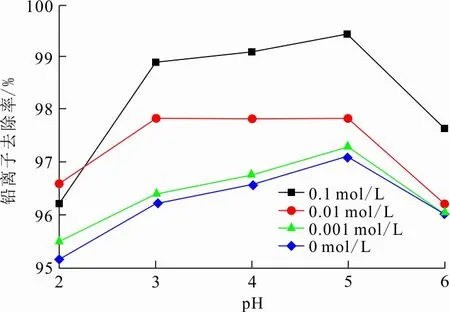
图 8 pH及离子浓度对Pb2+吸附的影响
从图8可以看出,随着pH增大,在不同离子浓度下其对Pb2+的去除率均增加。
在初始pH=2时,由于Pb2+和H3O+存在竞争关系,且Fe-Mn-Ce-SA凝胶球表面呈正电性,凝胶球表面和Pb2+之间有较强的排斥力,凝胶球对Pb2+去除率较低。在pH=3~5时,溶液中H3O+的浓度降低,凝胶球表面正电荷逐渐减小,此时凝胶球对Pb2+的斥力减小,从而对Pb2+的吸附量逐渐增加。在pH=6时,Pb2+的去除率略有降低,主要因为已经吸附的Pb2+占据了吸附剂内部吸附位点,而吸附的Pb2+难以通过水解沉淀暴露新的吸附点位。
当离子浓度由0.001 mol/L增加到0.1 mol/L,Fe-Mn-Ce-SA凝胶球对铅的去除率略有增加。原因可能是复合氧化物与Pb2+之间的化学作用受到离子浓度变化的影响。随着溶液中离子浓度的增加,凝胶球与吸附质之间存在配位共价键为主的共价键,形成内层表面络合物,有利于溶液中其他离子的移动和相互作用,起到一定的催化作用。
2.5 温度对吸附能力的影响
温度对铅吸附的影响如图9所示。

图 9 温度对Pb2+吸附的影响
从图9可以看出,在25 ℃条件下,Fe-Mn-Ce-SA凝胶球对Pb2+的吸附量与35及45 ℃的吸附量有着相似的变化特征,随着平衡质量浓度的增加,吸附量也逐渐增大。但45 ℃下的吸附量低于35 ℃下的吸附量,35 ℃下的吸附量低于25 ℃下的吸附量,特别是当初始Pb2+质量浓度逐步增大时,差异也逐步明显。在相同pH值条件下,25 ℃下的最大吸附量均大于35、45℃条件下的数值,表明温度的升高降低了Fe-Mn-Ce-SA凝胶球与Pb2+结合牢固程度和强度,由此可见升高温度对于吸附反应的进行是不利的,说明吸附反应可能为放热反应。在实验过程中,随着温度的升高,在45 ℃条件下有部分Fe-Mn-Ce-SA凝胶球出现细小裂缝,可能是由于高温破坏了海藻酸钠稳定的三维结构。
3 结 语
针对高毒性污染物Pb2+,采用凝胶法将共沉淀制备的铁锰铈金属氧化物成功包覆在海藻酸钠中,制得Fe-Mn-Ce-SA凝胶球,作为去除Pb2+的新型吸附剂。在初始Pb2+质量浓度为100 mg/L,温度为298.15 K时,所得的最佳pH为5,吸附剂用量为0.5 g/L,平衡时最大吸附容量为182.071 mg/g。凝胶球的吸附过程可以与准二级动力学模型和Freundlich吸附等温模型极好的符合。结果表明,Fe-Mn-Ce-SA凝胶球从废水中去除重金属离子(Pb2+)潜力巨大。
