小麦 TaWRKY51基因的克隆及其参与SQ-1诱导小麦花粉败育过程的表达模式研究
2022-01-08吴国丽魏霁桐段江丽盛呈泽宋齐鲁郭佳林张亚敏王军卫马守才张改生宋瑜龙
吴国丽,魏霁桐,段江丽,盛呈泽,宋齐鲁,郭佳林,张亚敏,牛 娜,王军卫,马守才,张改生,宋瑜龙
(西北农林科技大学农学院/国家杨凌农业生物技术育种中心/国家小麦改良中心杨凌分中心/小麦育种教育部工程研究中心/陕西省作物杂种优势研究与利用重点实验室,陕西杨凌 712100)
随着经济社会的快速发展和人口数量的持续增加,人们对小麦产量和品质的需求进一步加大,因此,在有限耕地面积不变的基础上创新育种材料,挖掘小麦单产潜力,实现小麦单产的大幅度提升,对保障国家口粮安全显得尤为重要[1]。利用杂种优势可提高作物单产,在玉米、水稻、油菜等作物中均已大面积应用,且已经取得了显著效果。“化杀二系法”可诱导小麦产生雄性不育系,实现杂种优势利用,因其具有操作简便、亲本选配范围广、强优势杂交组合出现几率高等优点,被认为是实现小麦杂种优势利用的最有效途径之一[2-4]。
WRKY转录因子是一类广泛存在于植物体内的转录因子,主要参与响应生物与非生物胁迫、激素信号传导、叶片衰老以及雄性生殖器官发育等过程[5-8]。Lei等[9]以拟南芥花粉粒为材料,发现花粉特异性表达基因WRKY2、WRKY34和VQ20共同调控参与花粉发育、萌发以及花粉管伸长过程,三者同时突变会引发花粉粒败育。Mukhtar等[10]发现,过表达WRKY27会造成拟南芥花药不能正常开裂,且花粉粒活性显著降低。张 娟[11]发现,过表达OsWRKY51后,水稻株高极显著降低,分蘖角度增大,花粉育性降低,单株结实数变少,且种子在开花期开裂。此外,关于小麦TaWRKY51功能的研究也有相关报道。Hu等[12]发现,过表达TaWRKY51可造成乙烯合成关键基因ACS的表达量降低,内源乙烯含量下降,侧根数量减少。栗 颖[13]发现,TaWRKY51在低温、氯化钠、ABA等诱导后表达量均显著上调,且具有较高的转录激活活性,可以与典型的W-box结合,行使转录因子功能。
SQ-1是由中国自主研发的具有高效、稳定、广谱等优点的一类小麦化学杂交剂,其诱导小麦产生雄性不育率可达95%以上,并对雌蕊无不良影响[14-15],但其生产成本较高,是限制SQ-1大面积应用的主要瓶颈。近年来,为了解析SQ-1诱导小麦花粉败育的机理,服务于新型廉价、高效、安全、广谱型小麦化学杂交剂的开发,本课题组围绕SQ-1诱导小麦花粉败育开展了系统研究。本研究拟利用从SQ-1诱导的小麦生理型雄性不育系PHYMS(physiological male sterility)-1376及其对照CK-1376花药差异表达基因中筛选到的WRKY转录因子基因片段,通过与小麦基因组数据库比对,克隆获得了TaWRKY51,并对其生物信息学、亚细胞定位,及其在PHYMS-1376花药中的表达模式进行研究,初步解析TaWRKY51与SQ-1诱导小麦花粉败育的关系,以期揭示SQ-1诱导的小麦生理型雄性不育机理,为开发新型化学杂交剂提供一定的理论依据。
1 材料与方法
1.1 试验材料
供试小麦品种西农1376与化学杂交剂SQ-1均由西北农林科技大学张改生教授实验室提供。2018年10月,将该品种种植于西北农林科技大学农作一站,翌年3月,当材料发育至Feek’s 8.5时期,将其分为两组,一组用5 kg·hm-2的化学杀雄剂SQ-1处理(PHYMS-1376),另一组用等量清水处理(CK-1376)。待花粉粒发育至四分体时期、单核早期、单核晚期、二核期和三核期时,分别在冰上采集PHYMS-1376的花药,置于EP管中,液氮速冻,-80 ℃保存,备用。
1.2 试验方法
1.2.1 总RNA的提取和cDNA的合成
利用Trizol提取PHYMS-1376和CK-1376各时期花药总RNA,并用DNase I进行纯化处理,随后参照HiScript ll 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒说明书(Vazyme,南京),将纯化后的花药总RNA反转录合成cDNA,置于-20 ℃冰箱保存,用于WRKY51扩增及后续研究。
1.2.2TaWRKY51基因的克隆
利用以PHYMS-1376和CK-1376花药筛选到的差异表达基因TraesCS1D02G362900.1序列,与小麦基因组数据库比对,获得TaWRKY51cDNA全序列,使用Oligo 7软件设计特异性引物TaWRKY51-F/R(表1)扩增开放阅读框,以cDNA为模板,使用2×TransStart FastPfu PCR SuperMix扩增TaWRKY51,PCR扩增体系:2×TransStart FastPfu PCR SuperMix 25 μL,上下游引物(10 μmol·L-1)各2.5 μL,模板cDNA(100 ng· μL-1)5 μL,ddH2O 15 μL。PCR扩增程序:95 ℃ 1 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 1 min,40个循环;72 ℃ 5 min。扩增产物用1%琼脂糖凝胶电泳检测,随后用SanPrep柱式DNA胶回收试剂盒(生工,上海)回收,连接至pEASY-Blunt Cloning Vector载体(TransGen,北京),然后转化大肠杆菌感受态细胞DH5α ,挑阳性克隆,37 ℃培养16 h,送上海生工测序,并在NCBI数据库对该基因结构进行预测。

表1 本研究所用引物
1.2.3TaWRKY51的生物信息学分析
利用ExPASy-ProtParam软件(http://web.expasy.org/protparam/)预测TaWRKY51蛋白的理化性质,用NPS-SOPM在线软件(http://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测TaWRKY51蛋白的二级结构,用SWISS-MODEL在线软件(http://swissmodel.expasy.org/)预测TaWRKY51蛋白的三级结构。利用Protscale在线软件(http://web.expasy.org/protscale)分析TaWRKY51蛋白的亲/疏水性,并通过Cell-Ploc 2.0(http:www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2)中的Plant-mPLoc进行TaWRKY51蛋白的亚细胞定位;通过Ensembl Plants在线网站(http://plants.ensembl.org)查找与TaWRKY51蛋白同源度较高的序列,利用MEGA 7.0软件构建蛋白系统进化树,并利用DNAMAN软件对TaWRKY51蛋白与其同源蛋白序列进行保守结构域比对分析。用PlantCARE在线软件(http://bioinformatics.psb.ugent.be/webtods/plantcare/html)对TaWRKY51启动子区的顺式作用元件进行预测。
1.2.4 TaWRKY51蛋白的亚细胞定位与转录活性分析
以CK-1376各时期混合花药cDNA为模板,利用TaWRKY51-F1/R1引物扩增TaWRKY51开放阅读框,用1%琼脂糖凝胶电泳检测后,回收目标条带(PCR扩增体系和程序以及扩增产物的检测和回收方法同1.2.2),并将其重组到35S-EGFP(酶切位点为BstBⅠ)表达载体上。随后,将35S-EGFP-TaWRKY51表达载体转入DH5α感受态细胞并测序验证,将测序正确的阳性菌株扩大培养,提取35S-EGFP-TaWRKY51质粒,利用冻融法将其转至农杆菌GV3101感受态细胞,挑选阳性克隆,并扩大培养,之后采用注射法将重悬农杆菌注射入4~6叶期健壮的本氏烟叶片中,培养48 h后取注射孔附近的叶片表皮置于载玻片上,在激光共聚焦荧光显微镜(Olympus,日本)下观察荧光信号,并拍照。
以CK-1376各时期混合花药cDNA为模板,利用TaWRKY51-F2/R2引物扩增TaWRKY51开放阅读框,用1%琼脂糖凝胶电泳检测,条带回收后将其重组转入酵母双杂表达载体pGBKT7(酶切位点为EcoRⅠ和BamHⅠ)。随后,将pGBKT7-TaWRKY51重组载体转入DH5α感受态细胞中并测序,将测序正确的阳性菌株扩大培养,提取pGBKT7-TaWRKY51质粒,将其转入酵母Y2H感受态细胞,并扩大培养,之后将其涂布于SD/-Trp培养基上,挑阳性克隆扩大培养,并将3种不同稀释度(100、10-1和 10-2)的酵母菌液接种于SD/-Trp/-Ade/-His培养基上观察生长情况。PCR反应体系与程序同1.2.2。
1.2.5 小麦TaWRKY51基因的表达模式分析
设计TaWRKY51荧光定量引物TaWRKY51-F3/R3,以小麦Actin作为内参基因,以SQ-1诱导的生理型雄性不育系PHYMS-1376及其对照可育系CK-1376四分体、单核早期、单核晚期、二核期、三核期花药cDNA为模板,参照2×RealStar Green Fast Mixture(康润诚业,北京)试剂盒说明书配制反应体系,置于QuantStudio 3实时荧光定量PCR仪(ABI,美国)上进行反应;qRT-PCR反应程序: 95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s,40个循环,溶解曲线分析采用系统默认值。运用2-△△Ct法计算基因相对表达量,所获数据用SPSS 21.0软件采用LSD法进行差异显著性分析。
2 结果与分析
2.1 小麦 TaWRKY51的克隆结果与结构分析
以CK-1376花药cDNA为模板,参照PHYMS-1376和CK-1376花药差异表达基因TraesCS1D02G362900.1序列,设计TaWRKY51-F/R引物,扩增获得单一条带(图1),胶回收后,将其连接到克隆载体,转化大肠杆菌,挑阳性单克隆测序,得到663 bp的序列,与TraesCS1D02G362900.1序列开放阅读框一致,可编码220个氨基酸。序列导入NCBI数据库进行比对,发现其与TaWRKY51同源性为97%,属于TaWRKY51同源基因。对TaWRKY51基因进行结构分析,发现该基因5′-UTR区长度为264 bp,3′-UTR区长度为433 bp。
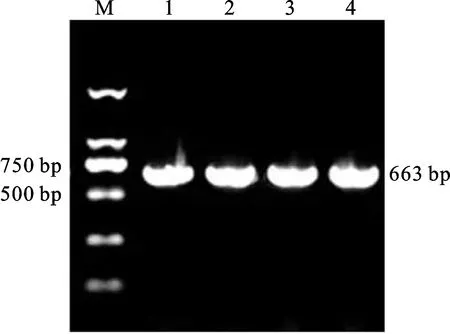
M:DL2000;1~4: TaWRKY51的PCR产物。
2.2 生物信息学分析
利用ExPASy-ProtParam分析TaWRKY51蛋白质理化性质,发现其分子量为23.34 kD,等电点为6.42,序列中有20个氨基酸(Arg+Lys)带正电荷,有21个氨基酸(Asp+Glu)带负电荷,不稳定系数为52.69,属于不稳定蛋白,脂溶性指数为57.82。二级结构分析发现,TaWRKY51蛋白中含有28.18%的α-螺旋,10.42%的β-转角,16.82%的延伸链,以及44.55%的无规卷曲(图2a)。利用SWISS-MODEL分析TaWRKY51蛋白的三级结构,发现其C端具有与拟南芥AtWRKY1蛋白相同的晶体结构,且序列一致性高达56.76%(图2b)。利用Protscale在线软件对TaWRKY51蛋白质的氨基酸序列亲/疏水性进行分析,发现得分为负值的氨基酸数量大于得分为正值的氨基酸数量,且最大值为1.956,最小值为-3.067,表明TaWRKY51蛋白属于亲水性蛋白(图2c)。Plant-mPLoc在线预测TaWRKY51蛋白亚细胞定位结果显示,该蛋白位于细胞核内。
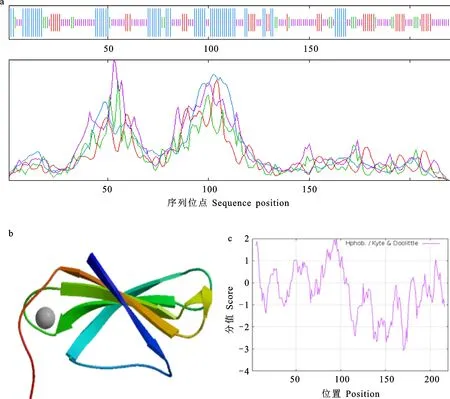
a:TaWRKY51蛋白的二级结构,蓝色代表α-螺旋,绿色代表β-转角,红色代表延伸链,紫色代表无规则卷曲;b:TaWRKY51蛋白的三级结构;c:TaWRKY51蛋白的亲/疏水性。
利用NCBI Blast数据库进行同源比对,筛选与TaWRKY51亲缘关系较近的基因序列,利用MEGA 7.0绘制进化树,结果发现,小麦TaWRKY51蛋白与节节麦(XP020192531.1)亲缘关系最近(图3)。利用DNAMAN进行多序列比对发现,小麦TaWRKY51的同源基因较多,第一同源群染色体与第二同源群染色体同源基因编码的蛋白质序列存在明显差异,但其均具有WRKY结构域和锌指结构,且高度保守,属于第二类WRKY家族(图4)。
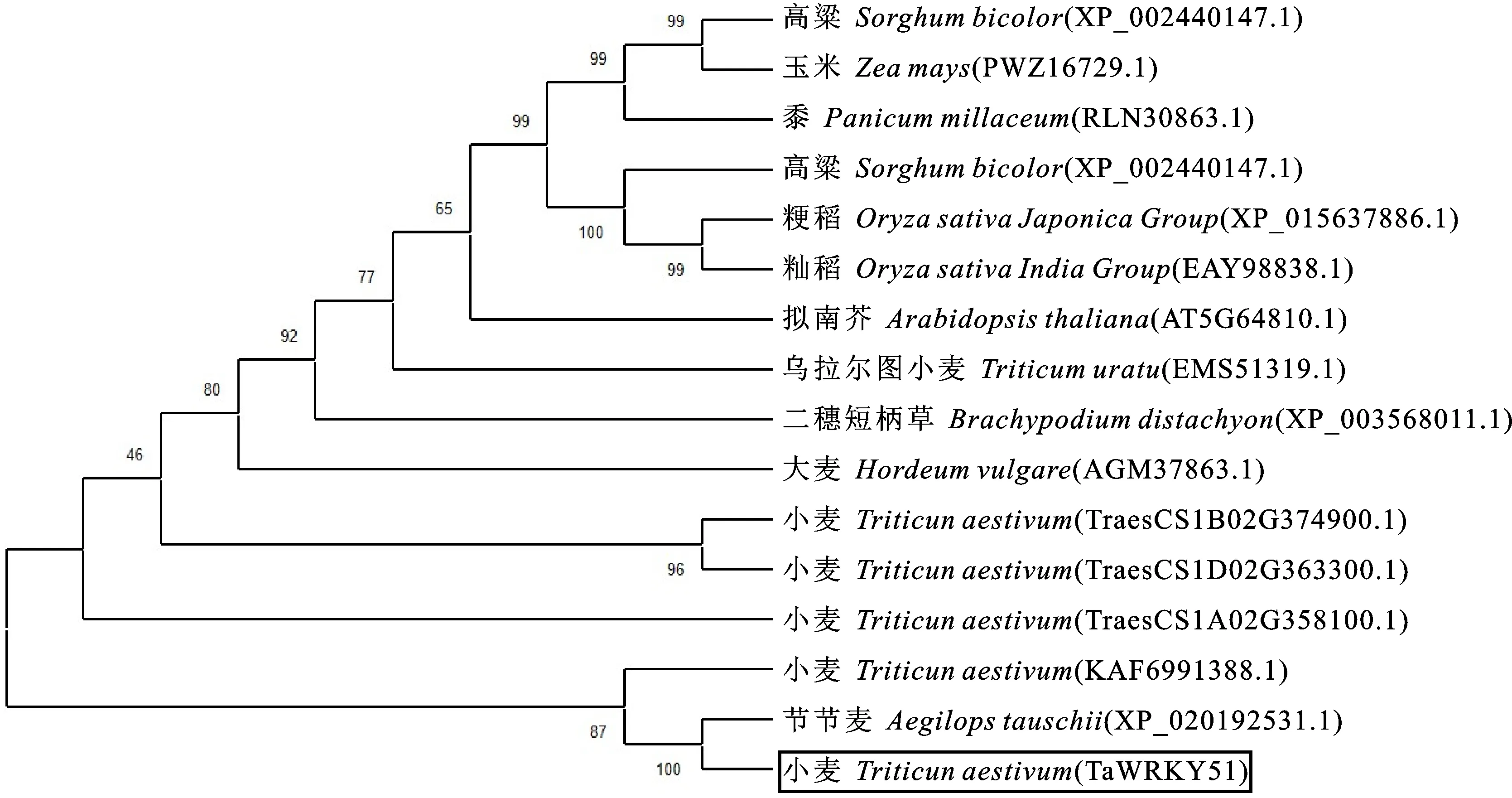
图3 TaWRKY51蛋白的进化树分析
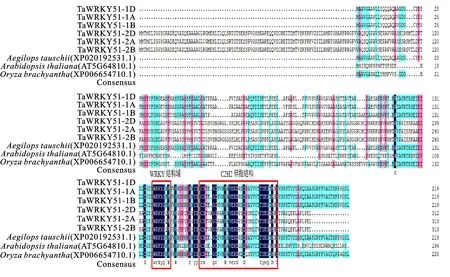
图4 TaWRKY51蛋白的同源序列比对
为了进一步解析TaWRKY51的转录调控机制,利用PlantCARE在线软件,对TaWRKY51启动子区域顺式作用元件进行分析,结果发现,TaWRKY51启动子区含有与光响应、茉莉酸甲酯响应、脱落酸响应等相关的7类顺式作用元件(表2),表明TaWRKY51可能受光、内源激素及其他非生物胁迫调控。

表2 TaWRKY51基因上游调控区顺式作用元件
2.3 TaWRKY51蛋白的亚细胞定位与转录激活活性分析
对TaWRKY51蛋白进行亚细胞定位,结果(图5)发现,35S-EGFP-TaWRKY51融合蛋白仅能在细胞核内检测到绿色荧光信号,而35S-EGFP融合蛋白在细胞质和细胞核中均能检测到,表明TaWRKY51定位于细胞核,属于核表达基因,该结果与Plant-mPLoc在线软件预测结果一致。为了进一步明确TaWRKY51是否具有自激活效应,将TaWRKY51连接到pGBKT7载体,并将pGBKT7-TaWRKY51和pGBKT7载体分别转入酵母Y2H感受态细胞。随后,将带有pGBKT7和pGBKT7-TaWRKY51载体的酵母菌株涂布在SD/-Trp和SD/-Trp/-Ade/-His培养基上,置于30 ℃条件下培养,结果(图6)发现,转入pGBKT7载体的酵母菌落只能在SD/-Trp培养基上生长,而转入pGBKT7-TaWRKY51载体的酵母菌落既可以在SD/-Trp培养基上生长,也能在SD/-Trp/-Ade/-His培养基上生长,表明TaWRKY51转录因子具有自激活活性。
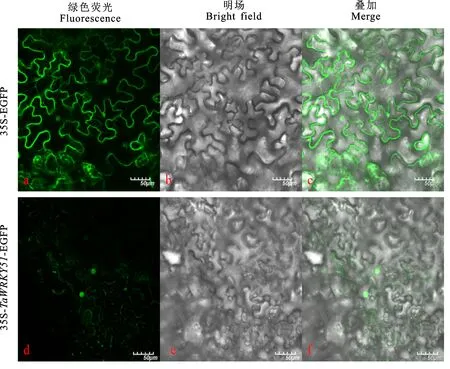
图5 TaWRKY51蛋白的亚细胞定位
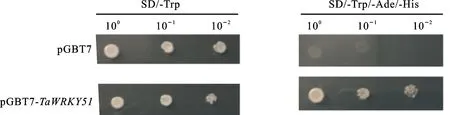
100、10-1和10-2为3种不同稀释度的酵母菌液。
2.4 TaWRKY51基因的表达分析
利用qRT-PCR技术对雄性不育系PHYMS-1376及其对照可育系CK-1376花药四分体、单核早期、单核晚期、二核期、三核期花药中TaWRKY51的表达模式进行研究,结果(表3)发现,CK-1376在花药四分体时期至单核晚期,TaWRKY51表达量呈持续降低,二核期至三核期表达量明显提高。与CK-1376相比, PHYMS-1376中TaWRKY51的表达量在花药四分体时期、单核晚期、二核期和三核期均极显著高于 对照。

表3 TaWRKY51在CK-1376和PHYMS-1376不同时期花药中的表达量
3 讨 论
本研究以化学杂交剂SQ-1诱导的小麦雄性不育系及其对照可育系为材料,筛选到一个显著差异表达基因TaWRKY51,其编码蛋白具有高度保守的WRKY结构域。WRKYGQK是WRKY家族转录因子的标志序列,主要位于蛋白的N端,且C端有Cys(2)-His(2)型或Cys(2)-HisCys型锌指结构[16]。有研究表明,N端具有WRKYGQK结构域且C端具有锌指结构的WRKY转录因子,才可以正常行使生物学转录功能,其中C端锌指结构可引导WRKY转录因子与目标基因特异性结合,因此,仅存在WRKY结构域而无锌指结构的WRKY转录因子不能发挥其生物学调控作用[17-19]。然而,WRKYGQK结构域中氨基酸序列并非完全保守,其中W、Q和K会出现不同频次的变异,尤其是Q位点变异频率最高[20]。Dong等[21]和Qiu等[22]研究发现,拟南芥和水稻WRKY家族WRKYGQK结构域中的Q会变异为K或E,且不同序列的转录活性存在一定程度差异。上述研究结果在本研究中也得到了证实,序列比对发现,TaWRKY51的N端含有WRKY保守结构域,C端含有C2H2锌指结构,且WRKYGQK序列中的Q变异为K。Eulgen等[16]研究表明,WRKY转录因子专一识别(T)(T)TGAC(C/T)序列,其中核心序列为TGAC,属于W-box结构,具有此类结构域的基因主要参与植物防御反应、衰老、生殖发育及其他非生物胁迫(干旱、高盐等)的应答反应。本研究对TaWRKY51基因启动子顺式作用元件分析,发现TaWRKY51基因启动子区含有与光响应、激素应答(茉莉酸、脱落酸响应)、胁迫应答(干旱和厌氧响应)等相关的7类顺式作用元件,表明TaWRKY51参与植物生长发育,可以响应多种逆境应答。这与前人研究结果一致。
Zhang等[23]对陆地棉不育系及其保持系进行了差异基因表达分析,鉴定到4个WRKY 转录因子,且都在不育系花药中上调表达;Hu等[24]利用基因芯片技术对3个籼稻不育系D62A(D型)、ZS97A(WA型)和XQZ-A(DA型)的花药转录谱进行分析,发现2个WRKY家族基因WRKY76和WRKY104,并且都在不育系中上调表达;李 莎[25]对K型小麦雄性不育系 KTM3315A及其近等基因系KTM3315R二核期的花药进行了转录组测序,鉴定到WRKY2、WRKY51等14个差异表达的WRKY转录因子基因,其中WRKY51等13个基因在不育系花药中上调表达。上述研究结果在本研究中也进一步得到了证实。本研究结果发现,在CK-1376花药四分体时期至单核晚期,TaWRKY51的表达量呈持续降低,二核期至三核期表达量明显提高。与CK-1376相比, PHYMS-1376花药中TaWRKY51的表达量在花药四分体时期、单核晚期、二核期、三核期均极显著高于对照,表明TaWRKY51与雄性花粉败育密切相关。此外,亚细胞定位结果表明,TaWRKY51位于细胞核内,这与小麦中的TaWRKY2和TaWRKY19定位结果一致[26]。转录激活活性研究结果表明,TaWRKY51具有转录自激活活性,这一研究结果与粟 颖[13]研究结果一致。
综上所述,TaWRKY51具有WRKY基因家族特征,定位于细胞核内,具有转录自激活活性,且与SQ-1诱导小麦花粉败育密切相关,但其具体生物学功能与花粉败育之间的关系还有待进一步深入研究。
