硫化锂正极材料及研究进展
2022-01-07苏冠睿张春飞艾旺圣袁金良
苏冠睿, 张春飞, 艾旺圣, 袁金良
(宁波大学 海运学院,浙江宁波 315211)
锂硫电池因具有超高的能量密度、优异的环境友好性、低廉的硫材料成本而成为下一代最具潜力的动力电池之一。锂硫电池的应用前景广阔,其商业化能较好地解决目前电动汽车续航里程短的问题。另外,在风能、太阳能、潮汐能等可再生能源的存储中将发挥巨大的作用。然而,锂硫电池也因存在很多难以克服的问题而限制其商业化应用,主要存在活性物质导电性差,多硫化物(Li2Sn)的穿梭效应及氧化还原反应速率缓慢等问题。这些问题严重影响锂硫电池的比能量、库仑效率和循环稳定性,阻碍锂硫电池的商业化应用。锂硫电池正极材料主要有硫单质和硫化锂(Li2S)两种形式,大量研究表明,Li2S 比硫具有更突出的优势。因此,Li2S 复合正极材料的研究逐渐成为一个研究热点,与其复合的宿主材料主要有碳基材料、聚合物、无机金属化合物等,通过充分利用宿主材料的物理吸附和电化学催化功能,从而达到有效改善锂硫电池性能的目的。
1 锂硫电池正极材料及存在的主要问题
1.1 锂硫电池正极材料
锂硫电池属于锂金属电池中的一种,其中正极材料可细分为硫基和Li2S 基两类。电池涉及的反应机理相同,仅充放电顺序不同。以硫为正极材料情况下,放电时负极的锂失去电子变为锂离子,正极的硫与锂离子化合生成Li2Sn,并最终生成Li2S。在充电过程中,锂硫电池的正负极反应逆向进行,具体反应如(1)所示。若正极为Li2S,则反应过程如(2)所示。
(1) 正极为单质S
电极反应过程[1]:

(2) 正极为Li2S
电极反应过程:

研究表明,具体的放电过程更为复杂。硫在反应中被逐步锂化(S8→Li2S8→Li2S6→Li2S4),形成一系列Li2Sn,可溶的长链Li2Sn再逐步形成短链的不可溶硫化物(Li2S4→Li2S2→Li2S),进而以固体形式重新沉淀到电极上。由此可见,随着反应的进行,电极反应经历了固-液-固的转变,是一个多相反应体系。因此,与传统的锂离子电池有很大不同之处。
1.2 锂硫电池硫正极存在的主要问题
(1)导电性差:正极活性物质单质硫导电性较差,其中硫单质的电导率只有5×10-30S/cm[2]。
(2)穿梭效应:放电中间产物Li2Sn易溶解在有机电解液中,导致活性物质硫的减少。在正极溶解的长链Li2Sn穿过隔膜到负极与金属锂反应,被还原成短链的Li2Sn;而充电时,负极的Li2Sn又会穿过隔膜回到正极,被氧化成长链的Li2Sn。这个过程就是锂硫电池的“穿梭效应”。“穿梭效应”可导致锂硫电池中活性物质损失,金属锂负极被腐蚀,造成库仑效率低和循环寿命短等问题[3]。由于存在“穿梭效应”,Li2Sn最终被还原成Li2S,并沉积在负极锂的表面上形成钝化层。这不仅导致活性物质的损失还增加了电池的阻抗,阻碍了负极锂与电解液的良好接触,从而抑制负极与电解液之间的锂离子交换,减缓了电极的反应动力学[4]。
(3)体积膨胀:因为硫的密度为1.96 g/cm3,Li2S 的密度为1.66 g/cm3,两者存在较大的密度差,导致单质硫在锂化过程中产生约80% 的体积膨胀[5]。体积增大会使部分活性物质与集流体失去良好接触,破坏电极结构,切断电子传输,造成电池容量下降。
(4)电极动力学过程缓慢:硫存在电子绝缘性等多因素引起的氧化还原反应速率缓慢的问题,特别是液态Li2S4向固态Li2S 的转化迟滞以及Li2S 较高的活化能垒,严重制约着电池的倍率性能[6]。
1.3 硫化锂正极材料的主要问题及优势
Li2S 是锂硫电池硫正极放电的终产物,可以看作是硫的预锂化。因此,二者存在共性问题。硫存在电子绝缘性,Li2S也是电子绝缘材料,导电率很低(电导率约10-13S/cm)[7],在其氧化过程中,也同样存在Li2Sn的“穿梭效应”和氧化还原反应动力学缓慢等问题。区别之处是,Li2S 对水较敏感,在空气中易吸收水蒸气发生水解,放出剧毒硫化氢气体。因此,Li2S 的制备条件也相对苛刻,主要采用球磨法[8]、溶剂法[9]、直接碳复合法[10]等。另外,Li2S 作为正极材料,其初始氧化时还需要克服一个很大的活化能垒(过电压)[11]。不过,Li2S 也有很多优势,其理论比容量高达1 166 mAh/g[12],还能避开硫的首次锂化过程导致的体积膨胀问题。此外,它能和非锂金属阳极(碳、硅等)配对组成锂离子电池,避开了一直悬而未决的金属锂枝晶问题。因此,Li2S 是非常有潜力的正极材料。
2 Li2S正极材料的研究进展
2.1 碳基/Li2S 复合材料
2.1.1 单质碳/Li2S 复合材料
单质碳材料的种类很多,主要有热解碳、石墨、碳纳米管、石墨烯等。碳材料具有良好的导电性,能有效地提高电极材料的导电率,从而提高电池的比容量。
热解碳或低结晶度碳材料比较容易制得,通过简单的高温热解即可形成碳/Li2S 复合材料,最具有代表性的方法是化学气相沉积法(CVD)。Yang 等[13]通过CVD 技术在Li2S 颗粒上成功沉积均匀的导电碳层,获得了核-壳结构的纳米复合材料(nano-Li2S@C)。所制备的纳米Li2S 颗粒的平均尺寸约为100 nm,碳壳厚度约为20 nm。Li2S@C 颗粒可以缩短锂离子的扩散距离,且外壳碳层可以加速电子传输,并能够有效限制可溶性多硫化物的迁移。在0.2C时初始放电比容量达到1 083.5 mAh/g,200 次循环后比容量为766.3 mAh/g,循环衰减率为0.15%。另外,高温热解含碳聚合物前驱体也是较常用的方法。Liang 等[14]采用聚苯乙烯为前驱体,通过高温热解合成出具有高Li2S 含量的多孔碳涂层复合材料Li2S@C。该复合材料在0.1 A/g 的电流密度下循环200 次,单次容量衰减率为0.18%,表现出优异的循环稳定性。
碳纳米管和石墨烯具有出色的物理化学性质,因而也常被用作锂硫电池正极的负载材料。Chen 等[15]通过喷雾干燥法和热处理制得Li2S 与碳纳米管(CNT)的复合材料(Li2S@CCNT)[见图1(a)]。3D CNTs 骨架网络可抑制Li2Sn的扩散,同时提供良好的电子传输路径,使得Li2S@C-CNT 复合材料具有良好的倍率性能和循环稳定性,如图1(b)、(c)所示。Li 等[16]采用热解法将石墨烯纳米片聚集体(GNA)和硫酸锂(Li2SO4)的混合物制备成Li2S-GNA 复合材料。实验结果表明,Li2SGNA 样品的初始放电比容量为693 mAh/g,第40 次放电比容量为508 mAh/g,库仑效率约为95%。 贾顺新等[17]制备的Li2S/石墨烯复合材料具有丰富的微孔蜂窝状结构,可显著提高复合电极材料的电导率并能通过物理截留作用限制Li2Sn的扩散,从而获得较高的库仑效率和良好的循环性能。表1为不同碳基/Li2S 复合材料的循环性能。

图1 (a)Li2S@C-CNT的合成过程示意图;(b) 电流密度为0.2 C时,负载量为3 mg/cm2的Li2S@C-CNT阴极的长期循环稳定性;(c) 在0.1 C电流密度下,负载量为5 mg/cm2的Li2S@C-CNT阴极的循环性能[15]

表1 不同碳基/Li2S 复合材料的循环性能
2.1.2 杂原子掺杂的碳基/Li2S 复合材料
采用杂原子掺杂的方法,可增强非极性碳材料与极性Li2Sn之间的相互作用力并显著提升碳基材料的导电性,因此是改善Li2S 电极性能的有效手段。目前,碳材料的杂原子掺杂主要有氮原子掺杂、磷原子掺杂、硼原子掺杂、过渡金属原子掺杂等形式。其中,氮掺杂的研究已获得较大进展[18]。Hu等[19]在二甲基甲酰胺(DMF)溶液中蒸发聚丙烯腈(PAN)和Li2S 的混合物,成功合成了Li2S@NRC 复合材料。在0.5C的高倍率下,电池的初始比容量为958 mAh/g,超过1 000 个循环后,每个循环的容量衰减率仅为0.041%。研究发现,磷/氮共掺杂比单一氮原子掺杂效果更佳,Zhang 等[20]合成了一种来自植酸掺杂聚苯胺的氮磷共掺杂碳(N,P-C)骨架,制备无粘结剂的Li2S 阴极。掺有N 原子和P 原子的3D 多孔碳结构可以实现更好的电子传输和Li+迁移。P 原子掺杂的碳骨架增强了与硫的相互作用,从而有助于抑制多硫化物的溶解与扩散,提高了库仑效率。此外,P 原子掺杂碳材料改善了反应动力学,通过催化电极反应降低了电极极化,并在提升离子电导率方面起着至关重要的作用。在0.1C的100 个循环中,电池库仑效率为99.4%,放电比容量为700 mAh/g。硼掺杂的研究相对较少,Zhou 等[21]用液体渗透-蒸发涂覆的方法分别制备出了氮、硼掺杂的石墨烯气凝胶负载Li2S 的复合电极材料,制备方法如图2(a)所示。杂原子N 或B 掺杂有利于电荷快速转移,并能改善非极性石墨烯骨架和极性Li2Sn之间的亲和力,使石墨烯电极具有稳定的循环性能。从图2(b)可知,在0.5C倍率下,相比未掺杂的还原石墨烯,二者的比容量均有较大幅度提升,放电比容量分别为657 和597 mAh/g,300 次循环后平均容量衰减率分别为0.129% 和0.134%。由此可见,N 原子掺杂要优于B 原子参杂。表2 为不同元素掺杂的碳基/Li2S 复合材料的循环性能。

图2 (a) Li2S的涂覆过程以及石墨烯基电极的原位充放电示意图;(b) 在0.5 C倍率下,商用Li2S-rGO、Li2S/rGO、Li2S/B-doped G 和Li2S/N-doped G等电极的300次循环充放电性能和库仑效率[21]

表2 不同元素掺杂的碳基/Li2S 复合材料的循环性能
2.2 聚合物基/Li2S 复合材料
聚合物用于锂硫电池的研究相对较少。Cui 等[22]通过在Li2S 颗粒上进行吡咯的原位聚合,合成了Li2S-聚吡咯(PPy)复合材料。PPy 中的N 原子带有孤对电子,它与Li2S 具有较强的Li-N 相互作用,可使PPy 牢固地覆盖在Li2S 的表面,从而抑制Li2Sn在电解质中的溶解。另外,导电的PPy 也有助于电子传导。另一类是非导电聚合物,目前很少用于锂硫电池系统中。 Hao 等[23]选用一种具有离子选择性的磺化聚醚醚酮(SPEEK)膜,与独立式SWCNT/rGO 结构构成界面层[如图3(a)]。因为SPEEK 膜带有负电的离子纳米通道,可以成为阻拦Li2Sn扩散的屏障和促进Li+离子快速传输的通道。从图3(b)和(c)可知,相对未添加聚合物的参比组而言,SPEEK 聚合物明显改善了电池的循环性能。
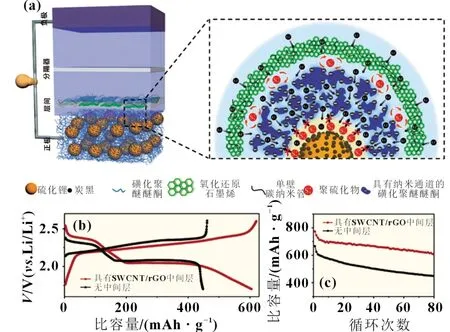
图3 (a)含有SPEEK 的阴极与SWCNT/rGO中间层构成的界面示意图;(b)有/无SWCNT/rGO 中间层条件下,Li2S阴极的电池电压-比容量曲线对比图;(c)有/无SWCNT/rGO 中间层条件下,电池的循环性能对比图[23]
2.3 无机金属化合物基/Li2S 复合材料
无机金属化合物也是一类极有潜力的Li2S 宿主材料,该类化合物的极性表面与极性的Li2Sn之间有较强的相互作用(路易斯酸-碱相互作用),具有表面吸附和催化的双重效果,因而引起了研究人员的高度重视。研究表明,利用金属与Li2Sn之间的路易斯酸碱相互作用能有效地抑制Li2Sn的“穿梭效应”[24]。目前研究较多的主要有金属碳(氮)化物(MXene)、金属氧化物、金属硫化物、金属磷化物等。
2.3.1 MXene 基/Li2S 复合材料
MXene 因具有类似石墨烯的典型二维(2D)结构而受到广泛的关注[25]。作为MXene 的代表化合物,过渡金属碳化物和氮化物具有高导电性、独特的三明治层状结构等,已被广泛应用于电极材料。
王等[26]合成了Li2S@MXene/G 阴极材料。多层片状的Ti3C2材料比表面积大、表面活性位点多,不但可以增加活性物质Li2S 的负载量,还能充分起到吸附催化的效果。结果表明,Li2S@MXene/G 阴极中Li2S 的含量高达9 mg/cm2,比容量为5.04 mAh/cm2,表现出良好的循环稳定性。Liang 等[27]通过高能球磨法制备了多层的Ti3C2/Li2S 复合材料(ML-Ti3C2/Li2S),在0.2C条件下,100 次循环充放电后,能保持450 mAh/g 的电池比容量(初始电池比容量约为700 mAh/g)。 Pourali 等[28]将Ti3C2Tx分散在Li2S-EtOH 溶液中,制备了Li2S/Ti3C2Tx复合材料。电极初始比容量为708 mAh/g,100 次循环后容量保持率为74.5%(528 mAh/g)。
2.3.2 金属氧化物/Li2S 复合材料
金属氧化物可作为锂硫电池中硫的宿主材料,该类研究主要通过构建不同的形貌结构(包括一维的纳米线、纳米棒,二维的纳米片,以及三维的纳米球等),从而合成出具有较大比表面积和分层结构的金属化合物材料。近年来,金属氧化物负载Li2S 的研究逐渐成为一个热点。Chen 等[29]通过热处理和原子层沉积技术制备出氧化石墨烯海绵负载氧化铝和Li2S (Al2O3-Li2S-GS)的分层结构材料。Li2S 表面沉积的纳米Al2O3不仅对Li2Sn的扩散有物理限制作用,还可以通过锂-氧键合作用抑制长链Li2Sn的溶解,从而确保较高的比容量。Al2O3-Li2S-GS 具有736 mAh/g的初始比容量,300次循环后容量保持率为88%(0.5C),1 000 次循环充放电后容量衰减率为0.028%(2C)。Yuan 等[30]证明Li2S 与TiO2(110)晶面之间的键能强度(≥2.18 eV)明显大于其与石墨烯之间的键能强度(<1.0 eV),所以金属氧化物TiO2可更好地与Li2S 结合,提高Li2S 的利用率。Wu 等[31]通过蒸发含有钛基的Li2S-乙醇溶液,然后进行热处理,制备Li2S@LiTiO2复合材料,如图4(a)所示。因为层状的LiTiO2壳不仅具有离子和电子传导性,而且能与Li2S形成非常强的化学键。最重要的是,LiTiO2可以将长链Li2Sn快速转化为短链Li2Sn,表现出较高的倍率性能和循环稳定性[图4(b)]。

图4 (a) Li2S、Li2S-LiTiO2和Li2S@LiTiO2复合纳米颗粒的工艺流程示意图;(b) Li2S@LiTiO2阴极在C/2和1 C下的长期循环稳定性[31]
2.3.3 金属硫化物/Li2S 复合材料
金属硫化物广泛存在于自然界中,有很强的亲硫性,可用作锂硫电池硫正极的宿主材料。Seh 等[32]用二维层状过渡金属TiS2作为锂硫电池阴极的宿主材料,合成了纳米Li2S@TiS2核-壳高导电性复合材料[图5(a)]。TiS2中存在极性的Ti-S 键,Ti 原子可以通过Ti-S 键合作用与Li2S 以及Li2Sn产生化学吸附作用,因此Li2S 与TiS2的结合能远高于其与碳基石墨烯之间的结合能。如图5(b)和(c),Li2S@TiS2材料表现出良好的倍率性能。Chung 等[33]设计了一种Li2S-二硫化钛-电解质(Li2STiS2-E)复合阴极。这种复合结构同时提高了Li2S 的活化效率、电荷存储容量和循环寿命。TiS2是一种可吸附Li2Sn的电化学活性材料,能有效阻止Li2Sn溶解在电解液中。另外,TiS2的高电导率可增强电池正极Li2S 的氧化还原反应速率,将Li2S-TiS2-E 阴极的活化能势垒从3.5 V 降到3.0 V,高效活化了Li2S,促进了电极反应。因此,Li2S-TiS2-E 复合材料具有较高的质量比容量(704 mAh/g)和面积比容量(4.23 mAh/cm2)。

图5 (a) Li2S@TiS2核壳纳米结构合成过程的示意图;(b)0.2 C到4 C多倍率循环充放电测试,Li2S@TiS2阴极的比容量;(c)充放电压分布图[32]
2.3.4 金属氮化物/Li2S 复合材料
相对金属氧化物和金属硫化物而言,金属氮化物具有更高的电子导电性,因此是十分有应用潜力的宿主材料之一。Zhou 等[5]采用石墨烯包覆具有TiN-TiO2异质结构的纳米复合物作为Li2S 的宿主材料。碳的非极性表面对极性多硫化锂(LiPS)的亲和性较差,但石墨可通过物理阻隔作用抑制LiPS的扩散。TiO2和TiN 对LiPS 均有很强的吸附性,此外,TiN 还具有电催化功能,可促进LiPS 向Li2S 转化,在电极界面上完成LiPS 的捕捉-扩散-转化等过程,很好地抑制了“穿梭效应”,实现活性物质的高效利用和反应的快速进行。在0.3C倍率下,7TiN:3TiO2-G 涂层可提供927 mAh/g 的比容量,每个周期的容量衰减仅为0.027%。但是,由于氮化物的合成条件比较严苛、成本高、结构难以控制,其应用受到了较大的限制。
3 结论与展望
综上所述,碳基材料、聚合物、金属化合物等作为负载Li2S 的宿主材料均能不同程度地改善电池的性能。杂原子掺杂的碳基材料和无机金属化合物是性能表现较为突出的两类宿主材料,但二者也各有优缺点。其中,碳基材料制备工艺相对简单,而且兼有廉价和环保的特点,因此应用潜力巨大。但是,掺杂的碳材料也存在极性较弱,振实密度低,表面活性位点数量无法有效控制的弊端。金属化合物表面的极性活性位点与Li2Sn的相互作用,可以有效改善Li2S 正极的性能。另外,通过采用多种纳米合成技术,构建分层的、高比表面积的金属化合物材料,可以进一步提高Li2S 的负载率。相对多孔碳宿主材料而言,纳米金属化合物对Li2Sn的吸附能力更强且有较高的振实密度来维持电池结构的稳定性。但是,大多数金属化合物导电性较差,密度大,脆性高,特别是Li2S 的电极负载率远远低于实际应用需求,其在锂硫电池中的应用受到了很大的限制。
就未来的发展趋势而言,Li2S 复合正极材料仍将是锂硫电池研究的热点方向之一。如何有效抑制多硫化物在电解液中的溶解和提升电极反应动力学仍是要攻克的重点问题。具体来讲,宿主材料的选择要考虑如下特点:高比表面积,以实现硫的高负载量;高电导率,以增强电极反应动力学;材料结构有利于锂离子传输和硫的体积膨胀;材料表面对Li2Sn的氧化还原反应有高效催化作用等。在充分考虑以上特性的同时,尽可能提高Li2S 在复合材料中的含量,从而获得具有长循环寿命和高能量密度的Li2S 基复合材料。如果锂金属问题也能得到很好解决,锂硫电池必将在未来的新能源领域占据重要的一席之地。
