两种不同燃料下SOFC的三维多物理场数值模拟
2022-01-07陈宇瑶魏明锐
陈宇瑶, 魏明锐
(武汉理工大学汽车工程学院,湖北武汉 430070)
SOFC 的高温工作环境(600~1 000 ℃)非常有利于碳氢化合物在电池内部进行直接重整[1],这给予SOFC 极大的燃料选择性。
氢气作为SOFC 的传统燃料,国内外学者对其进行了大量的实验研究和数值模拟。汤水等[2]和帅浚超等[3]都以氢气为燃料对SOFC 进行了三维数值模拟仿真,发现电池性能主要受氧气质量分数控制,单电池长度过小会限制氧气消耗。Zhang 等[4]研究发现SOFC 采用交叉流动可以获得比逆流和顺流更大的输出功率。Hussain 等[5]对平板SOFC 进行数值模拟来研究电化学性能,发现电压为0.1~0.5 V 时,最大功率密度为4 kW/m2,造成性能损失的主要因素为阴极活化极化、阳极浓度极化和欧姆极化。
但是,氢气的制取和存储的成本过高,制约了SOFC 的应用。甲烷作为天然气的主要成分,在SOFC 的研究中越来越受到关注。Barzi 等[6]和Wang 等[7]建立了二维数值模型来预测阳极支撑型SOFC 的性能。 孙成斌等[8]、Miyake 等[9]和Mauro 等[10]建立了以甲烷为燃料的SOFC 三维CFD 模型,分析了不同操作参数下的输出性能,发现温度和甲烷浓度都对性能有重要影响。谢静等[11]比较了天然气内重整和外重整下SOFC 的性能,认为内重整SOFC 的功率密度和燃料利用率更高。
本文分别建立了以氢气和甲烷混合气为燃料的阳极支撑型平板SOFC 的数值模型。其中甲烷直接在电池内部进行重整,重整反应的产物H2和CO 都被作为电化学反应物。比较两者内部物理参数分布规律以及性能差异,为SOFC 选择合适的燃料提供了理论依据。
1 模型介绍
1.1 模型几何参数
几何模型以中国科学院宁波材料技术与工程研究所开发的Ni-YSZ/YSZ/LSCF-GDC 阳极支撑型平板SOFC 为原型。模型由互连板(IC)、气体通道(CH)、阳极支撑层(ASL)、阳极功能层(AFL)、电解质(EL)、阴极功能层(CFL)、阴极电流收集层(CCL)组成。阳极、阴极和电解质材料分别为Ni-YSZ、LSCFGDC 和不锈钢。表1 给出了模型的几何参数;图1 给出了模型的几何结构和截面示意图。

表1 模型几何参数

图1 SOFC 几何结构及YZ截面示意图
1.2 模型简化
为了提高运算效率,数学模型做了一部分简化:
(1)气道内是单相不可压缩层流流动;
(2)混合气体作为理想气体;
(3)各部分材料物性参数具有各向同性;
(4)甲烷混合气中水碳比高,忽略积碳[12]。
2 数学模型
2.1 化学反应模型
当通入甲烷混合气时,甲烷会在阳极内进行重整,发生甲烷蒸汽重整反应(MSR)和水汽变换反应(WGS):

H2和CO 分子通过多孔阳极层扩散到电解质-阳极界面处的三相边界处(TPB),在该处H2和CO 跟O2-反应生成H2O、CO2和电子。下面3 个反应为相关电化学反应:

对于通入氢气的燃料电池,则只需要考虑反应(3)和(5)即可。
对应于MSR 和WGS 的反应速率分别为[13]:

式中:r为反应速率,mol/(m3·s);AS为活性比表面积,m-1;下标a 为阳极;R为通用理想气体常数,8.314 J/(K·mol);T为温度,K;p为压力,Pa;速率常数kWGS和平衡常数KWGS都是根据实验数据计算得出的与温度相关的表达式[14]。
电流密度用Butler-Volmer 方程来表达,方程如下所示:

式中:CR为还原物质浓度,mol/m3;CO为氧化物质浓度,mol/m3;上标0 为初始状态;ne为反应转移的电子数;F为法拉第常数,96 500 C/mol;α 为电极传递系数,本文取0.5;ηact为活化极化电压,V;J为电流密度,A/m2;J0为交换电流密度,A/m2。氢气电化学反应的J0由以下等式给出[15]:

式中:A为反应的指前因子,Ω/m2;下标a 为阳极,下标c 为阴极;E为反应活化能,J/mol。
文献中关于CO 电化学氧化反应的实验数据有限,Matsuzaki 和Yasuda[16]通过实验测量了Ni-YSZ 多孔金属陶瓷界面上H2和CO 的电化学氧化速率,发现在1 023 和1 273 K时H2的电化学氧化速率分别比CO 高1.9~2.3 倍和2.3~3.1 倍。据此将CO 的阳极交换电流密度设为H2的50%。
2.2 物理场控制方程
组分传输由扩散和对流引起,方程表示为:

式中:Sj为组分j的生成率,kg/(m3· s),由法拉第定律计算确定;ρ 为密度,kg/m3;u为速度,m/s;下标g 为气相;ωj为组分j的 质 量 分 数;dj为 组 分j的 扩 散 通 量,kg/(m2· s),由 考 虑Kundsen 扩散的Fick 扩散模型计算确定,方程定义为式(12):
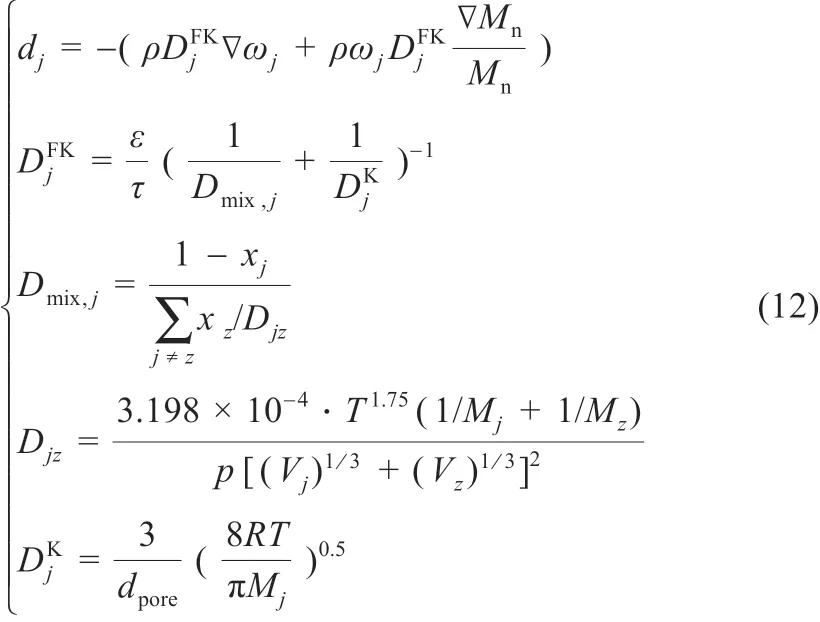
式中:Mn为混合气体的平均摩尔质量,kg/mol;Mj为组分j的摩尔质量,kg/mol;为Fick 模型气体扩散系数,m2/s;ε 为多孔介质孔隙率;τ 为多孔介质传输路径曲折因子;xj为摩尔分数;Djz为组分j和组分z的二元扩散系数;Vj为扩散体积,m3/mol,DK为Kundsen 扩散系数;dpore为多孔介质孔隙的平均直径,m。
气体流动用Navier-Stokes 动量守恒方程来描述:

传热分为多孔介质及固体区域的热传导和流体区域的热对流两部分。控制方程如下所示:
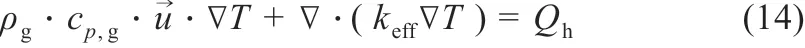
式中:cp为定压比热容,J/(kg · K);keff为有效导热系数,W/(m·K);Qh为热量源项,W/m3。
离子和电子的传输控制方程如下:

式中:σ为电导率,S/m,不同材料的电导率可以参考文献[17];φ 为电位,V;下标elec 为电子,ion 为离子,eff 为有效值。
2.3 物性参数及边界条件
模型各部分的物性参数及相关模拟参数由表2 给出。

表2 模拟参数
求解控制方程还需给定相应的边界条件。阳极连接体上表面设置为接地,阴极连接体下表面设置为电池电压,电池左右两侧设置为周期性条件,其余边界为电绝缘和热绝缘。工作温度为1 073 K,压力为0.1 MPa。阳极和阴极入口流量分别为100×10-6和200×10-6,阳极和阴极气体流动方向相同。甲烷混合气燃料各组分摩尔分数比为CH4∶H2∶H2O∶CO∶CO2=17.5∶25.9∶49.3∶2.9∶4.4,阴极入口气体各组分摩尔分数比为O2∶N2=21∶79。氢气燃料摩尔分数比为H2∶H2O=97∶3,阴极气体组成和流量均与甲烷混合气电池相同。对于传热和传质,气体出口为对流边界条件;对于流动,气体出口为压力出口边界条件。
3 模拟结果及分析
3.1 模型验证
通过对比郭常福[18]2018 年报道的实验数据来验证模型的准确性。实验以4 cm×4 cm 阳极支撑型平板SOFC 作为测试对象,分别以氢气和甲烷混合气作为燃料测量了电流密度-电压(J-V)性能曲线。表3 为相应的实验条件。
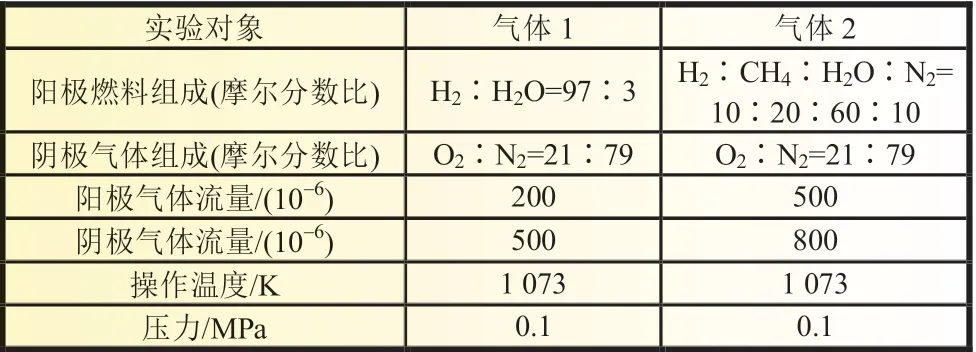
表3 实验参数
图2 为相同操作条件下模拟与实验数据的对比。可以看到,对于氢气燃料而言,模型的J-V曲线与实验数据的吻合性非常高。而对于甲烷燃料而言,使用方程(9)进行模拟时发现结果比实验值小,这是因为现有模型使用的交换电流密度方程都是从以加湿氢气为燃料的SOFC 中得到的,而根据Takino 等[19]的研究,氢燃料的交换电流密度并不完全适用于烃类燃料的SOFC,通过实验测量发现甲烷混合气为燃料的SOFC 的交换电流密度比氢气燃料的大。通过提高方程(9)的指前因子,使修改后的模型与实验更加符合。对于不同燃料下SOFC 的数值模拟,要仔细考虑交换电流密度的选择。总体而言,所建立的数值模型对于氢气和甲烷混合气的模拟都具有一定的可靠性。

图2 电压随平均电流密度变化的对比验证
3.2 输出性能
图3为两种燃料下模拟的电压和输出功率密度随电流密度变化的曲线图。在0.7 V 以上的电压区域,甲烷燃料在相同电压下的电流密度更大,这是因为较高的电压区域对应于较低的电流密度,在较低的电流密度区域两种电池的温度相差不大,甲烷燃料电池的反应物在电极中扩散更均匀,使得电化学反应速率更快。而在0.7 V 以下,氢气燃料电池的电流密度则超过了甲烷电池的,这是因为甲烷重整吸热导致电池温度更低,两者温度相差较大,温度对电化学反应速率的影响超过了反应物浓度的影响,使得甲烷电池的电化学反应速率下降。

图3 电压及功率密度随平均电流密度变化曲线
在整个工作电压范围内,两种电堆的功率密度随着平均电流密度的变大,都呈现先增大,达到峰值后减小的趋势。甲烷燃料电池的最大功率密度约为0.62 W/cm2,相对应的平均电流密度和电压分别为0.94 A/cm2,0.63 V。氢气燃料电池相对应的值分别为0.85 W/cm2、1.69 A/cm2和0.5 V。氢气供料的SOFC 功率密度峰值更大,因为氢气进入电池后可以直接进行电化学反应。另一方面,甲烷蒸汽的重整会降低电池温度从而导致电化学反应速率下降。
3.3 温度分布
图4 和图5 分别为电压0.7 V 时氢气和甲烷燃料电池在Y=1 mm 截面(电池Y方向的中心截面)上电池的温度分布,X=0 处为气体入口。由于电池长度即相比于宽度和高度大很多,接下来所示的截面云图均按1∶5 比例绘制。

图4 Y=1 mm 的中心截面氢气燃料电池温度分布

图5 Y=1 mm 的中心截面甲烷燃料电池温度分布
从图4 和5 中可以看出,两种燃料沿着气体流动方向温度都逐渐上升,在出口处达到最大值。因为电池运行中存在电化学反应产热、活化极化产热和焦耳热,在它们的共同作用下,导致温度沿着流动方向上升。H2为燃料时入口处跟出口处的温差约为37 K,甲烷混合气只有6 K。这是因为甲烷的蒸汽重整反应是一个强烈的吸热反应(反应焓变为206 kJ/mol),电化学反应产生的热量和焦耳热大部分会用于该吸热反应,导致电池整体温度的降低。另外,由于大部分的甲烷重整发生在入口处,所以靠近入口处阳极多孔介质内的温度跟气道内的温度相差不大,而对于H2燃料而言,靠近入口处阳极多孔介质内的温度比气道温度增加了约20 K。此外,由于阴极气体流量大于阳极,对流散发的热量更多,所以氢燃料电池沿着气体流动方向,阴极气道的升温速度远小于阳极。但是,甲烷燃料电池除了上述原因之外,更主要的是因为重整反应在阳极入口处产生了一个强烈吸热的区域,最终导致甲烷电池阳极气道出口处的温度小于阴极的。
图6给出了不同电压下阳极气道中心线温度在长度方向(图1 中的X轴方向)的分布。从图中可以看到随着电压降低,无论使用哪种燃料,电池的温度都会逐渐增加,因为电化学反应速率随着电压降低增大,电化学产热和欧姆热都会增加。甲烷蒸汽重整反应会强烈吸热,导致甲烷燃料电池随电压下降温度上升的幅度远小于氢气,同时也导致了在电压较高时,电池中会出现过冷现象,即电池中存在小于工作温度(1 073 K)的区域。
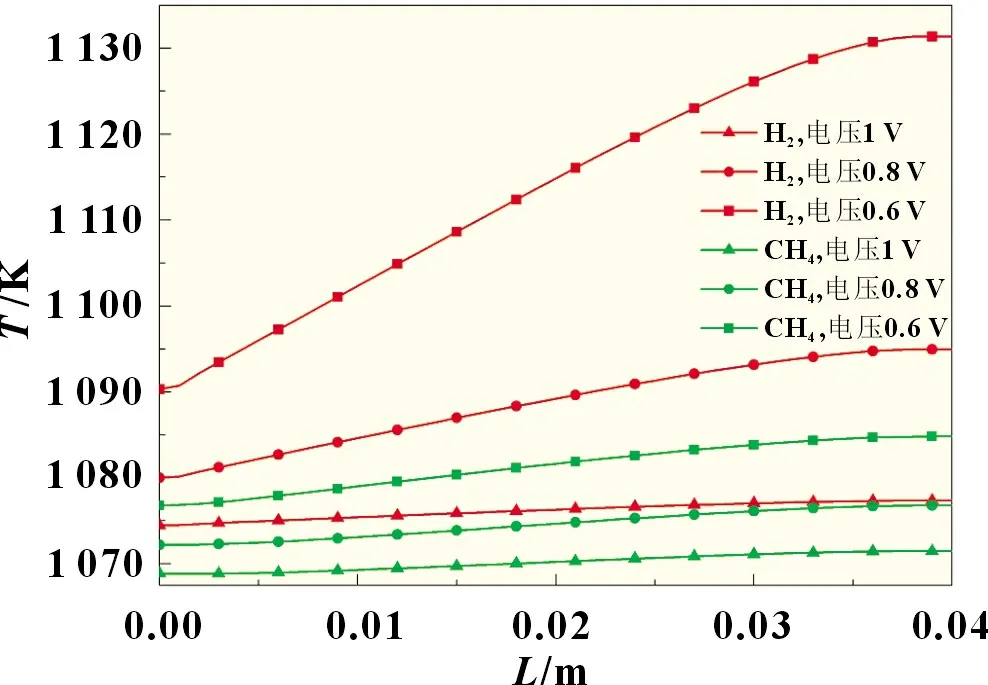
图6 不同电压下阳极气道中心线温度沿长度方向分布
3.4 速度分布
图7 和图8 分别给出了Y=1 mm 截面上(电池Y方向的中心截面)氢气和甲烷电池的流速分布图。氢气电池的温度要更高,导致其密度降低,同时粘度变大,同样流量下密度降低使气体流速增加,粘度变大使气体流速减小。从图中可以看出,阴极内空气在氢气电池中的速度要小于甲烷电池,说明粘度对速度的影响要大于密度对速度的影响。

图7 Y=1 mm 的中心截面氢气燃料电池速度的分布

图8 Y=1 mm 的中心截面甲烷燃料电池速度的分布
4 结论
分别对以氢气和甲烷混合气为燃料的SOFC 进行了三维多物理场耦合模拟,比较了两者在输出性能、电池内部温度分布以及氧气利用率方面的差异:
(1)在0.3~1.05 V 的工作电压范围内,SOFC 的功率密度随着平均电流密度的变大,都先增大,达到峰值后减小,氢气燃料电池的功率密度峰值更大;
(2)两种电池的温度都沿着流动方向上升,氢气燃料电池的温度梯度要更大;
(3)电化学反应使阳极内的质量流量增加,流速变大。阴极内气体在氢气电池中的速度要小于甲烷电池的。
