镁锂混合电池TiO2空心球正极材料的制备与性能
2022-01-07朱玉晓邹建新
朱玉晓,徐 昊,李 钊,邹建新
(1. 上海交通大学轻合金精密成型国家工程研究中心,上海 200240;2. 上海交通大学上海镁材料及应用工程技术研究中心,上海 200240)
随着经济社会高速发展,可再生能源的开发、储存与利用成为可持续发展的关键所在,因此高效电化学储能器件的研发显得尤为重要。其中,锂离子电池已被广泛应用于便携式电子设备和各种新能源设备中作为储能器件。然而金属锂在充放电过程中极易形成锂枝晶从而刺穿隔膜造成电池短路,存在进一步引发过热、燃烧甚至爆炸隐患,所以金属锂无法直接被应用为电池负极,因此导致电池容量受限,这阻碍了锂离子电池的进一步应用与发展。与锂相比,物理化学性质相似的镁作为电池负极时不易产生枝晶,具有更高的体积比容量[3 833 mAh/cm3vs. 2 046 mAh/cm3(Li)]、更低廉的价格、更好的安全性和环境友好性,因此镁电池具有成为下一代绿色高效安全化学电源的潜力[1]。
但与此同时,镁电池的发展受到一定的限制,由于二价镁离子相比一价锂离子具有更大的电荷密度,与正极材料存在更强烈的库仑作用,使其很难在一般的正极材料中完成可逆脱嵌,这使得镁离子电池的可实现容量与循环性能都还远不及锂离子电池,无法发挥金属镁负极的优势。基于此,混合离子电池体系,特别是镁锂双离子电池体系成为研究方向之一[2],其思路在于将锂离子较好的动力学特性与金属镁负极高体积比容量与高安全性等优异特性相结合,使得在理想条件下混合离子电池拥有显著优于镁离子电池的电化学性能及比锂离子电池更好的循环安全稳定性。然而,由于电压窗口限制以及与镁离子电解液的适配性,许多锂离子电池中采用的正极材料不再适用于镁锂混合离子电池体系。因此,目前镁锂混合离子电池的研究重点在于寻找具有高容量及良好循环稳定性的正极材料和适配的电解液体系。
现阶段相关的正极材料研究主要集中于过渡金属氧化物、硫化物、聚阴离子型化合物等。 例如Mo8S6[3]、MoS2[4]、Li4Ti5O12[5]等,而TiO2作为具有代表性的过渡金属氧化物,由于其优异的化学活性与催化性能,已被广泛应用于光催化、电容器等领域,同时其作为嵌入型正极材料可用于锂离子电池体系[6]。然而利用TiO2作为纯镁离子电池正极材料的研究却进展有限,这主要是TiO2自身的晶格结构特性所决定的,当镁离子插入TiO2晶格间隙中时,其晶格稳定性随着镁离子插入量的增加而增强,镁离子脱嵌势垒随之提高,使得镁离子在TiO2中的理论容量受限[7]。另一方面,由于镁离子较大的电荷密度,较差的动力学特性以及镁离子电解液较差的去溶剂化特性,其脱嵌过程难以可逆进行,以其为正极的纯镁离子电池实际电化学性能较差[8]。后续研究也尝试通过结构设计或掺杂生成阳离子空位等策略改善镁离子在TiO2中的脱嵌过程,但受制于TiO2本身的特性而效果有限[9-11]。因此本文以其为研究对象,对其形貌结构进行再设计,并通过引入镁锂混合离子电池体系使其在可充镁电池中能具有更好的电化学表现。
由于负极材料金属镁的应用,因此镁锂混合离子电池电解液通常以镁离子电解液为基础,通过相应Li 盐或含Li 化合物的添加获得镁锂混合离子电解液进行使用,诸如APC+LiCl体系[12]、LiBH4+Mg(BH4)2/二乙二醇二甲醚体系[13]、LiTFSI+(HMDS)2Mg-(AlCl3)2MgCl2/二甲醚体系[14]等均有应用于使用不同正极材料的镁锂混合离子电池,能使在合适的电压窗口下使镁离子在负极进行较好的可逆沉积/溶解。其中APC+LiCl 体系由于拥有接近~3.0 V 的较高电压窗口以及LiCl 在四氢呋喃中较好的溶解性,因此使用最为广泛,本文也以其为镁锂混合离子电解液进行正极材料的研究。
本文通过硬模板法制备了锐钛矿型空心TiO2纳米球作为镁离子及镁锂混合离子电池的正极材料,利用LiCl 作为电解液添加剂获得APC+LiCl 混合离子电解液,以镁金属为负极组装扣式电池,进行后续电池电化学性能研究。
1 实验
1.1 TiO2空心纳米球材料的合成与表征
本文通过硬模板法制备合成锐钛矿型TiO2空心纳米球[15],合成过程主要分为以下几个部分:
首先通过Stöber 法制备了SiO2纳米球模板,将70 mL C2H5OH 与30 mL 去离子水混合搅拌15 min 至均匀,再向混合溶液中加入5 mL 正硅酸乙酯(TEOS)继续搅拌45 min 至均匀,向其中加入5 mL 浓氨水继续搅拌3 h 使水解充分,将所得产物利用无水乙醇(C2H5OH)与去离子水进行充分离心洗涤,在60 ℃下干燥24 h,获得SiO2纳米球模板,记为S0。
之后,通过水解制备TiO2@SiO2纳米球,将50 mL 无水乙醇(C2H5OH)与0.2 mL 去离子水混合搅拌15 min 至均匀,取0.2 g 上述制得的SiO2纳米球与0.1 g 羧丙基纤维素充分溶解于上述制得的混合溶液中,以600 r/min 转速充分搅拌30 min,再进行30 min 超声处理,反复三次,获得白色悬浊液。另外将1 mL 钛酸四丁酯(TBOT)溶解于15 mL 无水乙醇中搅拌均匀,通过分液漏斗在保持转速为600 r/min 的条件下,将其逐滴滴加至上述白色悬浊液中,充分搅拌均匀,并在转速不变的条件下加热至80 ℃进行回流加热100 min,使钛酸四丁酯充分水解,将所得产物利用无水乙醇与去离子水进行充分离心洗涤,在60 ℃下干燥24 h,获得TiO2@SiO2纳米球,记为S1。
最后,对所得TiO2@SiO2纳米球进行刻蚀获得目标产物,首先取300 mg TiO2@SiO2纳米球加入40 mL 去离子水进行充分搅拌30 min,再进行30 min 超声处理,反复三次,向其中加入3 mL 2.5 mol/L NaOH 溶液,在50 ℃下水浴搅拌6 h,将所得产物利用无水乙醇与去离子水进行充分离心洗涤后再加入40 mL 去离子水充分搅拌,并向其中加入2 mL 1 mol/L HCl溶液,在50 ℃下水浴搅拌1 h,将所得产物利用无水乙醇与去离子水进行充分离心洗涤干燥后,在700 ℃下退火2 h,获得最终产物锐钛矿型空心TiO2纳米球(TiO2-HS),记为S2。
利用X 射线衍射仪(XRD,Rigaku Ultima IV)对产物物相进行表征,使用Cu 靶Kα 射线源(λ=0.154 nm),管压40 kV,步长0.01°,扫速5 (°)/min,扫描范围10°~80°。利用场发射扫描电子显微镜(SEM,JSM7600F) 及场发射透射电子显微镜(TEM,FEI Talos F200X)观察产物形貌。
1.2 电池的组装和测试
将合成产物锐钛矿型TiO2空心纳米球、纳米碳粉、聚偏氟乙烯(PVDF)以质量比8∶1∶1 混合,在研钵中充分研磨均匀后加入适量N-甲基吡咯烷酮(NMP)继续研磨搅拌。将得到的黑色浆料均匀涂覆在铜箔上,80 ℃真空干燥12 h 后裁切成直径14 mm 的正极片待用,控制正极片每片活性物质负载量约为0.70 mg/cm2,负极片则选用打磨光亮的纯镁片,控制负极片每片质量约为300 mg。 电解液选用现制的PhMgCl-AlCl3/THF(APC)以及LiCl 作为锂盐添加剂,配制0.4 mol/L APC+1.0 mol/L LiCl 混合双盐电解液,隔膜为商业PP 隔膜。将正、负极片和隔膜干燥后,使用电解液在手套箱内组装成CR2032 扣式电池,静置12 h 后进行电化学测试。
循环伏安测试在电化学工作站(CHI660E)上进行,电压范围为0.01~2.0 V,扫速为0.5 mV/s。恒流充放电测试在Land电池测试系统上进行,电压范围为0.01~2.0 V,电流密度为60 mA/g。
2 结果与讨论
2.1 物相结构与表面形貌分析
图1为TiO2空心纳米球(TiO2-HS)合成过程各阶段产物的XRD 的图谱。由图1 可以看出,通过Stöber 法合成的SiO2样品S0 的衍射峰位置与SiO2(PDF #39-1425)标准图谱相一致,说明所合成的SiO2模板物相较纯。 通过水解包覆制得的TiO2@SiO2样品S1 的衍射峰位置与锐钛矿型TiO2(PDF#21-1272)标准谱图相符合,但峰宽较宽,证明液相合成产物结晶性较差,而最终刻蚀获得的TiO2产物S2 的衍射峰位置与锐钛矿型TiO2(PDF#21-1272)标准谱图相一致,一方面说明最终合成产物为单相锐钛矿型TiO2材料,另一方面较窄的峰宽说明通过水解获得的TiO2具有较小的颗粒尺寸,较大的衍射强度说明材料通过退火处理后能具备更好的结晶性能。

图1 三种样品的X 射线衍射图谱
图2 为TiO2空心纳米球合成过程各阶段产物的扫描电子显微镜图像。可以发现通过Stöber 法合成的SiO2样品S0 呈分散的纳米球形,粒径约为300 nm,形貌规则,而通过钛酸四丁酯水解获得的TiO2@SiO2复合产物S1 也呈较为分散的纳米球形,但粒径略有增大约为340 nm,且形貌依然规则,可以较为清晰地观察到在SiO2球模板上的附着变化与部分粘连,最终经刻蚀获得的TiO2产物S2 在SEM 图像中表现出与前驱体TiO2@SiO2相似的形貌,结构并未被破坏,同样呈规则分散的纳米球形,不同的是纳米球中心衬度较低,表现出空心结构的特征,但需进一步进行表征分析。

图2 各样品的SEM 图像
图3为TiO2最终产物的TEM 图像与相对应的选区电子衍射图像、高分辨图像与元素分布情况。在TEM 图像中,可以较为清晰地观察到最终产物表现为空心纳米球结构,直径约为300 nm,证明了SEM 图像所表现的结果,并且球形结构较为完整,未有明显塌缩与破坏。与SEM 图像相同的是,球形结构间存在一定的粘连与共生长,推测这与SiO2模板并不充分的分散有关,导致TiO2壳层生长过程中相互连结。对于TiO2空心纳米球壳层部分的高分辨及选区电子衍射分析可知,其为较为典型的锐钛矿型TiO2结构,衍射环分别对应了(101)、(103)、(004)、(200)、(105)晶面,结晶性较好,而元素分析则较为清晰地反映了所获得的TiO2空心纳米球中的元素分布情况,除较为明显且一致的Ti 与O 元素的分布外,仅有较少部分Si 元素存在于材料表面,说明NaOH 溶液对于SiO2模板的刻蚀虽并不完全,但已较为充分。通过以上表征手段可知,合成的为具有规则形貌的单相锐钛矿型TiO2空心纳米球。

图3 TiO2最终产物的TEM图像与相对应的选区电子衍射图像、高分辨图像与元素分布情况
2.2 电化学性能与分析
取所合成的单相锐钛矿型TiO2纳米空心球最终样品作为正极材料分别组装镁离子电池与镁锂混合离子电池进行电化学测试,在电压窗口0.01~2.0 V 以及电流密度为60 mA/g的条件下,两种电池体系前三次比容量-电压曲线如图4 所示。 在镁离子电池体系中,电池首次放电比容量仅为6.1 mAh/g,随后虽略有上升,但几乎不表现出放电比容量。与之相对应的是,在镁锂双离子电池体系中,电池首次即具有72.9 mAh/g 的放电比容量,其中放电过程在1.0~0.5 V 间具有较明显的平台特征,而对应的在1.2~1.4 V 间也具有较明显的充电电压平台过程。随着电池充放电过程的进行,可以发现充放电电压平台与首次基本保持一致,电池充放电比容量也有一定的上升,在第3 次即具有116 mAh/g 的放电比容量,接近TiO2的理论比容量156 mAh/g。相比纯镁离子电池,镁锂混合离子电池所表现出的对于正极材料的激活效应,显然与LiCl 的添加所提供的锂离子相关,有待进一步研究,而TiO2所表现出的较高充放电比容量可能与其空心结构所带来的较高比表面积所提供的丰富反应活性位点有关,并且电解液高度的浸润性使得正极材料与电解液所处固液界面的离子扩散更易进行,在提升电池放电比容量的同时显著加速了活化进程。

图4 两种以TiO2空心纳米球为正极的电池前三次的比容量-电压曲线
图5为取所合成的单相锐钛矿型TiO2空心纳米球作为正极材料分别组装镁离子电池与镁锂混合离子电池体系60 mA/g 电流密度下,前50 次的循环次数-放电比容量曲线,更加清晰地反映了镁离子电池难以表现出电化学活性,几乎不具备容量表现,而镁锂混合离子电池体系在相同条件下则能进行稳定循环,在第50 次时依然能保持102.5 mAh/g 的放电比容量。随着电池循环过程所表现的容量衰减,可能与正极材料在充放电过程中离子脱嵌过程所造成的不可逆晶格变化和一定的体积膨胀有关,这一变化是随电化学过程的进行不可逆发生的。以上结果再次说明在镁锂混合离子电池中,TiO2空心纳米球才能表现出电化学活性,并且其循环性能及容量与微观形貌密切相关。
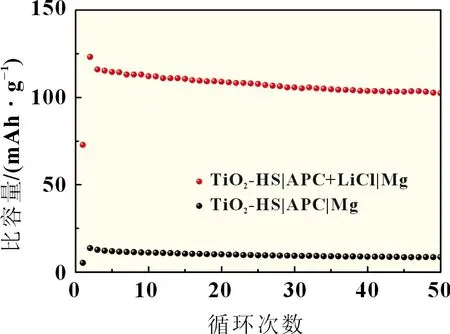
图5 以TiO2空心纳米球为正极的两种电池前50次的循环次数-放电比容量曲线
根据电化学测试结果,本文对于合成的单相锐钛矿型TiO2空心纳米球作为正极材料时在镁离子与镁锂双离子电池中的反应机理与电化学反应过程进行了进一步探究。对以其为正极材料组装的镁离子与镁锂双离子电池进行循环伏安测试,设置循环伏安扫描速度为0.5 mV/s,截止电压分别为0.01 和2.0 V(vs. Mg/Mg2+),得到充放电过程前三次的CV 曲线如图6(a)(b)所示。根据测试结果发现,在镁离子电池中并未有明显的氧化还原峰的出现,而在镁锂混合离子电池中首次存在较明显的极化过程,这与充放电曲线中首次所表现的较大充电比容量相匹配,第二次即可在~0.6 V 与~1.6 V 处发现明显的还原峰与氧化峰,且在随后的电化学过程中保持稳定,这对应于比容量-电压曲线中的电压平台状态,在充电过程~0.8 V 处循环伏安曲线所表现出的变化可能与电池充放电初期离子的分步脱出过程有关,并随循环过程而逐渐减弱。仅在~0.6 V 与~1.6 V 处的一组明显的还原峰与氧化峰随循环过程保持稳定,这说明电池充放电过程仅存在一组离子的可逆嵌入/脱出过程。图6(c)则对比表现了镁离子与镁锂混合离子电池的循环伏安曲线,再次说明锂离子的加入对于电池体系的改善以及锂离子在镁锂混合离子电池中的作用。

图6 以TiO2空心纳米球为正极的两种电池的性能曲线
结合文献[16],并且考虑到本实验所使用的混合双盐电解液中LiCl 的添加量足以使得正极活性物质完全反应,本文认为在以锐钛矿型TiO2空心纳米球为正极材料时,以放电过程为例,镁锂混合离子电池发生的电化学反应过程为(0<x<1):

在镁锂混合离子电池充放电过程中,由于锂离子具有更优异的动力学特性、更小的离子半径以及更弱的库仑作用,因此相比镁离子能够更容易进入TiO2晶格间隙,使得正极反应得以快速而可逆地进行,而同时锂离子的加入改善了电解液的溶剂化特性,使得镁离子在负极的溶解与沉积过程也随之得以改善,锂与镁的氧化还原电位也决定了锂离子无法在镁负极进行沉积/溶解,因此使得在镁锂混合离子电池充放电过程中负极为镁离子的溶解沉积,而正极为锂离子在TiO2中的嵌入脱出。而本文合成的具有空心结构的纳米球形TiO2能进一步改善锂离子在正极的脱嵌过程,减轻正极材料在充放电循环过程中的体积膨胀对于电池电化学性能的影响,相比已有研究使电池性能进一步提升。
3 结论
本文利用硬模板法合成了具有规则形貌的锐钛矿型TiO2空心纳米球,粒径仅为~300 nm,并探究了其作为镁离子与镁锂混合离子电池正极时电池电化学性能的表现,最后探究了其在两种电池体系中的电化学反应机理。实验测试表明,所制得的锐钛矿型TiO2空心纳米球在镁锂混合离子电池中作正极时,在60 mA/g 电流密度下,首次放电比容量为72.9 mAh/g,50 次循环后能保持102.5 mAh/g。然而,当其作为镁离子电池正极材料时,难以表现出电化学活性,这与锂离子的添加与TiO2纳米球的空心结构所提供的较高比表面积和对于液态电解液高度的润湿性有关。CV 测试结果进一步说明,镁锂混合离子电池的充放电过程主要由镁离子在负极的溶解沉积与锂离子在正极的嵌入脱出过程共同组成。本工作采用的镁锂混合离子电池体系为可充镁电池的发展提供了新的思路,有待进一步的深入研究。
