急性脑梗死病人血清ANGPTL4、SIRT1水平与颈动脉粥样硬化斑块稳定性的关系
2022-01-07夏瑞雪王丽轩张俊玲相凤兰戴建宁
夏瑞雪,李 阔,王丽轩,张俊玲,相凤兰,郭 建,戴建宁
急性脑梗死是多种原因导致局部脑组织供血突然中断引起脑组织坏死,具有较高的发病率、致残率及致死率,严重威胁居民生命健康[1]。有研究表明,颈动脉粥样硬化(carotid atherosclerosis,CAS)斑块破裂后促进血栓形成是急性脑梗死重要的病理基础[2],因此,积极探讨CAS形成和稳定性的相关机制对急性脑梗死的早期发现、干预及提高预后具有重要意义。有研究显示,血脂异常和血管内皮损伤在动脉粥样硬化(atherosclerosis,AS)过程中发挥着重要作用[3]。血管生成素样蛋白4(angiogenin like protein 4,ANGPTL4)是近年来新发现的一种人类相关血管生成素样蛋白,可抑制脂蛋白脂肪酶(lipoprotein lipase,LPL)和泡沫细胞形成,稳定AS斑块,抑制其发展[4]。沉默信息调节蛋白1(silencing information regulator protein 1,SIRT1)是一种组蛋白去乙酰化酶(histone deacetylase,HDAC),有研究表明,SIRT1通过调节相关通路参与多种心血管疾病过程[5]。关于血清ANGPTL4和SIRT1水平与急性脑梗死关系的研究较少,本研究分析急性脑梗死病人血清ANGPTL4和SIRT1水平变化,探讨其与CAS斑块稳定性的关系,以期为早期防治急性脑梗死提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2016年3月—2020年2月我院收治的231例急性脑梗死病人为急性脑梗死组,所有病人均经颅脑CT或MRI确诊,其中男127例,女104例;年龄47~82(61.24±8.63)岁;体质指数19~25(23.19±1.53)kg/m2;吸烟82例,饮酒61例。纳入标准:符合《中国急性缺血性脑卒中诊治指南2014》[6]制定的相关诊断标准;病人及家属均研究内容知情;临床资料完整;初次发作就诊;入院时间<48 h。排除标准:重要器官严重功能障碍;感染性疾病;恶性肿瘤;脑血管畸形、心源性、外伤、血液系统疾病等因素导致的急性脑梗死;近期创伤、感染、手术史。另选同期来我院体检健康者72名为对照组,其中男40名,女32名;年龄45~80(60.24±8.72)岁;体质指数18~25(22.07±1.61)kg/m2;吸烟24名,饮酒17名。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。
1.2 方法
1.2.1 一般资料收集 收集急性脑梗死病人一般资料,包括性别、年龄、体质指数、吸烟、饮酒、疾病史(糖尿病史、高血压史等)、实验室指标[国赛Astep特定蛋白分析仪测定血清超敏C-反应蛋白(high-sensitivity C-reactive protein,hs-CRP),迈瑞BS-300全自动生化分析仪测定三酰甘油(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)]等。
1.2.2 颈动脉超声检查 急性脑梗死病人均接受颈动脉超声检查,选择GE730彩色多普勒超声诊断仪,探头频率为5~10 MHz,病人取平卧位,于肩下垫软枕,将头部偏向一侧,充分暴露颈部,观察颈动脉内膜结构、光滑程度、增厚情况、斑块形态、位置、大小、内部回声、血流等情况,测量双侧颈动脉和分叉处及颅外段颈动脉内中膜厚度(carotid intima media thickness,CIMT),取平均值为最终CIMT。根据《中国头颈部动脉粥样硬化诊治共识》[7]定义CAS斑块稳定情况,存在CIMT≥1.5 mm即CAS;不稳定斑块即斑块表面部光滑,内部呈低回声,可见似火山口壁龛影,斑块厚度/对侧内中膜厚度>2 mm;稳定斑块即斑块表面光滑,向管腔内突起,内部强回声伴声影或均匀等回声。若同时存在稳定和不稳定斑块,判定为不稳定斑块。将急性脑梗死组根据CAS斑块情况分为不稳定组(141例)、稳定组(54例)和无斑块组(36例)。
1.2.3 血清ANGPTL4和SIRT1水平测定 抽取所有研究对象3 mL空腹静脉血,以3 000 r/min离心10 min,半径10 cm,取上清液,置于-80 ℃环境中保存,采用酶联免疫吸附法测定血清ANGPTL4和SIRT1水平,试剂盒由齐一生物科技有限公司提供,所有操作严格按照说明书进行。
2 结 果
2.1 急性脑梗死组与对照组血清ANGPTL4和SIRT1水平比较 急性脑梗死组血清ANGPTL4、SIRT1水平低于对照组(P<0.001)。详见表1。

表1 急性脑梗死组与对照组血清ANGPTL4和SIRT1水平比较(±s)
2.2 急性脑梗死病人各亚组临床资料比较 不稳定组血清hs-CRP、TC、LDL-C水平高于稳定组和无斑块组(P<0.05),ANGPTL4、SIRT1、HDL-C水平低于稳定组和无斑块组(P<0.05)。详见表2。

表2 急性脑梗死病人各亚组临床资料比较
2.3 影响CAS斑块稳定性的多因素Logistic回归分析 以单因素分析中差异有统计学意义的因素为自变量,以CAS稳定性为因变量(不稳定=1,稳定=0),多因素Logistic回归分析结果显示:hs-CRP为CAS斑块稳定性的危险因素(P<0.05),ANGPTL4、SIRT1为CAS斑块稳定性的保护因素(P<0.05)。详见表3。
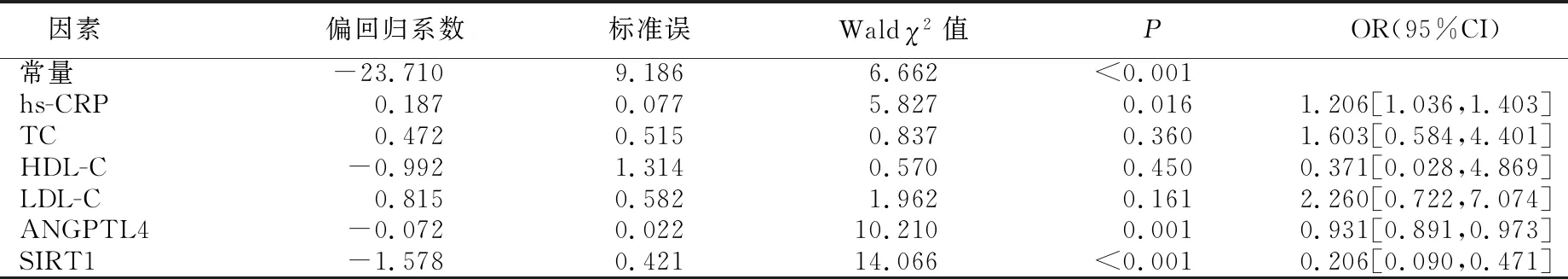
表3 CAS斑块稳定性影响因素的多因素Logistic回归分析
2.4 血清ANGPTL4和SIRT1水平对CAS斑块不稳定性的诊断价值 ROC曲线显示,血清ANGPTL4和SIRT1诊断CAS斑块不稳定性的灵敏度分别为79.43%、60.28%,特异度分别为70.37%、81.48%。详见表4、图1。

表4 血清ANGPTL4和SIRT1水平对CAS斑块不稳定性的诊断价值
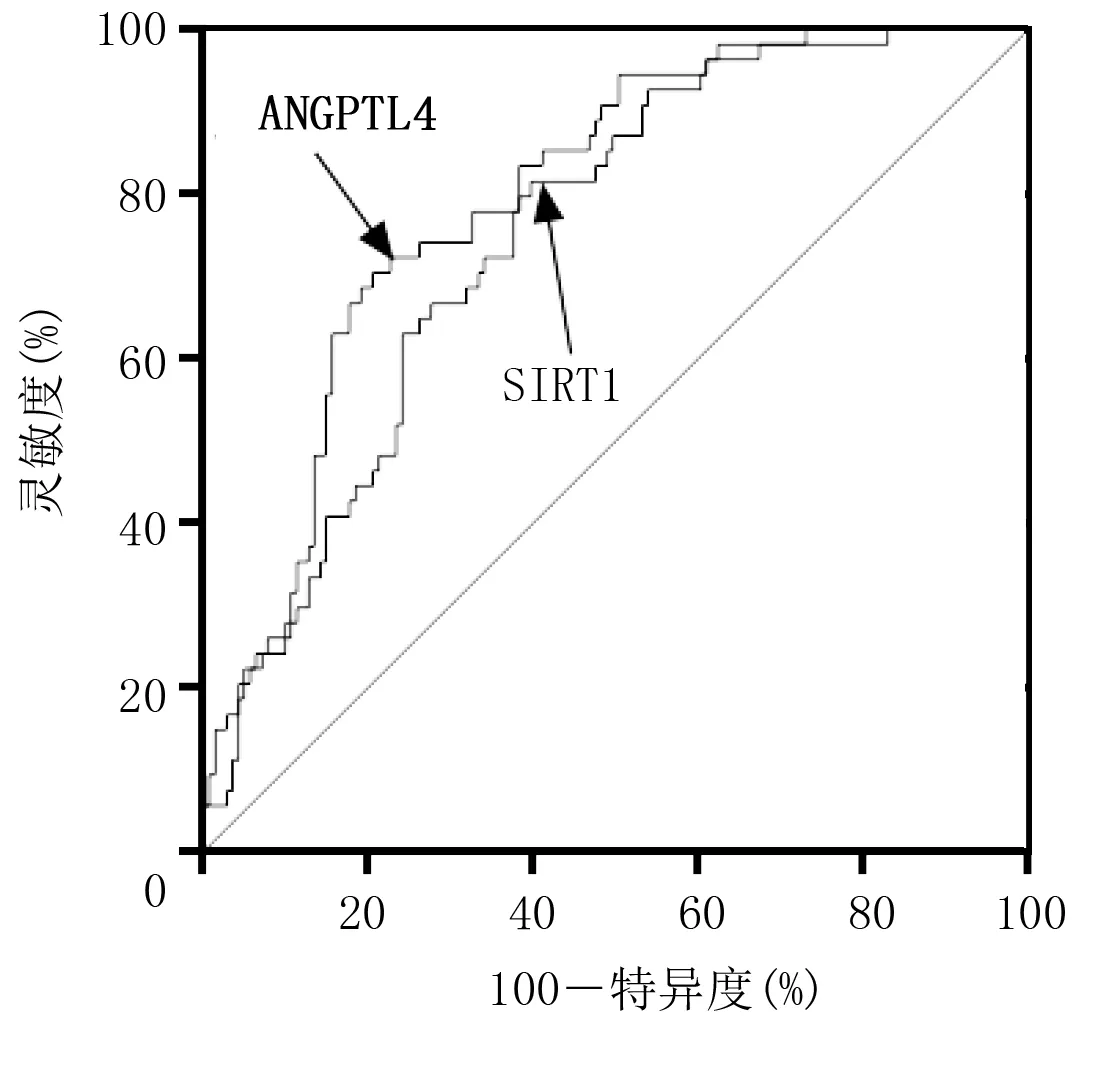
图1 血清ANGPTL4和SIRT1水平诊断CAS斑块稳定性的ROC曲线
3 讨 论
脑血管疾病是全球疾病负担的第3位疾病,根据《2018中国卫生健康统计提要》报告显示,2017年我国农村和城市脑血管疾病死亡率分别为23.18%和20.52%,约每5例脑血管疾病病人中有1例死亡[8]。急性脑梗死为脑血管疾病的常见类型,有研究显示,脑梗死病人中76%存在单侧CAS,58%存在双侧CAS;通过内膜剥脱术去除严重CAS病变后,病人发病风险显著降低,提示CAS斑块易损结构破裂、血小板聚集形成血栓是脑梗死的主要危险因素[9]。
关于CAS形成机制,目前主要以脂肪浸润学说和炎症导致损伤反应学说为主。脂肪浸润学说认为AS危险因素可降低血清HDL-C水平,提高LDL-C水平,LDL-C经氧化后产生的氧化物可损伤动脉血管内皮细胞,改变内膜成分,引起动脉内膜脂质沉积,形成粥样斑块[10]。炎症导致损伤反应学说认为炎症损伤动脉血管内皮细胞后,动脉血管内皮细胞功能受损,平滑肌细胞和白细胞迁移、增殖,引起细胞外基质降解,促进血小板活化,导致血小板黏附、聚集,形成粥样斑块[11]。本研究结果显示,不稳定组血清hs-CRP、TC、LDL-C水平高于稳定组和无斑块组(P<0.05),提示CAS斑块形成及其稳定性与脂质代谢紊乱和炎症反应有关。
ANGPTL为新型的血管生成相关因子,目前共发现ANGPTL1~ANGPTL8,其中ANGPTL4能调节能量和脂肪代谢、炎症反应、血管生成、血管通透性等生理病理过程,在多种脑血管疾病发生过程中发挥重要作用[12]。Zhang等[13]研究显示,ANGPTL4水平与短暂性局灶性脑缺血小鼠模型梗死面积和神经功能缺损程度呈正相关,随着ANGPTL4水平升高,脑梗死面积越大,神经功能缺损越严重。Aryal等[14]研究显示,ANGPTL4具有调节炎症信号传导、保持血管内皮细胞完整性、调节氧化应激等作用,因此急性脑梗死病人血清ANGPTL4表达增加可能与保护脑组织有关。研究显示,脂蛋白脂肪酶能通过促进残粒脂蛋白停留动脉内膜、催化脂质产物形成、增强血管内皮对单核细胞黏附作用,作为结构辅助因子促进细胞摄取脂蛋白等作用促进AS形成,而ANGPTL4是脂蛋白脂肪酶抑制剂,通过调节炎症信号,抑制AS[15]。Katano等[16]研究显示,稳定斑块病人经颈动脉剥脱术治疗后,斑块中ANGPTL4水平升高,认为与ANGPTL4下调成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)表达和上调抗血管生成功能,稳定CAS斑块有关。本研究结果显示,急性脑梗死组血清ANGPTL4水平低于对照组,不稳定组血清ANGPTL4水平低于稳定组和无斑块组(P<0.05),分析ANGPTL4参与斑块发生发展。同时结果显示,ANGPTL4为CAS斑块稳定性的保护因素(P<0.05),说明其能保护斑块稳定性。分析是ANGPTL4可能通过抑制血管内皮生长因子2(vascular endothelial growth factor 2,VEGF2)下游Srs激酶信号抵消血管完整性损失,维持动脉血管内皮细胞功能[17],并通过激活磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号,保护动脉血管内皮细胞完整性,抑制CAS形成[18]。
SIRT1为组蛋白去乙酰化酶抑制剂(HDAC)家族中的一员,广泛分布于肾脏、胰腺、脂肪、肝脏、脑等多种组织器官,主要表达于细胞核,通过改变其他蛋白的乙酰化状态,不仅可维持基因组和染色体稳定性,同时参与炎症反应、氧化应激、糖代谢、细胞代谢、应激反应和细胞自噬、凋亡、增殖等细胞反应,在众多生理和病理发生、发展中发挥着重要作用[19]。Sosnowska等[20]研究显示,SIRT1通过抑制氧化低密度脂蛋白受体-1(oxidized low density lipoprotein receptor-1,LOX-1)表达,降低氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)摄取,减少泡沫细胞产生,起到抗AS形成作用。Lin等[21]研究显示,SIRT1可抑制高血糖引起的动脉血管内皮细胞衰老和高脂饮食引起的AS。Gorenne等[22]研究显示,降低小鼠血管平滑肌细胞SIRT1后,低密度脂蛋白诱导的DNA损伤、凋亡、AS增加,斑块稳定性降低。Carloni等[23]大鼠模型显示,脑缺血模型双侧颈总动脉结扎后,脑血流量明显降低,脑组织受损,注入SIRT1激活剂后,脑缺血模型神经细胞死亡数量明显减少。Deng等[24]研究显示,上调SIRT1后可发挥保护缺血再灌注损伤、抗凋亡、抗炎症反应等作用。本研究结果显示,急性脑梗死组血清SIRT1水平低于对照组,不稳定组血清SIRT1水平低于稳定组和无斑块组(P<0.05),与唐宇姣等[25]研究结果一致,说明SIRT1具有抗AS形成和稳定斑块的作用。同时结果显示,SIRT1为CAS斑块稳定性的保护因素(P<0.05),进一步说明SIRT1可抑制CAS形成,增加斑块稳定性。分析是SIRT1可乙酰化核转录因子κB,抑制其活性,降低白细胞介素-6、白细胞介素-1β、肿瘤坏死因子-α等促炎性因子基因表达,缓解病理损伤[26]。通过缓解低密度脂蛋白诱导细胞的凋亡和动脉血管内皮细胞的氧化应激反应,诱导内皮型一氧化氮合酶表达,保护动脉血管内皮细胞功能[27]。
综上所述,急性脑梗死病人血清ANGPTL4、SIRT1水平降低,其参与CAS斑块形成及发展过程,可作为急性脑梗死病人CAS斑块不稳定性的预测指标。但由于本研究纳入样本量有限,未完全阐明ANGPTL4和SIRT1在CAS中的作用机制,故存在一定的局限性,今后需多中心、大样本量进一步研究。
