不明原因心脏性猝死相关分子标志物研究进展及法医学应用
2022-01-07何享旺李林峰张付云利兵
何享旺,李林峰,张付,云利兵
1.四川大学华西基础医学与法医学院,四川 成都 610041;2.广东省公安厅法医病理学重点实验室,广东广州510050
心脏性猝死(sudden cardiac death,SCD)[1]被定义为:机体各方面(心血管系统除外)无异常表现的个体在症状发作的1 h 内或24 h 内他人目击其身体状态正常情况下突然发生死亡。其中一些案例通过涵盖组织学和毒理学检测的全面尸体检验,仍无法确定死亡原因,称为不明原因心脏性猝死(unexplained sudden cardiac death,USCD),此类案例约占SCD 的40%,通常表现为心脏结构无异常,且高发于年轻人,夜间(18:00—06:00)居多[1]。
探寻SCD 的原因一直都是医学研究和法医学鉴定实践所面临的挑战,特别是USCD 的鉴定还存在相当程度的困难:目击信息多缺乏或准确性有限,易被误认为暴力性死亡;相关的疾病谱广,既有心肌、血管等形态结构的异常,也有电生理紊乱所致的节律失常等功能紊乱;部分遗传性因素已获证实,却也存在疾病外显率差异较大的不确定因素。已有研究[2-4]力图从多方面探明其机制,不仅从组织学层面解释了心脏肥大、心脏瓣膜病等与SCD 的相关性,也结合法医病理学系统检验心脏的案例进一步考量了存在的风险因素。近期人群调查[5]发现,成瘾性药物和精神病类药物与年轻群体的SCD 案例存在明显相关性;当组织病理学和毒理学检测等方法无法明确死因时,对相关分子标志物进行检测,为识别USCD 提供了新的探究路径。本文从分子病理学角度出发,结合DNA、RNA、蛋白质与USCD 的相关性,对最新研究进展进行综述,以期为USCD 的法医学鉴定及研究提供借鉴。
1 USCD 相关基因的突变
1.1 心脏离子通道蛋白的编码基因突变
部分USCD 系离子通道蛋白异常所致的遗传性心律失常引发,有研究[6]探索了此类被称作离子通道病相关蛋白的编码基因所发生的突变及其功能紊乱机制。目前国内外学者研究了长QT 间期综合征、Brugada 综合征和儿茶酚胺敏感性多形性室性心动过速(catecholaminergic polymorphic ventricular tachycardia,CPVT)等遗传性心律失常的致病基因,如涉及长QT 间期综合征主要亚型的KCNQ1 和KCNH2 等基因突变,与Brugada 综合征相关且与长QT 间期综合征存在关联的SCN5A基因,与CPVT 相关的RYR2基因突变等[7]。2019 年国内学者[8]研究USCD 案例发现,编码膜通道蛋白的HCN4基因存在新的无义突变c.1578C>T,进一步验证了心脏离子通道病在USCD中扮演的重要角色。
围绕部分基因突变的致病机制及功能验证开展的研究亦获得了进展,如SCN5A基因,该基因位于人类3 号染色体(3p21),拥有28 个外显子,主要编码心脏钠离子通道NaV1.5 的α 亚基,参与心脏动作电位的形成过程,其突变会引发钠离子通道功能亢进或功能减退,从而导致心脏电生理的异常[9]。通过系统整理SCN5A基因突变的位点、人群特点、临床及实验室表现等特征[10],Meta 分析亦表明携带已知突变基因SCN5A的Brugada 综合征患者具有更早发病、更高比例的心电图异常、更显著的心脏节律传导或心脏动作电位复极化异常及更严重的心脏损伤[11]。最新研究[12]发 现,NaV1.5蛋白脯氨酸-酪氨酸(prolinetyrosine,PY)模体是泛素连接酶Nedd4-2 识别的位点,SCN5A基因突变导致的PY 模体改变将影响NaV1.5 蛋白的降解效率,可能是功能蛋白异常的潜在机制之一。除此之外,利用全基因组关联分析对心电图Q-T 间期特性研究[13],发现其与SCN5A基因顺式作用元件的单核苷酸多态性(single nucleotide polymorphism,SNP)相关,即SCN5A基因启动子、增强子等的SNP 将影响其与反式作用因子的结合强度,进而对最终基因表达产生影响。
1.2 心肌细胞其他结构蛋白的基因变异
随着分子病理学研究的进展,越来越多的基因突变被发现与SCD 相关,并且已不再局限于编码离子通道蛋白的基因。2018 年的研究从一个大家族中发现编码桥粒蛋白(desmoplakin,DSP)基因的框内缺失突变(c.243_251del CTTGATGCG)与该家族连续三代人出现双室心律失常致SCD 相关[14],同年也发现心肌闰盘相关的Xrip 蛋白变异与USCD 相关[15]。随后对SCD的研究又陆续发现了编码核纤层蛋白的LMNA基因的无义突变、NEXN基因非编码区的突变、线粒体DNA 的突变[16-18];其中LMNA基因编码核纤层蛋白A和C(lamin A/C)还参与细胞核完整性的维持及DNA的翻译活动。最新研究[19]发现,LMNA基因K219T 突变会促进lamin A/C 与SCN5A基因增强子的结合,通过阻碍转录起始复合物的形成抑制SCN5A基因的表达,从而影响心肌细胞钠离子内流电流。高通量测序的应用极大提高了可疑致病性基因变异的发现,已有研究[20]通过创建USCD 分子病变谱,实现了20%左右的USCD 分子病因的解析。基于更大样本量开展USCD 的高通量分子病理学研究,有利于更全面阐释致病基因,也将推动系统的功能学验证及猝死机制分析。
致病基因突变研究领域的快速发展极大丰富了候选基因库[21],目前逾百个致病基因的数千个突变位点已见诸报道,将其用于阐释USCD 的尝试也相继开展(表1)。2016 年一项流行病学调查对USCD 案例的4 个基因(KCNQ1、KCNH2、SCN5A和RYR2)进行分子解剖分析,仅9%案例被确诊存在基因变异;在此基础上额外分析了55 个被认为与心脏疾病相关的基因(包括心律失常、长Q-T 间期综合征和心肌病的相关基因),最终有27%的案例可确诊基因突变[1]。2019年开展的SCD 案例调查检测了100 个心脏疾病相关基因,仅在16%的案例中找到基因异常[22];绝大部分案例无法确诊,凸显了候选基因的结构和功能、相互间的复杂作用尚待阐明。
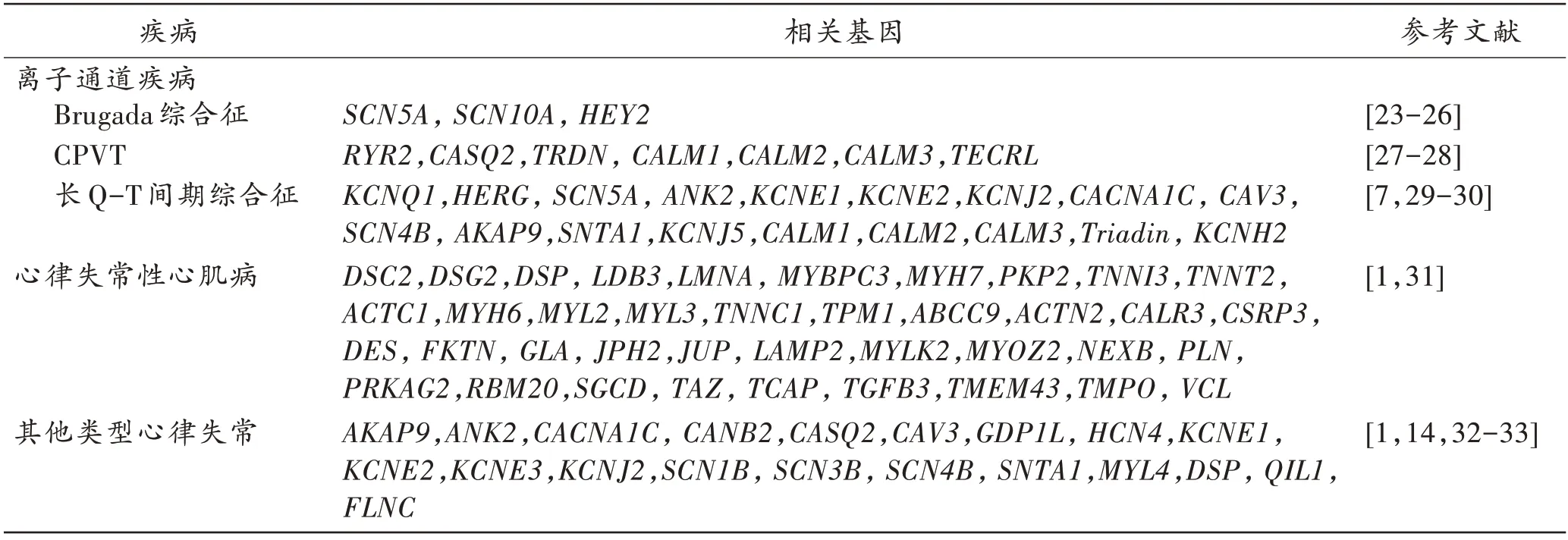
表1 USCD 相关致病基因Tab.1 USCD-related pathogenic genes
2 检测USCD 相关的蛋白质分子
功能基因突变所致异常最终可影响其表达蛋白质的含量,而常规的法医病理学研究已利用免疫组织化学技术直接检测相关功能基因产物的表达情况。心肌细胞的肌钙蛋白Ⅰ、肌球蛋白轻链3、脑利尿钠肽(brain natriuretic peptide,BNP)等应用于鉴定USCD 的价值已被许多研究关注[34-35]。缺血修饰白蛋白(ischemia modified albumin,IMA)、脂肪酸结合蛋白(fatty acid-binding protein,FABP)和窖蛋白在SCD法医学诊断中的应用价值已有学者进行了详细论述[36-37]。此外,核孔蛋白107(nucleoporin 107)在不影响心肌细胞SCN5A基因表达及其mRNA 稳定性的基础上,通过促进核质转移增加SCN5A的表达,在缺血缺氧致心肌损伤中通过增加NaV1.5 表达发挥重要调节作用[38]。
2.1 氧化应激相关蛋白的异常
SCD 相关的临床研究结果为法医病理学分子解剖提供了可靠的依据和思路。机体氧化应激失衡被认为是导致自主神经功能紊乱的机制之一,对不稳定型心绞痛患者进行的临床研究发现,同型半胱氨酸血清水平升高、相关抗氧化物(白蛋白和胆红素)的血清水平降低与低心率变异性(heart rate variability,HRV)有关,而低HRV 往往提示心搏节律异常、心血管抗压能力差和心血管疾病死亡率高[39]。各类研究结果提示[40-41]:机体氧化应激状态可通过改变自主神经功能来影响心肌节律,其相关标志物对SCD 的作用值得深入探讨。另有临床研究[42]印证了血清白蛋白对SCD 的作用,校正其他SCD 的危险因素后,患有低蛋白血症的急性心肌梗死者发生院内SCD 的风险是白蛋白水平正常患者的1.688 倍,并认为血清白蛋白水平与机体炎症负担、冠状动脉病变程度等相关。烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)可抑制线粒体活性氧自由基的产生,同时降低NaV1.5 乙酰化及蛋白激酶C(protein kinase C,PKC)介导的磷酸化水平,共同效应表现为增加细胞钠离子电流,同时揭示了NAD+合成的前体物质具有预防缺血性心律失常的潜在作用[43]。现阶段尚缺乏证实氧化应激相关蛋白可应用于SCD 法医学鉴定的充分依据。
2.2 免疫相关蛋白的异常
关于人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者高发SCD 的现象,研究者发现,HIV 的感染状态及部分治疗药物会大大增加患者发生心律失常的风险,且实验显示细胞因子如肿瘤坏死因子-α 和白介素-1β 的浓度升高会影响心肌细胞的离子流,从而导致心律失常[44]。同时,自身抗体也被认为在USCD 中扮演着重要的角色:由于人乳头状瘤病毒(human papillomavirus,HPV)与心肌细胞膜上肾上腺激素β 受体和乙酰胆碱M 受体存在共同的抗原表位,导致HPV 疫苗接种后会出现对心脏的副作用[45]。免疫相关蛋白在USCD 中的作用及应用价值还有待进一步研究。
基于蛋白含量的检测方法可以综合基因表达之间错综复杂的关系,直接从目标产物表达水平去解读生物学现象。但机体代偿时蛋白质产物的表达存在延后性,因此蛋白质含量检测的方法难以对急性心肌梗死(acute myocardial infarction,AMI)进行准确判断。但死后自身分解也经常干扰结果的判读。因此,上述原因令USCD 的蛋白质检测结果往往需结合其他检测方式所获数据进行综合分析。
3 USCD 相关的RNA 异常
尽管围绕致病基因及其表达产物应用于死因筛查的研究已相继展开,但由于多方面原因仍有相当比例的案件无法解释,促使研究者们开始考虑USCD 中RNA 的作用。基因突变检测阴性的USCD 可能是目标功能基因并未突变,而基因表达过程出现异常(图1)。
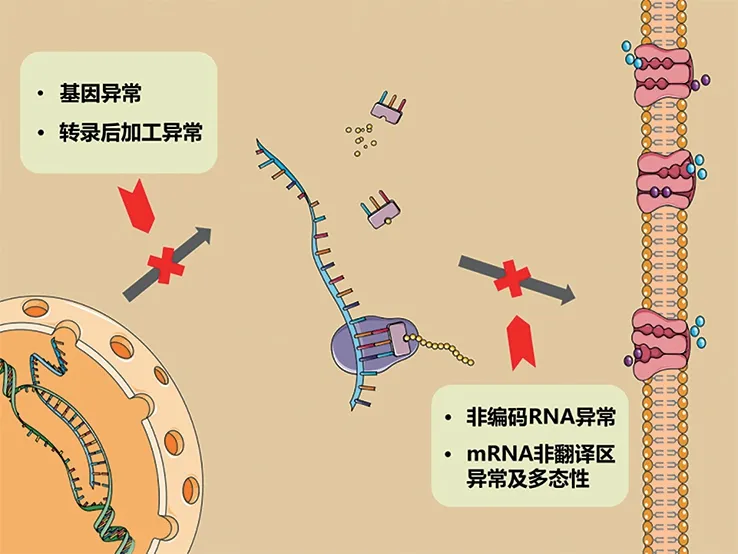
图1 USCD 致病过程相关分子标志物及其功能异常Fig.1 Biomarkers related to the pathogenesis of USCD and their functional abnormalities
3.1 编码RNA 的异常
信使RNA(mRNA)作为DNA 与蛋白质之间的重要中介,在USCD 发生中所扮演的角色不可忽视。2016 年,有学者[46]发现冠状动脉粥样硬化致SCD 的案例中连接蛋白43(connexin 43,Cx43)和闭锁小带蛋白1 的mRNA 水平降低。依据先前对死后组织mRNA 完整性和稳定性的研究结果,GONZÁLEZHERRERA 等[35]选取缺血性心肌损伤和心肌修复相关的5 个基因,通过分析提出了mRNA 表达谱可鉴别心肌缺血情况:以转化生长因子β1 mRNA 升高为主多提示心肌缺血的急性期,并可见于全身性缺氧状况的致死案例,而以肌球蛋白轻链3、基质金属蛋白酶9、血管内皮生长因子A 三者mRNA 升高为主则提示心肌缺血处于修复期,而该假设在具备AMI 病理表现的SCD 案例得到了印证。
除了mRNA 表达水平异常外,其加工过程的异常也与SCD 相关。YIN 等[47-48]通过人群调查发现,桥粒芯蛋白-2 和Ⅰ型胶原蛋白α2 链mRNA 的3’-UT 多态性可影响其与相应miRNA 的结合,最终影响产物蛋白质的表达。利用人类胎儿心肌细胞系R14 的研究发现,RNA 结合蛋白HuR 通过稳定心肌细胞增强因子-2C(myocyte enhancer factor-2C,MEF2C)的mRNA增加其表达,而MEF2C 可促进SCN5A 的转录过程并对其进行正向调节[49]。PARIKH 等[31]则发现,心肌细胞特异性RNA 剪接因子RBM20 的异常会大大增加SCD 的风险。此外,一项研究对无临床表现的Ⅰ型强直性肌营养不良患者发生SCD 后进行RNA 测序分析,发现LDB3基因的mRNA 选择性剪接发生异常[50]。
3.2 非编码RNA 的异常
逐渐深入的分子水平研究也揭示了非编码RNA协助诊断SCD 的价值。微RNA(microRNA,miRNA)通过与基因mRNA 的3'端或5'端非翻译区结合影响其稳定性,实现对基因表达的调控[51]。鉴于SCN5A基因编码区的突变仅能解释15%~30%的Brugada 综合征[52],DAIMI 等[52]对患有Brugada 综合征的家族SCN5A基因外显子、内含子及5'端和3'端的非翻译区进行测序,发现3'端存在突变且与miRNA 相关。TAFTI 等[53]对40 名爱尔兰Brugada 综合征患者进行线粒体转运RNA(transfer RNA,tRNA)突变分析,确定了4 个位点发生突变。非编码RNA,如长非编码RNA(long noncoding RNA,lncRNA)和微小RNA,在冠心病、心律失常、心肌炎、心脏肥大等疾病发生中起到重要作用,特别是研究SCD 相关的几类具有调节功能的非编码RNA 分子在细胞增殖分化和相关病理进程中发挥着重要作用[54]。
新近的研究已不仅关注非编码RNA 与心脏疾病的相关性,而且通过验证多层次生物标记之间的关联网络,试图阐明其背后的致病机制。2018 年的1 项研究[55]通过建立miRNA 在心肌细胞转录组谱的结合位点,发现miR-24 调节SCN5A 表达的作用受SCN5A基因多态性的影响,且与心力衰竭的死亡率相关。HUANG 等[56]发现,LncRNA TTTY15或通过miR-455-5p 参与介导缺氧对心肌细胞的损伤过程。也有研究[57]发现,LncRNA MAGI1-IT1 可通过调节miR-302e 参与心肌肥大过程,前述的研究结果将有助于揭示miRNA 应用于法医分子病理学鉴定的价值。
国内有学者提出联合miRNA 与其相关基因的表达作为诊断SCD 的客观指标。李国良等[58]发现SCD案例的心肌组织中miR-17 可能通过调节缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)与STAT3的表达参与猝死过程,与非心脏疾病的样本相比呈现出miR-17 和HIF-1α 高表达、STAT3 低表达,并提出联合应用几种标志物诊断SCD。另外的研究[59]也发现miR-21 与RECK、Smad基因存在相关性,在SCD 心肌组织中呈现miR-21 高表达、RECK 和Smad7 低表达的情况。因此,联合基因、miRNA 和相关蛋白表达情况构建表达谱可为分子解剖应用于法医病理学鉴定提供新思路。
4 总结
由于USCD 在尸体检验及常规组织病理学检测缺乏特征性形态学表现,利用分子病理学方法阐释USCD 机制有望取得重要突破,也被视为探究客观指标进行准确鉴定的关键途径。国内外研究USCD 相关基因突变及其鉴定应用已获显著进展,但其覆盖度和可解释性存在的不足仍使USCD 的法医病理学鉴定实践面临困难,亟待从多方面解析USCD 的复杂机制,进而实现系统的死因归类并建立统一的鉴定标准。当前以编码离子通道蛋白的基因突变为主的候选基因检测和分子解剖技术已初具基础,深入研究USCD 相关的RNA 和功能蛋白也有了可观发现,借助分子生物学技术拓展的分析能力,整合多类型生物标志物的分子病理检测辅助于法医精准诊断与鉴定的应用价值将逐步体现。
