团簇Mo2S4的催化析氢活性计算分析
2022-01-07方志刚吕孟娜毛智龙
王 倩 方志刚 吕孟娜 许 友 毛智龙
(辽宁科技大学 化学工程学院,鞍山 114051)
引 言
氢能源是能源危机爆发后的一大研究热点,其具有能量转化率高、产物可回收利用等优点。目前氢能源的主要获取途径仍为水的电解析氢,已有研究报道[1-3],贵金属单质Pt是良好且高效的电催化析氢材料,Pt纳米粒子可用于燃料电池及电解器电解水裂解等方面,但由于自然资源稀缺和价格高昂等原因导致其不能满足工业生产的需要,无法得到广泛的应用。因此,人们现在致力于寻找析氢水解能力强、价格低、催化活性好且自然界含量高的非贵金属催化剂作为贵金属Pt的替代品[4-6]。
过渡金属掺杂非金属作为电催化析氢的催化剂已被证明具有良好的催化效果,包括过渡金属硫化物、过渡金属磷化物、过渡金属硼化物等[7-11]。其中,不同形态的过渡金属硫化物材料(如纳米管、纳米团簇、纳米粒子等)由于具有成本低、自然界含量高、催化性能优良等优点而得到广泛应用[12-13]。在过渡金属硫化物中,Mo-S体系由于其独特的空间结构特征而受到人们的关注。Wang等[14]提出,由于Mo原子上的未配对电子,小尺寸(MoS2)n(n=1~2)倾向于具有磁性,但对(MoS2)n的催化性能并未说明。Li等[15]提出,MoS2由于其丰富的不饱和S边界,有着优异的内禀活性,构建多相界面是一种有效提高MoS2电催化析氢性能的策略。Swain等[16]认为,虽然MoS2具有丰富的活性边缘位置,但MoS2在碱性与中性溶液中的催化性能不能达到预期效果,限制了MoS2的广泛应用。Ruffman等[17]研究了碳基调节MoS2基面与边缘位置的吸附性能,探究在不同碳载体的MoS2的基面和边缘上氢吸附能的趋势,以用于筛选新的候选催化剂载体,为改进现有MoS2催化剂提供了有用的参考。Chen等[18]采用原位水热和化学气相沉积相结合的方法,在碱性条件下合成了具有优异析氢反应(HER)和析氧反应(OER)性能的C-N-MoS2/CC-700催化剂,发现氯化萘的沉积诱导了MoS2中的不饱和硫缺陷和Mo—N键形成,C-N-MoS2/CC-700表面将暴露出更多的催化活性位点,这对电催化水分解非常有利。Jayabal等[19]总结了MoS2基电催化剂在HER和氧还原反应(ORR)方面的优势,讨论了MoS2纳米片在催化活性方面面临的主要障碍,提出了提高MoS2基材料催化活性的策略和潜在途径,从而有助于人们更好地理解二维层状MoS2基催化剂的高电催化活性。以上研究主要集中在Mo-S体系中MoS2的催化性能方面,而针对Mo2S4催化活性的研究甚少,因此本文以团簇Mo2S4作为研究对象,对其稳定性和催化活性进行理论计算及分析,得出催化活性较好的构型,以期所得的结论可以为Mo-S体系的相关研究提供参考。
1 计算方法与催化水解析氢反应机理
1.1 计算方法
根据密度泛函理论[20],在较高量子化学计算水平B3LYP/Lanl2dz下[21],对Mo、S原子采用含相对论矫正的有效核电势价电子从头计算基组[22],即采用18-eECP的双ξ基组(3s、3p、3d/2s、2p、2d)加double zeta优化,并在S原子上添加极化函数ξS.d=0.55[23]。对根据拓扑学原理[24]所设计的团簇Mo2S4异构体进行全参数优化计算与虚频验证,所有优化计算过程均采用启天M4390计算机上的Gaussian 09程序完成[25],前线轨道图由Gauss View软件绘制完成。在此量化水平下,优化收敛均方根位移小于0.001 2,最大位移小于0.001 8,均方根作用力小于0.000 3,最大作用力小于0.000 45。
1.2 催化水解析氢反应机理
以团簇Mo2S4(以M表示)为模拟对象,其催化水解析氢的反应机理为[26]
第一步 M+H2O+e-→M-Hads+OH-
第二步 有两种途径:
M-Hads+e-+H2O→M+H2+OH-
2M-Hads→2M+H2
其中Hads表示吸附在团簇Mo2S4上的H原子,下文以M-Hads表示吸附H原子的(Mo2S4)-Hads模型。
2 结果与讨论
2.1 团簇Mo2S4的优化构型及热力学稳定性分析
根据热力学稳定性,排除异构体中能量较高及含虚频的不稳定构型后,得到10种稳定构型,其中单重态和三重态各5种。以能量最低的构型1(3)为参考,设其能量为0 kJ/mol,并按照各稳定构型相对能量的高低排序,绘制出如图1所示的各稳定构型图。根据式(1)和(2)计算团簇Mo2S4各优化构型的结合能EBE(Mo2S4)和吉布斯自由能变ΔG(Mo2S4),结果列在表1中。
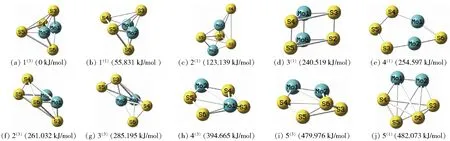
上角标括号内的数字表示构型的自旋多重态,构型后括号内的数值(如55.831 kJ/mol)表示构型的相对能量。
EBE(Mo2S4)=2EZPE(Mo)+4EZPE(S)-EZPE(Mo2S4)
(1)
ΔG(Mo2S4)=G(Mo2S4)-2G(Mo)-4G(S)
(2)
式中,EZPE(Mo)、EZPE(S)、EZPE(Mo2S4)分别表示Mo原子、S原子、团簇Mo2S4的零点振动能;G(Mo)、G(S)、G(Mo2S4)分别表示Mo原子、S原子、团簇Mo2S4的吉布斯自由能。G(Mo)=-176 665.180 kJ/mol;G(S)=-26 397.780 kJ/mol;EZPE(Mo)=-176 621.909 kJ/mol;EZPE(S)=-26 355.948 kJ/mol;EZPE(Mo2S4)和G(Mo2S4)的数据见表1。EBE(Mo2S4)越大,团簇Mo2S4的稳定性越好;ΔG(Mo2S4)越大,反应的自发程度越小。由表1可知,构型1(3)的EBE(Mo2S4)最大,ΔG(Mo2S4)最小,故其热力学稳定性最好。同理,结合EBE(Mo2S4)与ΔG(Mo2S4)分析其他稳定构型,得出其稳定程度的大小顺序为:1(3)>1(1)>2(1)>3(1)>4(1)>2(3)>3(3)>4(3)>5(3)>5(1)。整体上,单重态构型的稳定程度排序靠前,故在热力学上单重态的稳定性相较于三重态更好,单重态构型反应的难度较大。

表1 团簇Mo2S4优化构型的能量参数
2.2 团簇Mo2S4催化水解析氢的前线轨道
2.2.1团簇Mo2S4的HOMO图与水分子的LUMO图
根据能量的高低可将分子周围分布的电子云划分为不同的分子轨道,由前线轨道理论(frontier molecular orbital theory,FMO)[27]可知,HOMO(highest occupied molecular orbital)是能量最高、电子所受束缚最小的最高占据轨道,LUMO(lowest unoccupied molecular orbital)是能量最低、电子所受束缚最大的最低未占据轨道。在双分子反应过程中,分子轨道发生相互作用,优先起作用的是前线轨道,电子从HOMO流向LUMO。当二者按照正与正、负与负的叠加方式相互接近,即二者对称性较好时,反应较易进行。此外,由于团簇Mo2S4三重态构型分子轨道内是2个自旋不配对的α电子(自旋向上)和β电子(自旋向下),而单重态构型的电子自旋成对,无自旋向上与自旋向下之分,故为了更好地分析催化析氢反应活性,现同时列出团簇Mo2S4各三重态构型的α-HOMO与β-HOMO图以及单重态的HOMO图与水分子的LUMO图,如图2所示。团簇Mo2S4催化水解析氢时,电子从团簇的HOMO流向水分子的LUMO,团簇Mo2S4与水分子中的氢原子结合,形成M-Hads结构模型,即完成了催化析氢反应机理中的第一步。从图2可以看出,团簇Mo2S4与水分子的构型分别被深浅程度不同的2种阴影部分所覆盖,其中浅色阴影部分代表轨道波函数相位为正,深色阴影部分代表轨道波函数相位为负。二者相互覆盖的范围与面积表示电子在前线轨道出现时的离域空间,即催化水解析氢反应的活跃区域。
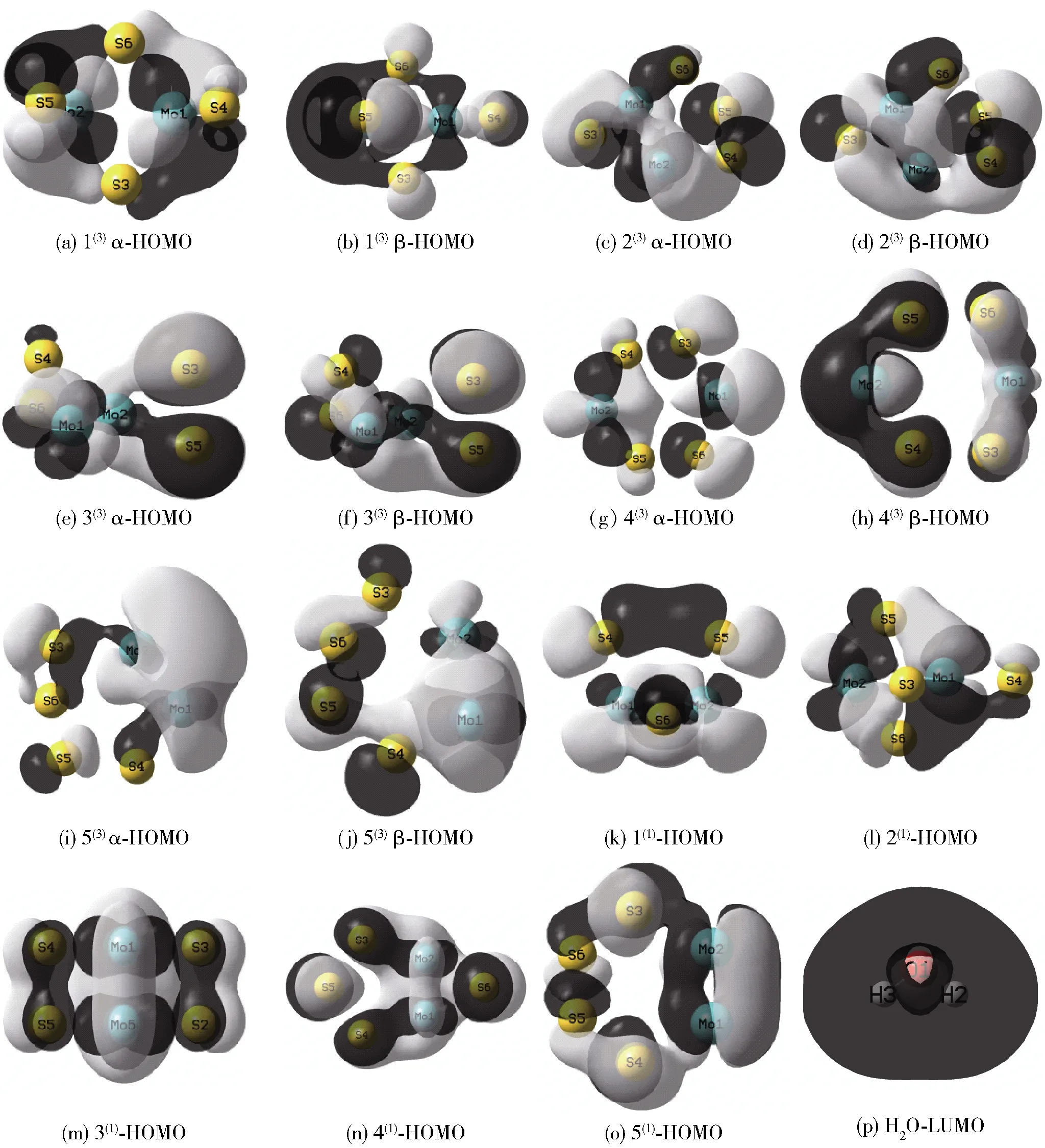
图2 团簇Mo2S4的HOMO图与H2O分子的LUMO图
首先对水分子的LUMO图进行分析,其浅色阴影仅为内部氧原子周围一小部分,水分子外围部分均被深色阴影所包围,故在水分子的LUMO中,轨道波函数为负的电子离域空间较大。再对团簇Mo2S4各稳定构型的HOMO图进行分析,整体上来看,团簇Mo2S4的稳定构型的对称性较好,深色区域与浅色区域相当,当水分子的LUMO深色区域与团簇Mo2S4的HOMO深色区域进行同号重叠,即二者轨道波函数相位为负的部分重叠时,意味着二者较易完成轨道间电子的转移与原子间的有效成键,氢原子附着于团簇上,即完成反应机理中的第一步。进一步观察三重态构型的HOMO图,可以看出同一构型的β-HOMO的深色区域均大于α-HOMO的深色区域,并且除了构型1(3)的α-HOMO图与β-HOMO图均具有良好的对称性外,其余构型的β-HOMO图的对称性均优于α-HOMO图,这在一定程度上说明整体上三重态构型的β-HOMO对团簇Mo2S4的贡献比α-HOMO大,在催化水解析氢过程中,团簇Mo2S4倾向于由团簇的β-HOMO流向水分子的LUMO。相较于三重态构型的HOMO图,单重态构型的HOMO图的对称性均较好,但深色阴影部分与浅色阴影部分重叠得比较多,而浅色阴影不利于电子的流动与原子间的成键,故当团簇Mo2S4与水分子的LUMO相互重叠时,电子较难从Mo2S4流向水分子,即吸附氢原子生成M-Hads更困难,因此三重态构型催化水解析氢的能力相较于单重态构型更占优势。
2.2.2团簇Mo2S4与水分子反应的前线轨道能级差
从2.2.1节中分析得到的关于反应难易程度的结论,仅是从团簇Mo2S4与水分子的电子离域空间大小方面进行比较分析,故具有一定的局限性,并不能准确地比较出团簇Mo2S4各稳定构型的催化活性大小。同时,由前线轨道理论可知,当团簇Mo2S4与水分子的轨道能级差ΔE越小,电子越容易由HOMO流向LUMO,反应越易发生,故根据能级参数计算出各构型与水分子的轨道能级差,结果如表2所示。所有单、三重态构型的HOMO与水分子的LUMO的能级差范围较小(580~676 kJ/mol),其中构型5(3)的ΔE最小(580 kJ/mol),说明构型5(3)的电子从HOMO轨道流向水分子的LUMO轨道,从而使团簇Mo2S4吸附氢原子,即完成反应机理的第一步(形成M-Hads)最易发生。同理,构型4(1)的ΔE最大(676 kJ/mol),完成反应机理的第一步最难发生。将各优化构型按能级差大小排序可得:4(1)>3(1)>1(3)>2(3)>1(1)>2(1)>5(1)>3(3)>4(3)>5(3),可以看出,相较于单重态构型,在整体上三重态构型的能级差排序靠后,而能级差较小时,反应更易发生,故三重态构型完成析氢反应机理的第一步更容易,这与2.2.1节的讨论相符。
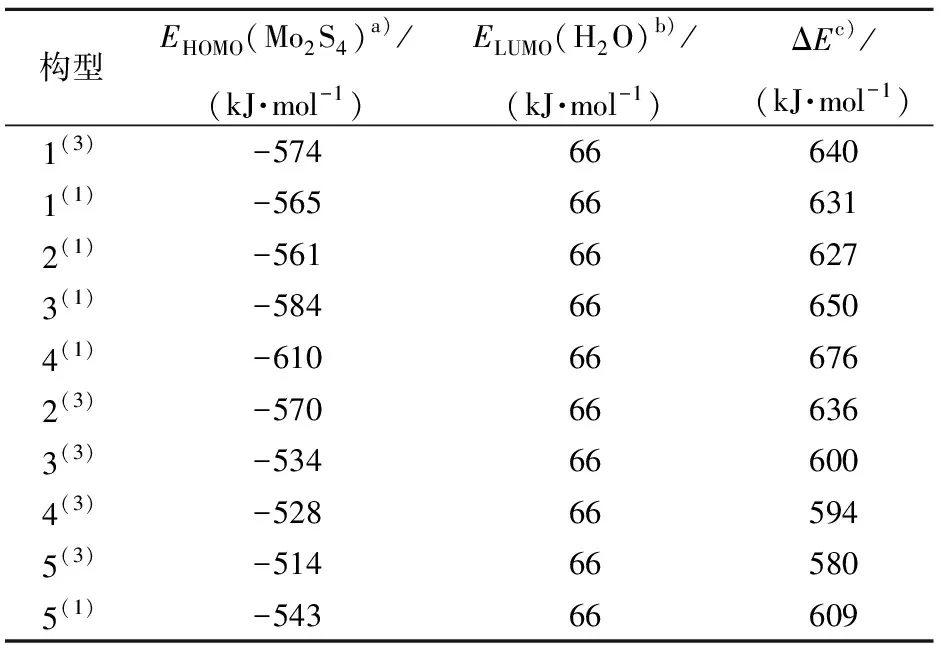
表2 团簇Mo2S4与H2O反应的前线轨道能级差ΔE
2.3 (Mo2S4)-Hads的解吸过程分析
当第一步反应完成后,团簇模型将变成(Mo2S4)-Hads(即M-Hads)型。各优化构型吸附氢原子后的M-Hads空间结构如图3所示。由图3可知,团簇Mo2S4与水分子的氢原子的吸附位点都位于金属原子Mo上,并且相较于图1,各优化构型在吸附氢原子后都有不同程度的变形。在2.2节中,我们对吸附氢原子进行的讨论仅是针对催化水解析氢的第一步反应,而第二步反应的解吸过程同样重要,现对解吸过程的反应进行讨论。
2.3.1(Mo2S4)-Hads与H2O的前线轨道能级差
2.2节主要从团簇优化构型的HOMO图与水分子的LUMO图的角度定性地进行了讨论,同时也从轨道能级差的角度定量地进行了分析。通过前面的分析可知,从轨道能级差的角度分析更具有客观性,故列出M-Hads的HOMO与水分子的LUMO的能级差ΔE,如表3所示。由表3可知,(5(3))-Hads与水分子的能级差最小(606 kJ/mol),故其第二步反应最易发生,结合2.2.2节的讨论可知,其原始构型团簇Mo2S4吸附氢原子的反应(第一步反应)也最易发生,故构型5(3)最易发生催化水解析氢反应。
2.3.2(Mo2S4)-Hads的结合能
在M-Hads与水分子进一步反应生成M与H2的过程中,当M-Hads的结合能较小时,即过渡中间体M-Hads的稳定性较弱时,氢原子易脱离M从而析出氢气。根据式(3)计算M-Hads各优化构型的结合能EBE(M-Hads),结果列在表4中。
EBE(M-Hads)=2EZPE(Mo)+4EZPE(S)-EZPE(M-Hads)
(3)
式中,EZPE(M-Hads)为M-Hads的零点振动能,其数据见表4。由表4可知,(5(3))-Hads模型的结合能最小,即(5(3))-Hads中间体模型的稳定性最弱,析氢机理的第二步反应最易进行。M-Hads各优化构型按照结合能的相对大小排序:(5(3))-Hads<(5(1))-Hads<(3(1))-Hads<(2(3))-Hads<(3(3))-Hads<(4(1))-Hads<(1(3))-Hads<(4(3))-Hads<(2(1))-Hads<(1(1))-Hads。由表3可知,(5(3))-Hads中间体模型与水分子的能级差最小(606 kJ/mol),(5(3))-Hads的解吸过程最易进行,这与结合能所讨论的结果一致。此外,由表2可知,构型5(3)转化为(5(3))-Hads中间体模型的能级差最小(580 kJ/mol),说明构型5(3)同样能较好地吸附氢原子。以上结果表明,构型5(3)无论是在第一步反应还是在第二步反应时,均能较易进行。同理可知,构型4(1)转化为(4(1))-Hads中间体模型的能级差最大(676 kJ/mol),构型4(1)的结合能与(4(1))-Hads中间体模型解吸生成氢气的结合能均较大,说明在催化水解析氢反应过程中,构型4(1)的第一步反应与第二步反应均较难进行,故构型4(1)的催化水解析氢活性较差。

表4 团簇Mo2S4吸附氢原子后的零点振动能和结合能
3 结论
本文对团簇Mo2S4进行全参数的优化计算及虚频验证,根据前线轨道理论对计算所得的10种稳定构型进行催化析氢反应活性的计算分析,从热力学稳定性和前线轨道能级的角度分析了团簇Mo2S4的催化水解析氢过程,进而确定了析氢活性最好的团簇Mo2S4构型。结果表明,单重态构型的热力学稳定性高于三重态构型,三重态构型的催化水解析氢能力相较于单重态构型更占优势;构型5(3)在吸附氢原子和解吸氢原子的过程中都表现出了较好的反应活性,而构型4(1)在水解析氢机理的两步反应中活性均较差。以上结论可以为Mo2S4材料用于催化水解析氢反应的宏观实验提供一定的理论依据。
